绿原酸对脂多糖诱导的急性肾损伤小鼠的保护作用
徐静红,毛艳菲
(浙江省丽水市中心医院病区药房,丽水 323000)
脓毒症是一种常见、复杂且致命的感染并发症,通常由免疫反应释放大量的炎性细胞因子引起[1]。急性肾损伤(acute kidney injury,AKI)是脓毒症的严重并发症,有研究发现其由脂多糖(lipopolysaccharides,LPS)所致[2]。脂多糖诱导疾病模型是阐明脓毒症AKI机制和潜在治疗方法的常用动物模型之一。脂多糖可诱导TLR4信号通路,进而诱导核因子κB(nuclear factor kappa-B,NF-κB)活化和炎性细胞因子,如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)和白细胞介素-1β(interleukin -1β,IL-1β)[3]。这些炎症细胞因子可能导致肾损伤,使肾小球中性粒细胞浸润和单核细胞转移,特别是肾小球系膜周围区域[4]。因此,通过抑制炎症细胞因子产生可以有效治疗肾损伤。据报道,植物多酚对多种炎症性疾病有抗氧化和抗炎作用[5],其抗氧化和抗自由基性能作用于酶活化、基因表达、信号转导途径,进而阻止或延迟炎症性疾病发生。已有研究表明,多酚可以分解2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]自由基,清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基和超氧自由基,抑制低密度脂蛋白(low-densitylipoprotein,LDL)氧化,螯合铜离子,还原铁离子[6-7]。绿原酸(chlorogenic acid,CGA)是最常见的多酚之一,具有多重药理活性、强效免疫保护、抗炎、抗菌和抗氧化特性[8]。此外,有研究发现绿原酸具有预防脂多糖诱导小鼠急性肺损伤的作用[9]。研究发现,绿原酸可以减轻链脲佐菌素诱导的糖尿病肾病大鼠的肾损伤。但绿原酸对脂多糖诱导AKI的保护作用报道较少见。笔者在本研究中探讨绿原酸对脂多糖诱导小鼠AKI的治疗作用。
1 材料与方法
1.1试剂及仪器 绿原酸购自中国食品药品检定研究院(批号:110753-201415,含量≥98%);脂多糖(批号:L-2880)、磷酸盐缓冲溶液(phosphate buffer saline,PBS,批号:P5368)购自Sigma 公司;血肌酐( serum creatinine,Scr,批号:T17P128B)、血尿素氮(blood urea nitrogen,BUN,批号:EIABUN)、TNF-α(批号:168235001)、IL-6(批号:146735017)和IL-1β 酶联免疫吸附测定(ELISA)(批号:147442015)试剂盒均购自eBioscience 公司;增强化学发光(enhanced chemiluminescence,ECL)试剂购自Milipore公司(批号:WBKLS0100);细胞核蛋白与细胞浆蛋白抽提试剂盒(批号:P0028)、多功能电泳仪(型号:EEP102)购自中国碧云天生物技术有限公司;连续光谱扫描式酶标仪(型号:SpectraMax Plus384)购自美谷分子仪器有限公司。
1.2动物与处理方法 无特定病原体级(SPF)雌性C57BL/6小鼠,6~8周龄,体质量18~22 g,购于维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006,置于温度(22±2)℃,相对湿度50%~60%,12 h循环照明的环境中适应性饲养7 d,自由摄食和饮水。
采用随机数字表法将50只小鼠随机分成5组,每组10只:对照组、LPS组、LPS+CGA不同剂量(5,10,20 mg·kg-1)组。LPS组腹腔注射LPS溶液10 mg·kg-1;LPS+CGA组给予LPS1 h后腹腔注射0.9%氯化钠溶液配制的绿原酸溶液。对照组腹腔注射PBS 20 mL·kg-1。在LPS刺激后24 h,处死小鼠并采集血液和肾组织。
1.3组织病理学检查 10%甲醛固定肾组织并切片,石蜡包埋,苏木精-伊红(HE)染色,光学显微镜下观察肾组织病理变化。采用Jablonski半定量评分标准评价肾损伤程度[10],0分为正常组织;肾小管损伤面积<5%为1 分;5%~25%为2 分;>25%~75%为3 分;> 75%为4 分。
1.4Scr和BUN测定 按照试剂盒说明书检测Scr和BUN。
1.5TNF-α、IL-6和IL-1β的测定 根据说明书,采用ELISA试剂盒测定小鼠血清和肾组织TNF-α、IL-6和IL-1β水平。
1.6Western bloting分析 使用细胞核蛋白与细胞质蛋白抽提试剂盒提取肾脏组织蛋白质。12%聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)分离总蛋白样品(30 μg),转移到聚偏氟乙烯膜。室温下5%脱脂乳封闭2 h,将封闭的膜与抗Toll样受体4(Toll like receptor 4,TLR4)(1:1000),髓样分化因子88(myeloid differentiation factor 88,MyD88)(1:1000),核因子κBp65(nuclear factor kappa-Bp65,NF-κBp65)(1:1000),磷酸化核因子κB抑制蛋白(phospho-inhibitor ofNF-κB,p-IκB)(1:1000),核因子κB抑制蛋白(inhibitor of NF-κB,IκB)(1:1000)和β-肌动蛋白(β-actin)(1:2000)一抗4 ℃孵育过夜。将膜与二次抗体室温孵育1 h,ECL试剂显现免疫反应条带。
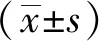
2 结果
2.1肾组织病理特征 见图1。LPS组肾脏病理损伤明显,肾小管上皮细胞浸润,肾囊腔扩张,管状结构破坏,上皮细胞坏死,坏死细胞进入腔内小管。与LPS组比较,LPS+CGA 5,10和20 mg·kg-1组肾损伤明显改善(P<0.05或P<0.01),且呈剂量依赖性。
2.2Scr与BUN测定结果 与对照组比较,LPS组血清Scr和BUN显著升高(P<0.01);与LPS组比较,LPS+CGA各剂量组血清Scr与BUN显著降低(P<0.05或P<0.01),见图2。
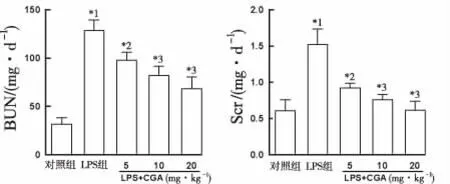
2.3TNF-α、IL-6和IL-1β测定结果 与对照组比较,LPS组血清和肾脏TNF-α、IL-6和IL-1β显著增加(P<0.01)。与LPS组比较,LPS+CGA各剂量组血清和肾脏TNF-α、IL-6、IL-1β等含量下降(P<0.05或P<0.01),且该作用呈剂量依赖性(图3)。
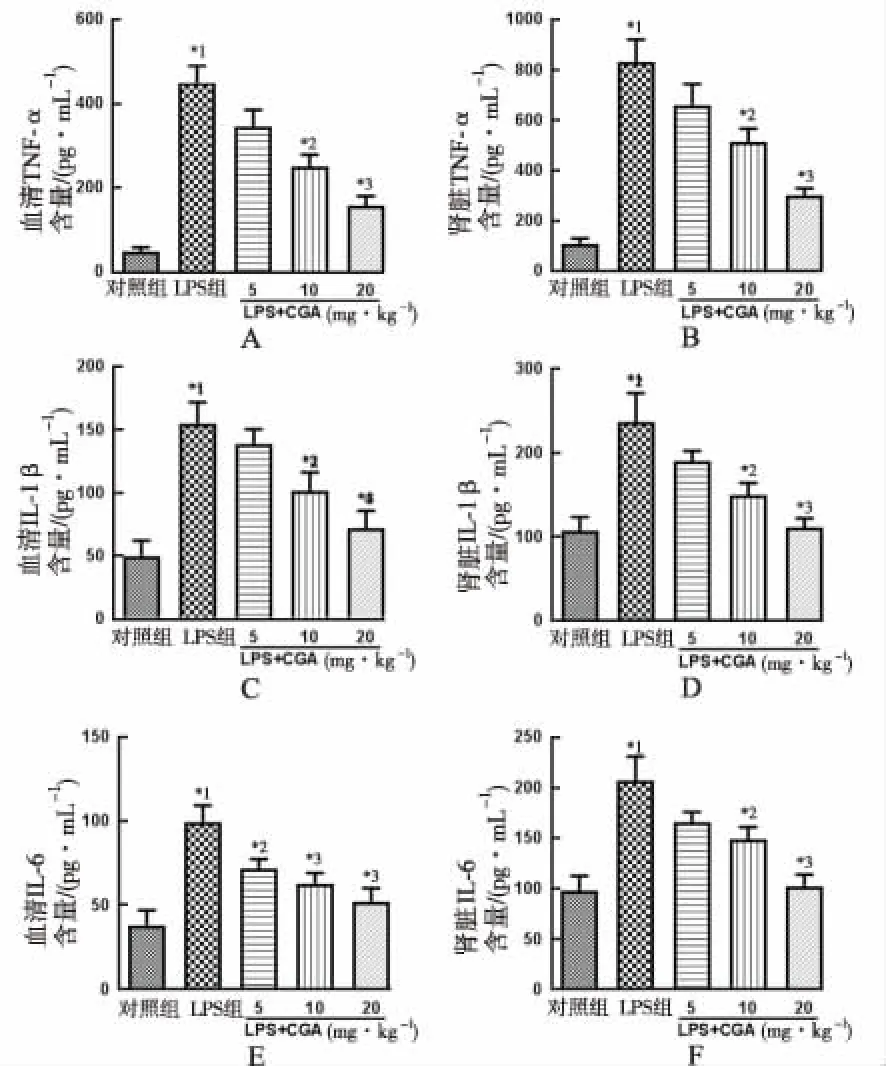
2.4TLR4/NF-κB信号通路测定结果 见图4,与对照组比较,LPS组诱导NF-κB活化和IκB分解,明显增加TLR4和MyD88表达(P<0.05或P<0.01);与LPS组比较,LPS+CGA各剂量组NF-κB p65和IκB磷酸化显著抑制,且剂量依赖性地抑制LPS诱导TLR4和MyD88表达(P<0.05或P<0.01)。

A.对照组;B.LPS组;C.LPS+CGA 5 mg·kg-1组;D.LPS+CGA 10 mg·kg-1组;E.LPS+CGA 20 mg·kg-1组;F.肾损伤评分;与对照组比较,*1P<0.01;与LPS组比较,*2P<0.05,*3P<0.01
图1 5组小鼠肾组织病理学特征(HE,×200)
A.control group; B.LPS group; C.LPS+CGA 5 mg·kg-1group; D.LPS+CGA 10 mg·kg-1group; E.LPS+CGA 20 mg·kg-1group; F.renal injury score; compared with control group,*1P<0.01; compared with LPS group,*2P<0.05,*3P<0.01
Fig.1Pathologicalfeaturesofrenaltissueinfivegroupsofmice(HEstaining,×200)
A.BUN水平;B.血肌酐水平;与对照组比较,*1P<0.01;与LPS组比较,*2P<0.05,*3P<0.01
图2 5组小鼠BUN与Scr测定结果
A.BUN level; B.serum creatinine level; compared with control group,*1P<0.01; compared with LPS group,*2P<0.05,*3P<0.01
Fig.2DeterminationresultsofBUNandScrinfivegroupsofmice
3 讨论
AKI常伴有严重并发症,直接影响其他系统,并导致危重患者多器官功能衰竭[11]。严重并发症导致AKI患者死亡率达到30%[12]。因此迫切需要探索新的治疗途径。绿原酸广泛存在于中草药,具有很强的抗炎作用[13]。本实验中,与对照组比较,LPS组肾组织病理学及血清生化指标有明显差异,肾小球结构被破坏,肾小管上皮细胞变性,肾小管和肾间质细胞存在严重的细胞内灌流和充血。此外,LPS组血Scr和BUN水平升高,肾功能不全。给予不同剂量绿原酸后,小鼠肾组织病理学变化减轻,血BUN和Scr水平降低。提示绿原酸可减轻脂多糖诱导的AKI。
脂多糖是导致脓毒症或AKI的关键因素[14]。据报道,脂多糖所致炎症细胞因子在AKI发病机制中发挥重要作用[15]。在脂多糖诱导AKI过程中,TNF-α、IL-1β和IL-6在血清和肾组织升高,脂多糖能诱导AKI发病相关炎症细胞因子产生。越来越多的证据表明,抑制上述细胞因子可减轻AKI[16]。本研究结果表明,绿原酸呈剂量依赖性地抑制脂多糖诱导的TNF-α、IL-1β和IL-6产生,抑制这些炎症细胞因子的释放是绿原酸对脂多糖诱导AKI的保护机制。
为进一步研究绿原酸抑制炎症细胞因子产生的机制,本研究探索了绿原酸对TLR4/NF-κB信号通路活化的影响,该通路被认为是肾脏炎症主要因素。脂多糖所致TLR4活化通过诱导炎症细胞因子产生而传导初期损伤,与引发炎症细胞因子TNF-α、IL-1β和IL-6表达相关的NF-κB信号通路密切相关,已有证据表明减少TLR4和NF-κB介导的炎症反应在各器官中有抵抗AKI的保护作用。
笔者在本实验采用脂多糖诱导小鼠模型,研究绿原酸对AKI的保护机制,结果表明绿原酸可呈剂量依赖性地抑制磷酸化IκB的表达和NF-κB p65活性。此外,Western bloting分析研究MyD88和TLR4在肾组织中的表达,发现脂多糖刺激导致MyD88和TLR4的显著表达,而绿原酸可减弱MyD88和TLR4的活化。
A.血清TNF-α含量;B.肾脏TNF-α含量;C.血清IL-1β含量;D.肾脏IL-1β含量;E.血清IL-6含量;F.肾脏IL-6含量;与对照组比较,*1P<0.01;与LPS组比较,*2P<0.05,*3P<0.01
图3 5组小鼠血清和肾脏TNF-α、IL-6、IL-1β含量测定结果
A.serum TNF-α content; B.renal TNF-α content; C.serum IL-1β content; D.renal IL-1β content; E.serum IL-6 content; F.renal IL-6 content; compared with control group,*1P<0.01; compared with LPS group,*2P<0.05,*3P<0.01
Fig.3DeterminationresultsoftheserumandrenallevelsofTNF-α,IL-6andIL-1βinfivegroupsofmice
实验结果表明,绿原酸可能通过抑制TLR4/NF-κB信号通路的活化来减少脂多糖诱导AKI的促炎症细胞因子。
与对照组比较,*1P<0.01,*2P<0.05;与LPS组比较,*3P<0.05,*4P<0.01
图4 5组小鼠TLR4/NF-κB信号通路测定结果
Compared with control group,*1P<0.01,*2P<0.05; compared with LPS group,*3P<0.05,*4P<0.01
Fig.4DeterminationresultsofTLR4/NF-κBsignalingpathwayinfivegroupsofmice

