仿制药一致性评价中人体生物等效性试验豁免申请的进展及辅料影响考量点
廖萍,朱嘉,张景辰,吴浩,姜红
(1.上海药品审评核查中心,上海 201203;2.湖北省药品监督检验研究院,武汉 430075)
自国家原食品药品监督管理总局于2016年5月发布《人体生物等效性试验豁免指导原则》,并于2018年5月及2018年7月分别发布可豁免或简化人体生物等效性(bioequivalence, BE)试验品种第一批清单和第二批征求意见稿,以及2018年7月发布征求289种基本药物目录中的国内特有品种评价建议以来,有超过67个品种有望通过BE豁免申请简化评价流程,减少不必要的健康人体药物暴露,降低评价费用,加快评价进程。笔者对BE豁免申请与批准现状进行调研,并针对BE豁免申请中的难点之一——基于生物药剂学分类系统(Biopharmaceutics Classification System,BCS)的豁免申请中辅料的种类与用量的影响进行分析,现报道如下。
1 仿制药一致性评价中BE豁免申请与批准现状
据不完全统计,截至2018年9月24日,国家药品审评中心(Center for Drug Evaluation, CDE)共受理一致性评价申请372份,其中BE豁免申请31份,占比8.3%,涉及12个品种,见图1。目前仅3家蒙脱石散生产企业申请BE豁免获得批准。
经对企业的走访调研,企业BE豁免申请和获批品种数量不多的主要原因有如下几点:第一,目前公布的豁免清单品种大多为基本药物,上市时间长,品种老,利润空间小,企业不愿意进行再次研发投入,拟放弃品种再评价;第二,BE豁免在国内的研究基础还比较薄弱,企业对豁免政策不了解,对所需技术要求不能充分把握;第三,BE豁免研究技术要求高、难度大。如企业对于品种是否满足BE豁免条件的分析能力不足,没有有针对性地开展辅料种类、用量等对于影响药物吸收的方式和原理研究,申报资料无法满足BE豁免的评价要求。笔者针对以上研究过程中的难点问题展开分析和讨论。
2 基于BCS分类的BE豁免中辅料种类与用量的要求
在基于BCS分类的BE豁免申请中,在确定了原料药的BCS分类后,制剂处方组成中的辅料种类与用量是重要考量点,将决定BE豁免申请能否被药监部门接受。
国际人用药品注册技术协调会(International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)指导原则《M9:基于生物药剂学分类系统的生物等效性豁免》进入第3阶段征求意见,对企业普遍关心的BCS分类标准、BE豁免标准及所需支持证据进一步细化,并在ICH成员国之间达到协调。“若药物满足溶解性和渗透性标准(BCSⅠ类和Ⅲ类),药品是具有全身作用的普通口服剂型,并且剂型与参比制剂药学等同,则该药品适用于基于BCS的生物等效性豁免”[1]。
基于BCS分类的BE豁免要求受试制剂与参比制剂的辅料差异不能影响药物体内吸收,即吸收速率和吸收程度。在制剂中存在的一些“活性”辅料,能改变药物生物利用度和(或)生物等效性。特别是可能对BCSⅢ类药物的生物等效性产生较大影响。这些“活性”辅料对药物体内吸收的影响包括溶解性、胃肠动力、膜完整性、生理pH值、通过时间及包括转运机制在内的肠道渗透性。

A.维生素B6片;B.碳酸氢钠片;C.氯化钾颗粒;D.蒙脱石散;E.聚乙二醇4000散;F.对乙酰氨基酚片;G.盐酸普萘洛尔片;H.氟康唑片;I.拉米呋定片;J.盐酸尼替丁胶囊;K.异烟肼片;L.氨基葡萄糖类口服固体制剂;M.甲钴胺片;N.左乙拉西坦片
图1 仿制药一致性评价中BE豁免申请情况
A.vitamin B6tablets;B.sodium bicarbonate tablets;C.potassium chloride granules;D.montmorillonite powder;E.polyethylene glycol 4000 powder;F.paracetamol tablets;G.propranolol hydrochloride tablets;H.fluconazole tablets;I.lamivudine tablets;J.nitidine hydrochloride capsules;K.isoniazid tablets;L.aminoglucosamine oral solid preparation;M.mecobalamin tablets;N.levetiracetam tablets
Fig.1BEwaiverapplicationinconformityevaluationofgenericdrugs
在ICH M9中对BCSⅠ类和BCSⅢ类药物的可允许辅料量差异进行了明确规定。对于BCSⅠ类药物,允许辅料存在种类和用量差异,但对于可能影响吸收的辅料,种类应相同且用量相似(即用量应在参比制剂相应辅料用量的±10.0%范围内)。BCSⅢ类药物,所用辅料应种类相同且用量相似,除对于可能影响吸收的辅料应在参比制剂相应辅料用量的±10.0%范围内以外,还具体规定不同功能辅料用量的变异性,如填充剂为±10.0%,作为崩解剂的淀粉为±6.0%,其他崩解剂为±2.0%,粘合剂为±1.0%,作为润滑剂的硬脂酸钙或硬脂酸镁为±0.5%,其他润滑剂为±2.0%,作为助流剂的滑石粉为±2.0%,其他助流剂为±0.2%,并规定辅料总变异量不能超过10.0%(不包括薄膜包衣或胶囊外壳)[1]。
3 辅料种类与用量对药物体内吸收的影响
药用辅料是生产药品和调配处方时的赋形剂和附加剂,是药物制剂的基础材料和重要组成部分,是可能影响药品质量、安全性和有效性的重要成分。辅料的物料性质、功能性质、来源、生产工艺、生物药剂学性质都可能影响制剂性质,见图2。
通常,药物主要吸收部位是小肠。正常成人小肠全长5~7 m,遍布绒毛膜,具有巨大的比表面积,面积约200 m2,一般药物溶液在小肠停留2~4 h。小肠上皮细胞顶膜表达有多种内向转运体(如寡肽转运体PepTide等),这些转运体参与氨基酸、肽类以及多种营养物质的吸收。此外,人类和啮齿类动物小肠上皮细胞顶膜还表达能量依赖的外向转运体,如P-糖蛋白(P-glycoprotein,P-gp)、多药耐药相关蛋白2(multidrug resistance-associated protein 2,MRP2)、乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)。这些转运体对药物吸收有显著影响。
P-gp蛋白外排药物的作用机制是:当药物与底物结合区接触时,ATP酶接触到核苷酸结合机构区(nucleotide binding domain,NBD)上,ATP水解提供能量,P-gp结构构型改变,将药物从高亲和的位点转移至低亲和的位点并被排出到细胞外。其外排药物时具有底物作用广泛、2种底物可与P-gp竞争性结合、ATP依赖性和外排饱和性等特征。很多非离子型表面活性剂都具有抑制P-gp作用,而离子型表明活性剂(阳离子表面活性剂、阴离子表面活性剂和两性离子表面活性剂)无此作用,这可能与它们所带的电荷有关[2]。
细胞色素P450(CYP)是人小肠最主要的Ⅰ相代谢酶,是由多种同工酶组成的基因超家族。CYP3A4是CYP最重要亚型之一,参与肠道约90%药物代谢。以表面活性剂和聚合物为主的药用辅料能抑制CYP3A4活性,提高AUC,降低CL/F,提高药物口服生物利用度。P-gp与药物代谢酶CYP3A4呈现协同作用。
因基于BCS分类的BE豁免申请已要求提供溶出度信息,并对溶出度有快速溶出或非常快速溶出要求,狭义上辅料对药物体内吸收的影响即为辅料种类与用量对口服固体制剂在体内崩解后小肠吸收性质的影响。影响方式包括影响药物渗透性、影响药物溶解性、影响小肠动力从而影响小肠通过时间、影响黏液完整性、影响生理pH值、影响药物代谢、影响转运蛋白功能、改变小肠膜表面微观环境等[3-8]。
以下对常见的可能影响吸收的辅料种类、用量及影响方式进行分析。
3.1糖醇类 糖醇通常用作口服固体制剂中的稀释剂或甜味剂,包括甘露醇、山梨醇、麦芽糖醇、木糖醇和乳糖醇等。大多数糖醇难以吸收,在肠道中存在渗透作用,可以通过在小肠中的渗透势来影响低渗透性药物的吸收,称为“渗透活性辅料”。与高渗透性化合物相比,此类辅料对低渗透性药物的吸收和生物利用度的影响更显著。
有研究表明,当山梨醇用量从1.25 g增加到2.5和5 g时,BCS Ⅲ类药物雷尼替丁生物利用度降低了7.2%、25%和45.5%。相比之下,在美托洛尔溶液或茶碱片中加入山梨醇没有发现该不良作用,表明山梨醇渗透作用对BCS I类药物的生物利用度或生物等效性几乎无影响,而对BCS Ⅲ类药物影响明显。在甘露醇中也观察到类似影响作用,使用甘露醇2.264 g可导致西咪替丁生物利用度降低约30%[2]。
除了渗透作用外,糖醇类辅料对药物体内吸收的影响还可能由于水通量变化而导致跨膜拖曳效应,以及改变胃肠道神经免疫激素控制等。糖醇类辅料对化合物的肠吸收影响还依赖于化合物的吸收特征(如吸收机制和吸收位点)。

图2 可能影响制剂性质的辅料性质鱼骨图
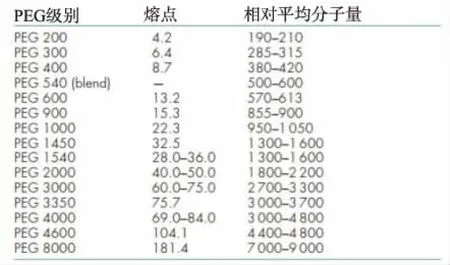
3.2聚乙二醇 表面活性剂聚乙二醇(polyethylene glycol,PEG)相对分子质量范围广(200~35 000),低相对分子质量(<600)PEG本质上是液体,通常用于增加水溶性差药物的溶解度和生物利用度,还可作为增塑剂、溶剂、软膏及栓剂的基质、片剂及胶囊剂的润滑剂等。PEG结构式见图3,不同级别PEG相对平均分子量见表1。
图3 PEG分子结构式
Tab.1PEGgradeandaveragemolecularweight
PEG不能在肠内被吸收,而通过渗透作用保留流体。PEG影响药物吸收的机制较复杂,包括稀释、溶解度改变、对肠黏膜直接作用、加速肠道转运时间以及与外排转运蛋白P-gp具有相互作用从而导致肠渗透性与运动性发生变化等。
研究表明,不同浓度PEG-400对雷尼替丁的小肠吸收具有不同影响作用,且呈现性别差异。对于男性受试者,随着PEG-400在0.5~1.5 g范围内增加,峰值达到0.75 g,然后逐渐下降至1.5 g的基线。对于更大剂量的PEG-400,2.5,5,10 g PEG-400分别使雷尼替丁溶液的生物利用度约降低38%,38%和31%。对于女性受试者,0.5~1.5 g的PEG-400降低雷尼替丁生物利用度。雷尼替丁生物利用度的性别差异部分归因于PEG-400对小肠转运的渗透作用及其通过抑制P-gp外排转运和(或)改变膜流动性而调节肠通透性之间的潜在综合相互作用。小剂量(0.5~1.5 g)下,在男性受试者中,PEG-400对雷尼替丁生物利用度的提高是由于该辅料具有调节肠通透性能力。而在小肠转运时间显著加快,遮蔽了较大剂量(≥2.5 g)PEG-400的吸收增强机制。另一方面,女性受试者可能具有较高比例的肠外排出转运蛋白如乳腺癌抗性蛋白(breast cancer resistance protein,BCRP),可能造成生物利用度性别差异[2]。
闫方[7]采用外翻肠囊法作为体外模型,研究排除神经和血流情况下PEG-400对环孢素肠道吸收的作用。结果显示,5 mg·mL-1PEG-400(23.16%)和10 mg·mL-1PEG-400(42.08%)在90 min时能显著增加环孢素透膜吸收量。整体动物模型实验也显示,不同浓度PEG-400能不同程度提高环孢素最大血药浓度及药物浓度-时间曲线下面积(AUC)。
PEG-4000和PEG-400具有相似渗透作用性质并影响肠道中的药物吸收。阿莫西林为BCS Ⅲ类药物,其肠道转运由被动扩散和通过二肽载体介导的主动转运所进行。有研究表明,小剂量(2.95 g)PEG-4000将阿莫西林AUC降低了8.4%,剂量范围为2.95~10 g的PEG-4000渗透势和药物生物利用度降低之间存在线性关系。
当在Caco-2细胞系中与PEG-400、PEG-2000和PEG-20000孵育时,发现罗丹明123 (P-gp底物)的外排转运显著降低。这些PEG对肠P-gp功能的抑制作用在0.1%~20% (V/V或W/V)的范围内呈浓度依赖性。还发现其他PEG衍生物,例如PEG-32月桂酸甘油酯、PEG-35蓖麻油、PEG-20硬脂酸酯、PEG-50硬脂酸酯、PEG-12硬脂酸酯和PEG-660 12-羟基硬脂酸酯对P-gp功能的抑制作用与辅料浓度的对数相关[2]。
3.3十二烷基硫酸钠 十二烷基硫酸钠(sodium dodecyl dulfate,SDS)对低渗透性药物的渗透性显示浓度依赖作用,SDS在低浓度(0.139 mmol·L-1)时增加药物表观渗透性(Papp),SDS浓度增加时,由于赋形剂介导的对单层细胞膜的破坏作用,药物渗透性甚至更大。
研究表明,少量SDS(3.64 mg)即影响利培酮片生物利用度。仿制药阿仑膦酸速释片中(BCS Ⅲ类药物)添加SDS而原研药品中未添加,导致阿仑膦酸生物利用度增加5~6倍,进而导致生物不等效。阿司匹林片(BCSⅢ药物),SDS4 mg增加其生物利用度超过5倍。
3.4聚山梨酯类 聚山梨酯类非离子表面活性剂常作为难溶性药物增溶剂与乳化剂。有研究表明,聚山梨酯80可增加罗丹明123在单层Caco-2细胞模型中顶膜-基底膜(apical side - basolateral side,AP-BL)方向的转运并减少基底膜-顶膜(BL-AP)方向的转运。由于聚山梨酯80对P-gp的抑制作用,聚山梨酯80可增加P-gp底物,如西咪替丁、环孢素等药物的表观渗透系数。
3.5泊洛沙姆(poloxamer) 泊洛沙姆为聚氧乙烯聚氧丙烯醚嵌段共聚物,分子量1000~7000,由适量的聚氧丙烯与聚氧乙烯共聚成亲油水平衡值不同的化合物,为一类新型的高分子非离子型表面活性剂,可用作制剂的乳化剂、稳定剂、增溶剂、吸收促进剂、固体分散剂、缓释材料。泊洛沙姆促进药物吸收,一方面由于本品使肠蠕动变慢,药物在胃肠道中滞留时间增长,吸收增加,从而能提高口服制剂生物利用度,另一方面为增加肠壁通透性,促进药物吸收。
3.6卡波姆 卡波姆是以非苯溶剂为聚合溶剂的丙烯酸键合烯丙基蔗糖或季戊四醇烯丙醚的高分子聚合物,可以用于口服固体制剂的润湿剂、粘合剂等。
福辛普利是Pept1转运体高亲和力的底物,孙筱[6]以其为探针底物,发现0.1%和0.2%卡波姆934P对福辛普利空肠的吸收有显著促进作用(P<0.05),0.5%卡波姆934P对福辛普利在十二指肠、空肠和回肠三段肠的吸收都有显著促进作用(P<0.05)。
3.7焦磷酸钠 焦磷酸钠(sodium pyrophosphate)可用作泡腾剂辅料,导致药物产品快速崩解。在雷尼替丁相对生物利用度研究中,发现同时给予1.132 mg (5.1 mmol) 焦磷酸钠可显著降低雷尼替丁吸收(AUC减少54%),这与使用闪烁摄影成像技术得到的小肠转运时间减少56%的结果平行[2]。
4 结束语
BE豁免可简化仿制药一致性评价流程,减少不必要的健康人体药物暴露,降低评价费用,加快评价进程,但也面临着研究难度大、技术要求高、具体标准规范还不够明确的问题,需要企业充分把握政策要求,科学分析BE豁免风险,并与药监部门保持通畅的沟通交流。

