从原理和事实出发建立正确的模型认知,防止教学中的过度归纳——以微粒在阴、阳极上的放电为例
重庆
以高考题为背景论述高中教学过程中的过度归纳,根据事实和原理出发,建立电解池中离子放电的正确认知模型——“阴离子可以在阴极放电,阳离子可以在阳极放电,含氧酸根离子甚至分子均可以参加电极反应”。教会学生以积极的心态认识和接受新知识、新情景。
1.问题的提出
分析电解放电,书写电极反应式时,为了让学生快速找到放电离子,老师通常带领学生共同参考各种资料进行归纳总结,以便得出这类题目的认知模型。如惰性电极电解溶液时,阳离子在阴极放电,阴离子在阳极放电,含氧酸根离子由于还原性弱于OH-,水溶液中通常不在阳极上放电。此经验规则在以后的习题训练和考试中不断被强化,形成思维定势导致学生解决此类问题时,审题不清,忽略题干的描述和信息,直接套用上述模型进行证据推理,得出答案。
为验证经验规律的准确性查阅相关资料并分析近些年的高考试题,发现上述经验总结是典型的“过度归纳”。很多真实情景下的电极反应与上述经验规则相违背,下面以高考题中涉及的真实情景为例简单论述。
2.原理及案例分析
2.1 阴离子能在阴极放电吗?
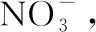
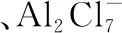
(1)钢制品应接电源的________极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为____________________。若改用AlCl3水溶液作电解液,则阴极产物为________。
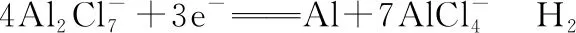

【例2】(2016·江苏卷·20·节选)铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物。
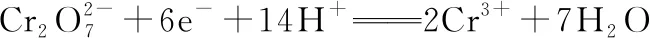
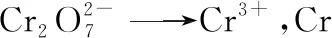
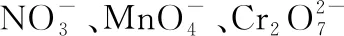
2.2 阳离子能在阳极放电吗?
阳极发生失电子的氧化反应,本质是放电离子还原性的体现,某些处于较低价态阳离子具有较强的还原性,可以在阳极放电发生氧化反应。
【例3】(2014·全国卷Ⅱ·27·节选)铅及其化合物可用于蓄电池、耐酸设备及X-射线防护材料。回答下列问题:
(3)PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生反应的电极反应式为____________________,阴极上观察到的现象是__________________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________,这样做的主要缺点是____________________。


【例4】(2014·北京卷·28·改编)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol/L FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值)

序号电压/V阳极现象检验阳极产物Ⅰx≥a电极附近出现黄色,有气泡产生有Fe3+、有Cl2Ⅱa>x≥b电极附近出现黄色,无气泡产生有Fe3+、无Cl2Ⅲb>x>0无明显变化无Fe3+、无Cl2
(1)甲同学由Ⅰ推测:Fe2+在阳极放电产生Fe3+。这种推测是否正确,并说明原因:______________。
(2)乙同学由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,其电极反应式为______________。
(3)Ⅱ中虽未检测出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:

序号电压/V阳极现象检验阳极产物Ⅳa>x≥c无明显变化有Cl2Ⅴc>x≥b无明显变化无Cl2
与Ⅱ对比,通过控制电压验证了Fe2+________(填“先于”“后于”或“同时”)Cl-放电。


分析高考题我们发现,阳离子可以在阳极放电,有些还原性较强的离子(如Fe2+)甚至可能先于阴离子反应。而这恰好是符合氧化还原反应规律的(还原性:Fe2+>Cl-)。
2.3 含氧酸根离子会参与电极反应吗?
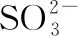
【例5】(2012·北京卷·2·节选、改编)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。


n(SO2-3)∶n(HSO-3)91∶91∶11∶91pH8.27.26.2
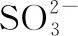
(2)混合溶液pH降至约为6时,送至电解槽再生。再生示意图如下:
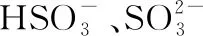
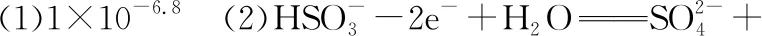

【例6】(2016·全国卷Ⅰ·36·节选)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
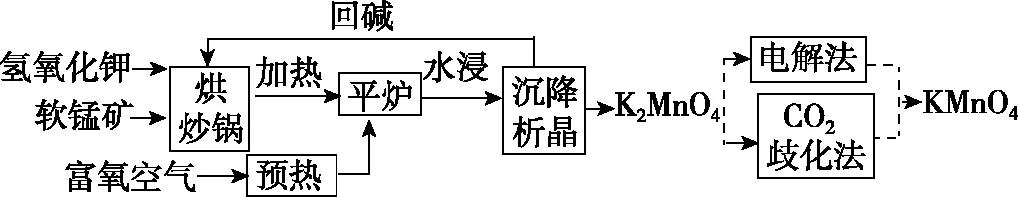
回答下列问题:
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4、MnO2和________(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为____________________,阴极逸出的气体是________。

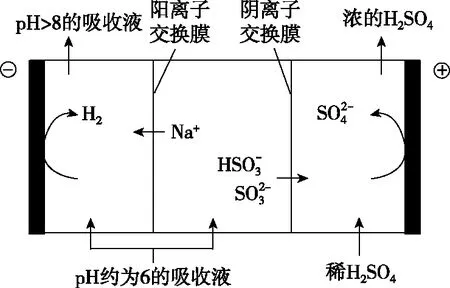
【例7】(2018·全国卷Ⅰ·27·节选、改编)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。
(1)阳极的电极反应式为______________。
(2)电解后,________室的NaHSO3浓度增加。
(3)b室的________(填“NaHSO3”或“Na2SO3”)浓度增加,原因是______________(用电极反应式说明)。


2.4 分子有可能参与电极反应吗?
当条件合适的情况下,电中性的分子也有可能参与电极反应。
【例8】(2014·北京卷·26·节选)
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:______________。
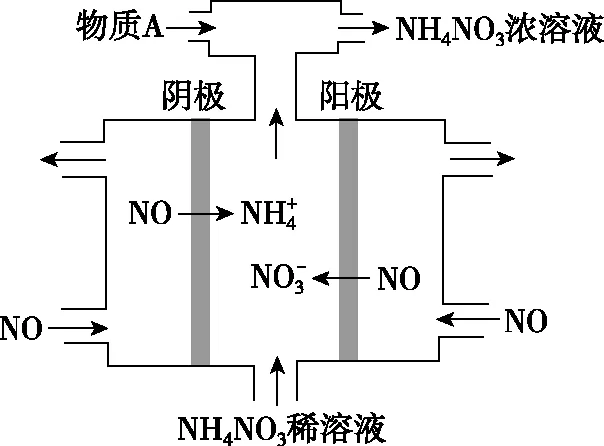
【答案】NH3观察图示转化中应通入NH3把多余的HNO3转变为NH4NO3

【例9】(2018·清华大学领军计划暨自主招生化学试题)利用电解产生的H2O2处理含氨废水(电解前用酸调pH=5)的装置如图,下列判断错误的是
( )
A.可用硫酸调节废水的pH
B.阴极的电解产物之一是N2
C.阴极O2的消耗与阳极O2的产生量相同
D.电路中通过3 mol电子时除去废水中17 g NH3
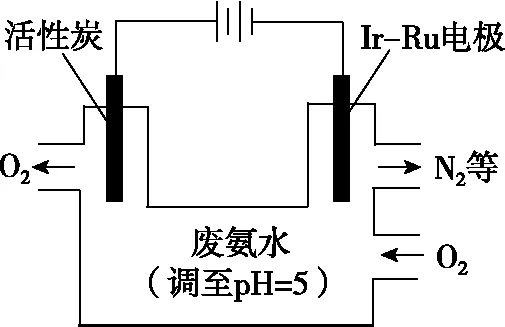
【答案】C

3.中学教学中的应对方法
电解过程的本质可以认为是氧化还原反应,影响微粒的氧化性或还原性的外界条件有很多,如浓度、温度、溶液酸碱性、电极电势等。高中学生由于知识水平所限,一些原理和方法不能讲解,避免增加学生的学习负担。为了解决中学教学中的实际问题避免过度归纳,教师在电化学教学中应牢记以下三点。
3.1 从电解反应的本质:氧化还原反应入手分析
不从原理本身出发而只进行片面的规则总结,不但不是学习知识和解决问题的万能钥匙,还会束缚学生的思维,阻碍学生对知识本质的探求。电解池中,电极反应式是微粒氧化性和还原性的体现,而不能简单归纳为“阴离子在阳极放电,阳离子在阴极放电,含氧酸根离子通常不参与电极反应”。
3.2 避免过度归纳,形成“先入为主”的定势思维
适当归纳总结是必要的,有利于知识的形成初步,学生可以利用经验规律解决常见的简单问题。但在高中学习的后期,更应该带领学生从原理和事实出发体验不一样的电极反应。过度归纳容易形成心理学上的“首因效应”,学生牢牢抓住错误的认知模型进行证据推理当然不能得出正确答案。教学中教师应该教会学生辩证地看待问题,感受高中知识的局限,为以后的学习埋下种子。
3.3 题目的信息比“天大”,高考题中尤其如此


