EDTA在中学化学计算中的考查与应用
江苏
乙二胺四乙酸简称EDTA或EDTA酸,结构简式为(CH2COOH)2NCH2CH2N(CH2COOH)2,它是一种能与Mg2+、Ca2+、Mn2+、Fe2+等二价金属离子按物质的量1∶1结合的螯合剂。由于EDTA在水中的溶解度小,故通常把它制成二钠盐,一般也简称为EDTA,或叫做EDTA二钠盐,用Na2H2Y表示。EDTA相关知识属于大学化学内容,它在分析测定中具有重要的意义,通常用于滴定分析多种金属离子。近年来,各地高考题和模考题对EDTA在化学计算中的考查愈加频繁,以下举例分析说明。
考向一、由EDTA直接滴定某金属离子的含量

(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”或“偏低”或“不变”)。
(2)通过计算确定硫酸镍铵的化学式(写出计算过程)。
【答案】(1)偏高 (2)(NH4)2Ni(SO4)2·10H2O
【解析】(1)若滴定管在使用前未用EDTA标准溶液润洗,则消耗EDTA标准溶液的体积偏大,由此计算出的Ni2+含量将偏高。
(2)n(Ni2+)=0.040 00 mol·L-1×31.25 mL×10-3L·mL-1=1.250×10-3mol,
m(Ni2+)=59 g·mol-1×1.250×10-3mol=0.073 75 g,

则硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O。
【小结】EDTA和金属离子的直接滴定是高中阶段对EDTA考查最常见类型,分析时应根据金属离子和EDTA反应的计量数关系(通常为物质的量之比1∶1)进行计算,此类问题难度不大,应熟练掌握。
考向二、由EDTA间接测定某成分的含量
【例2】锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)是一种重要的磁性材料。测定锰锌铁氧体中ZnO含量的实验步骤如下:
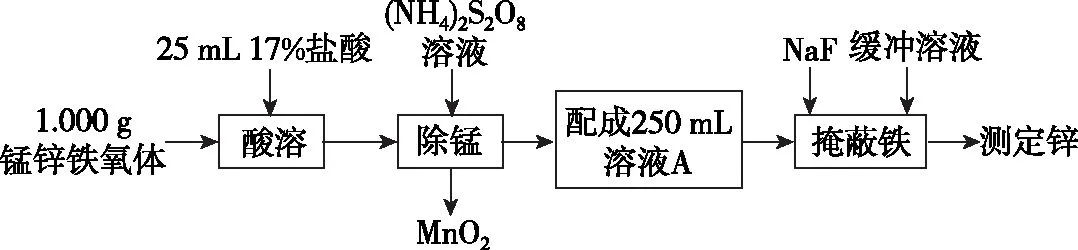
(1)a、b、c的代数关系式为________。
(2)“除锰”时发生反应的离子方程式为______________。

【答案】(1)2a+2b+3c=8

(3)16.2%
【解析】(1)由化合物中正负化合价的代数和为0,可知a×(+2)+b×(+2)+c×(+3)+4×(-2)=0,即2a+2b+3c=8。
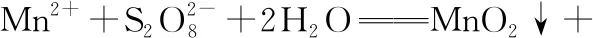
(3)25.00 mL溶液A消耗EDTA的物质的量为
20.00 mL×10-3L·mL-1×0.010 00 mol·L-1=2.000×10-4mol,
【小结】本例中ZnO不能与EDTA反应,故将ZnO酸化为能直接与EDTA反应的Zn2+。根据滴定过程中消耗的EDTA含量,可测定样品中Zn2+的含量,从而间接测定样品中ZnO的含量,分析过程中应紧抓物质之间的关系式“ZnO~Zn2+~EDTA”进行计算。
考向三、由EDTA在不同的pH环境中测定某金属离子的含量
【例3】以碳酸镁(含少量FeCO3)为原料制取硫酸镁晶体,并测定Mg2+含量:将原料完全溶于一定量的稀硫酸中,加足量的H2O2后用氨水调节溶液的pH,静置后过滤,除去滤渣,将滤液结晶得硫酸镁晶体。
(1)加入H2O2时反应的离子方程式为______________。
(2)已知Ksp[Fe(OH)3]=1.0×10-39,Ksp[Mg(OH)2]=1.0×10-12。室温下,若溶液中c(Mg2+)=0.01 mol·L-1,欲使溶液中的c(Fe3+)≤1×10-6mol·L-1,需调节溶液pH范围为________。
(3)常采用下列方法测定结晶硫酸镁中Mg2+的含量:
已知:①在pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)形成配合物。

步骤1:准确称取得到的硫酸镁晶体1.50 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
步骤2:准确移取25.00 mL溶液A于锥形瓶中,用0.10 mol·L-1Zn2+标准溶液滴定,滴定到终点,消耗Zn2+标准溶液的体积为20.00 mL。
步骤3:准确移取25.00 mL溶液A于另一只锥形瓶中,调节pH在5~6;用0.10 mol·L-1Zn2+标准溶液滴定,滴定至终点,消耗Zn2+标准溶液的体积为30.00 mL。
计算该结晶硫酸镁中Mg2+的质量分数(请给出计算过程)

(2)3~9
(3)6.4%

(2)调节溶液pH的目的是将Fe3+转化为Fe(OH)3沉淀,而Mg2+却没有沉淀,根据Ksp[Mg(OH)2]=1.0×10-12及c(Mg2+)=0.01 mol·L-1,可得Mg2+开始沉淀时的pH:Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.0×10-12,则c(OH-)=1.0×10-5mol·L-1,pH=9;同理根据Ksp[Fe(OH)3]=1.0×10-39及溶液中的的c(Fe3+)≤1×10-6mol·L-1,可求得Fe3+沉淀完全时的pH=3,故需调节溶液pH的范围为3~9。
(3)25 mL溶液A中:
n(EDTA)=n(Zn2+)=0.10 mol·L-1×20.00 mL×10-3L·mL-1=2.00×10-3mol,
25 mL溶液A中EDTA的量:
n(EDTA)总=n(Zn2+)=0.10 mol·L-1×30.00 mL×10-3L·mL-1=3.00×10-3mol,
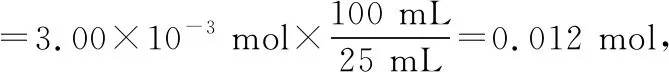
所以1.5 g硫酸镁晶体中的n(Mg2+)=0.012 mol-8.00×10-3mol=0.004 mol,



