巨峰葡萄Rs基因的克隆鉴定、 序列分析与时空表达特征研究
崔腾飞,王 晨,谭红雨,贾海锋,白云赫,王文然,房经贵
(1.南京农业大学 园艺学院,江苏 南京 210095;2.中国农业大学 食品科学与营养工程学院,北京 100083)
白藜芦醇(Resveratrol),简称Res,早在1924年就被发现[1],化学名称为3,4′,5-三羟基-1,2-二苯乙烯(3,4′,5-trihydroxystilbene),分子式C14H12O3,相对分子质量228.25[2],其存在顺式和反式2种类型[3]。白藜芦醇是在植物体内受到了病原体侵染或者在恶劣环境条件下,植物体内自身分泌的一种抗毒素[4],具有增强植物抗逆性的作用。白藜芦醇广泛存在各种植物体中,其中在葡萄科植物中白藜芦醇含量较高[5]。随着研究的深入,人们发现Res具有很强的预防和抑制心血管疾病及抗癌作用[6]。另外,它还具有如抗氧化、抗肿瘤、抗血小板凝聚、抗细菌和真菌等医疗保健作用。因此,白藜芦醇已成为科学家们高度重视的天然活性成分[7]。目前,很多国家和地区都开发生产了白藜芦醇及其制品并应用于食品、医疗保健品和化妆品等领域。比如,日本将白藜芦醇作为食品添加剂,美国将白藜芦醇纳入膳食补充剂,我国也将白藜芦醇制成了天然保健食品[8-10]。
白藜芦醇是一种天然多酚类化合物,目前至少已在21科、31属的72种植物中发现[11]。其广泛存在于自然界中,包括葡萄、虎杖[12]、花生[13-14]、豆类[15]等植物或果实中均有存在。在现有报道中,葡萄中含量较高,但在葡萄不同部位中白藜芦醇含量不同,而葡萄皮是白藜芦醇的主要合成部位。尽管葡萄中白藜芦醇的含量相对较高,但是作为一种次生代谢物质,自然条件下在植物体内的含量相对较低,所以仅仅以目前栽培的天然葡萄果实为白藜芦醇的来源远远满足不了人们的需求,欲实现葡萄中白藜芦醇的高效富集,很有必要认识葡萄中白藜芦醇代谢的调控机制。而白藜芦醇的合成受到苯丙氨酸裂解酶(PAL)、4-香豆酸:辅酶A连接酶(4CL)、肉桂酸-4-羟基化酶(C4H)、二苯乙烯合酶(STS)、赤松素-甲氧基转移酶(PMT)甚至查尔酮合成酶(CHS)等多个酶促反应的调节控制,其中最关键的调节酶是白藜芦醇合酶(Rs)。Rs又被称为3,4′,5-三羟基二苯乙烯合酶,为酮二聚物,是STS中的一类[16]。因此,研究葡萄Rs基因在白藜芦醇代谢过程中的调控作用显得尤为重要,而巨峰葡萄作为目前生产中栽培最广的品种,且巨峰葡萄Rs基因相关的研究鲜有报道,故本研究对巨峰葡萄开展了Rs基因的初步研究,以期为认识Rs基因在葡萄白藜芦醇代谢过程中的调控作用提供理论依据。
1 材料和方法
1.1 材料与试剂
供试巨峰葡萄(Vitisviniferacv.Kyoho)果实均采自江苏农博园葡萄种植基地,分别为花后25,40,60,80 d不同成熟度的葡萄果实。
试验所用试剂主要有:Tris、山梨醇、PEG、CTAB、NaCl、EDTA、KAc、C2H2OH、氯仿、LiCl、异丙醇,以及由TaKaRa生物工程有限公司生产的RNA反转录试剂盒、PCR产物纯化试剂盒和捷倍思生物基因技术有限公司的DNA凝胶回收试剂盒,此外还有Taq酶、T4DNA连接酶和限制性内切酶。主要载体有pMD19-T和pCAMBIA1302。
1.2 试验方法
1.2.1 葡萄总RNA的提取及cDNA合成 采用改良CTAB法[17]提取巨峰葡萄不同时期果肉和果皮中总RNA。用紫外分光光度计测定总RNA的OD260和OD280,通过比值大小判定其浓度和纯度,用1%琼脂糖凝胶电泳检测所提取RNA完整度,如图1所示,提取的总RNA条带较为清晰,可进行后续试验。然后将RNA按照TaKaRaPrimeScriptTMRT-PCRKit操作说明进行反转录合成cDNA。
图1 巨峰葡萄果皮和果肉总RNA电泳Fig.1 Total RNA electrophoresis of peel and pulp of Kyoho grape
1.2.2 PCR扩增引物的设计与合成 根据GenBank中已报道的葡萄Rs基因序列,基本信息如表1所示,设计PCR扩增引物:上游引物rs1:5′-ATGGCT
TCAGTCGAGGAATTTA-3′;下游引物rs2:5′-TTAAT
TTGTAACCATAGGAACGCTATG-3′。根据载体pCAMBIA1302,选取BglⅡ和NheⅠ 2个酶切位点,加酶切后上游引物rs3:5′-GAAGATCTATGGCTTCAG
TCGAGGAATTTA-3′;下游引物:rs4:5′-CTAGCTAGC TTAATTTGTAACCATAGGAACGCTATG-3′。引物由擎科生物有限公司合成。

表1 葡萄Rs基因基本信息Tab.1 Basic information on the Rs gene of grapes
1.2.3 目的基因的克隆 以反转录得到的cDNA为模板,扩增巨峰葡萄Rs的序列。使用25.0 μL的PCR反应体系:10×PCR缓冲液2.5 μL,提取的样品Cdna 2.0 μL,上游引物rs1(25 mmol/L)1.0 μL,下游引物rs2(25 mmol/L)1.0 μL,dNTPs(10 mmol/L)0.5 μL,rTaqDNA聚合酶0.2 μL,灭菌的无核酸重蒸水17.8 μL,离心混匀。在PCR仪中94 ℃预变性5 min后,按以下程序进行PCR扩增:94 ℃变性30 s,53~64 ℃的温度梯度退火30 s,72 ℃延伸2 min,共35个循环;最后72 ℃延伸10 min结束反应。然后琼脂糖凝胶电泳检测PCR扩增产物,如图2-A所示。按照胶回收试剂盒说明回收DNA,以回收产物为模板利用引物rs3和rs4进行PCR扩增,PCR扩增产物凝胶电泳如图2-B所示,将PCR产物纯化回收并连接pMD-19T载体,16 ℃连接过夜后转化大肠杆菌进行测序。
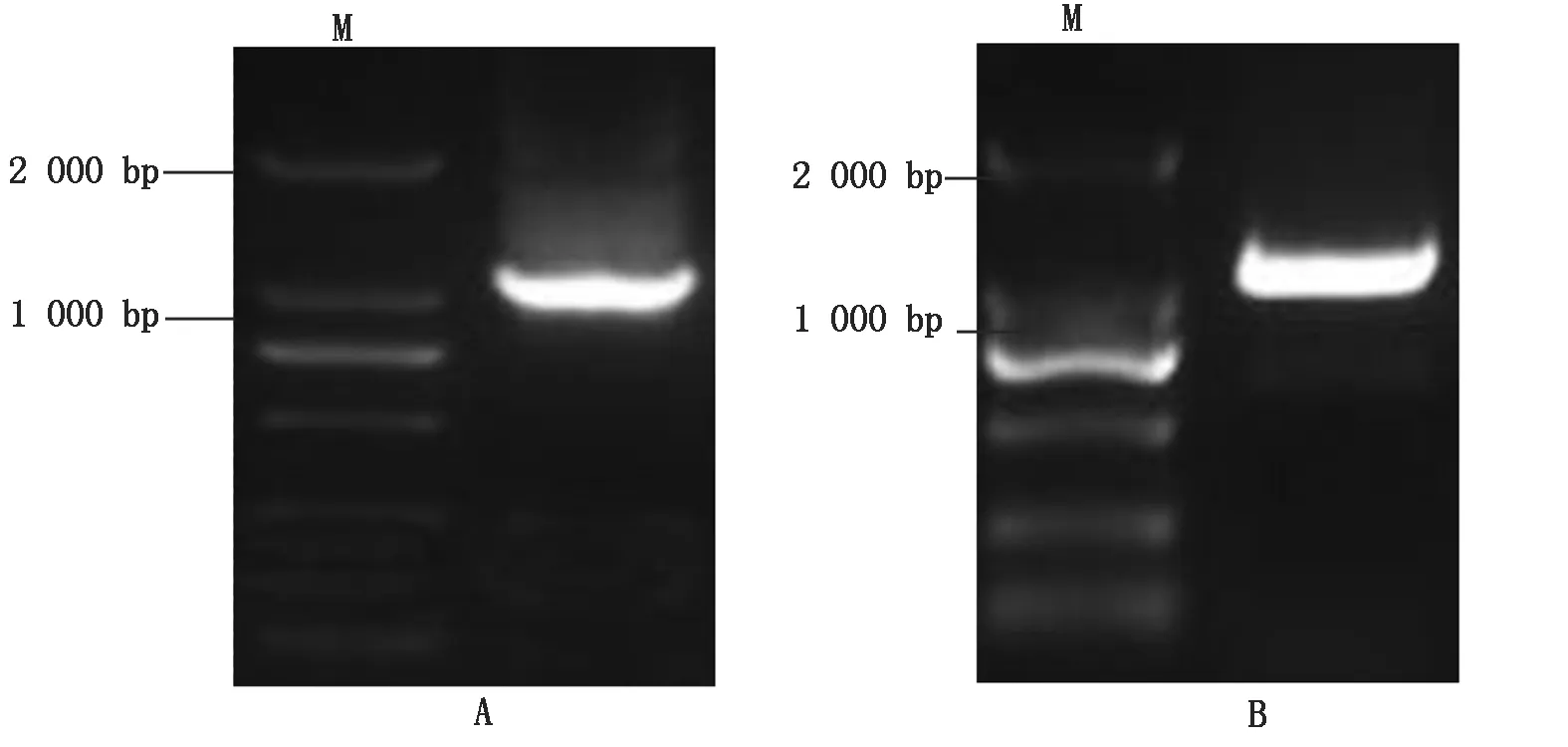
A.以rs1/rs2为引物,使用RT-PCR扩增的目的基因片段,约为1 200 bp;B.将目的片段回收以rs3/rs4为引物扩增后的片段,即加酶切位点后的片段。A.rs1/rs2 is used as a primer,and the target gene fragment amplified by RT-PCR is about 1 200 bp; B.The fragment of interest is recovered by rs3/rs4 as a fragment amplified by the primer,that is,the fragment after the restriction enzyme site is added.
1.2.4Rs基因生物信息学分析 应用网站ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找开放阅读框(Open reading frame,ORF);利用NCBI在线软件Blast搜索比对,下载其他植物相似性高的氨基酸序列,使用MEGA 5.0软件根据相邻连接方法(Neighbor jointing,NJ)构建系统进化树并分析利用在线软件MEME(http://meme-suite.org/tools/meme)对葡萄Rs蛋白进行基序预测。使用在线软件ProtParam(http://web.expasy.org/protparam/)分析蛋白质理化性质及氨基酸组成;分别用在线软件SOPMA和Swiss-Model等对Rs蛋白进行二级结构分析,对其三级结构建模并进行不同物种间对比分析;利用在线软件STRING(https://string-db.org/cgi/input.pl? UserId=input_page_show_search=on)对Rs基因进行蛋白互作分析;采用WoLF PSORT(http://www.genscript.com/wolf-psort.html)进行亚细胞定位;利用PlantCARE对获得的葡萄Rs基因启动子序列进行了顺式作用元件的分析及功能预测并分析启动子的motif作用类型和数量。
1.2.5 基因表达特异性分析 采用qRT-PCR技术,用试剂盒以及iQTM5Software和iQTM5Real-timePCRSystem分析不同发育阶段葡萄果皮和果肉中目的基因的表达特性。根据克隆获得的目的基因序列设计引物,上游引物序列为:5′-GGCTTTTGA
CCCACTTGGTA-3′;下游引物序列为:5′-GTGGCTTT
TTCCCCCTTTAG-3′,以葡萄的actin基因(登录号:XM_019223591.1)为内参基因,上游引物序列为:5′-TACAATTCCATCATGAAGTGTGATG-3′;下游引物序列为:5′-TTAGAAGCACTTCCTGTGAACAATG-3′。扩增体系总体积为20.0 μL,其中cDNA模板1.0 μL、上、下游引物各0.4 μL、2×Supermix 10.0 μL、双蒸水8.2 μL。扩增程序为:94 ℃预变性30 s;94 ℃变性5 s,55 ℃退火15 s,共40个循环;72 ℃保温10 s。绘制熔解曲线,并根据2-ΔΔCT计算基因的相对表达量。
2 结果与分析
2.1 巨峰葡萄Rs基因克隆及序列进化分析
2.1.1Rs基因克隆及序列分析 为研究Rs的潜在作用,开发其利用价值,本研究以巨峰葡萄cDNA为模板,利用引物rs1和rs2进行PCR扩增,得到序列为1 539 bp。经测序、分析,该序列含有一个完整的开放阅读框,其大小是1 179 bp,共编码392个氨基酸。如图3所示,该序列含有查耳酮和二苯乙烯合酶活性位点RVMLYHQGCYAGGTVLR,并具有完整的芪合酶家族特征位点GVLFGFGPGLT,该蛋白属于查耳酮合酶家族,结构域序列号为cl28398,结构域匹配E值为0e+00。

三角形表示起始密码子和终止密码子;单下划线表示芪合酶家族特征位点GVLFGFGPGLT;双下划线表示查耳酮和二苯乙烯合酶活性位点。The triangle indicates the start codon and the stop codon; the single underline indicates the stilb enzyme family signature GVLFGFGPGLT; the double underline indicates the chalcones and stilbene synthase active sites.
2.1.2 系统进化分析 通过在NCBI中Blast搜索比对类似序列,采用MEGA 5.0软件对巨峰葡萄Rs基因编码的氨基酸序列同拟南芥、番茄、草莓等植物的同源序列比对,并构建系统进化树分析其保守性。如图4-A所示,巨峰葡萄Rs基因与圆叶葡萄(ACM 47246.1)氨基酸序列一致性高达99%,与番茄(NP 001234033.2)氨基酸序列一致性为76%,与草莓(XP 004306542.1)和落花生(AID 59203.1)氨基酸序列一致性均为74%,而与拟南芥(NP 196897.1)氨基酸序列一致性为73%。证明Rs基因在葡萄属中保守性较高,而在不同属之间存在一定差异,但差异不大。

A.葡萄Rs基因构建的进化树;B.葡萄Rs蛋白基序的MEME分析。A.Phylogenetic tree constructed from grape Rs gene;B.MEME analysis of grape Rs protein motifs.
基于Rs基因进化分析,本研究用MEME软件构建了蛋白基序结构图(图4-B)。研究发现,巨峰葡萄Rs基因与同属的圆叶葡萄(Vitisrotundifolia)蛋白长度和蛋白基序位置一致性较大,并且与不同属之间差异较小,进一步表明葡萄Rs基因在分子结构进化中具有较高的保守性。
2.2 Rs基因生物信息学分析
2.2.1 Rs蛋白质理化性质及氨基酸组成分析 通过表2可以看出,巨峰葡萄Rs编码392个氨基酸;分子质量为42.88 ku,理论等电点pI为6.09;在编码蛋白中,酸性氨基酸所占比例高于碱性氨基酸;不稳定系数小于40,故为稳定性蛋白;亲水性平均值为-0.047,则该蛋白属于弱亲水性蛋白。
2.2.2 Rs蛋白二级结构分析 蛋白质二级结构是构成其高级结构的基础,主要包括4种基本形式:α-螺旋、β-折叠、β-转角和无规则卷曲,此外也包含延伸链等其他形式[18]。如表3和图5所示,从二级结构分析预测结果能够看出,巨峰葡萄Rs蛋白的二级结构组成和分布为,α-螺旋为44.13%,β-转角为11.48%,无规则卷曲为26.79%,延伸链为17.60%。巨峰葡萄Rs蛋白二级结构主要成分是α-螺旋。

表2 巨峰葡萄Rs蛋白理化性质Tab.2 Kyoho grapes Rs protein physical and chemical properties
注:不稳定指数中S(Stability)表示稳定,I(Instability)表示不稳定。
Note:The unstable index S(Stability)express stable,I(Instability)express is not stable.

表3 巨峰葡萄Rs蛋白二级结构预测Tab.3 Prediction of secondary structure of Rs protein in Kyoho grapes %

图5 巨峰葡萄白藜芦醇合酶基因编码蛋白二级结构分布Fig.5 Secondary structure map of resveratrol synthase gene encoding Kyoho grapes
2.2.3 Rs蛋白三级结构分析 蛋白质三级结构是在二级结构基础上进一步的盘绕折叠形成的,分析预测蛋白质三级结构有利于更加深入地了解Rs基因,开发其潜在的利用价值。故利用在线软件Swiss-Model,对巨峰葡萄Rs蛋白进行了三维结构建模,并且将其和同属的圆叶葡萄以及亲缘关系较远的落花生进行比较。如图6,建模结果显示,巨峰葡萄Rs蛋白三级结构与亲缘关系近的圆叶葡萄相似性较高,而与亲缘关系较远的落花生存在明显差异。进一步证明Rs基因在葡萄属中具有较高的保守性。
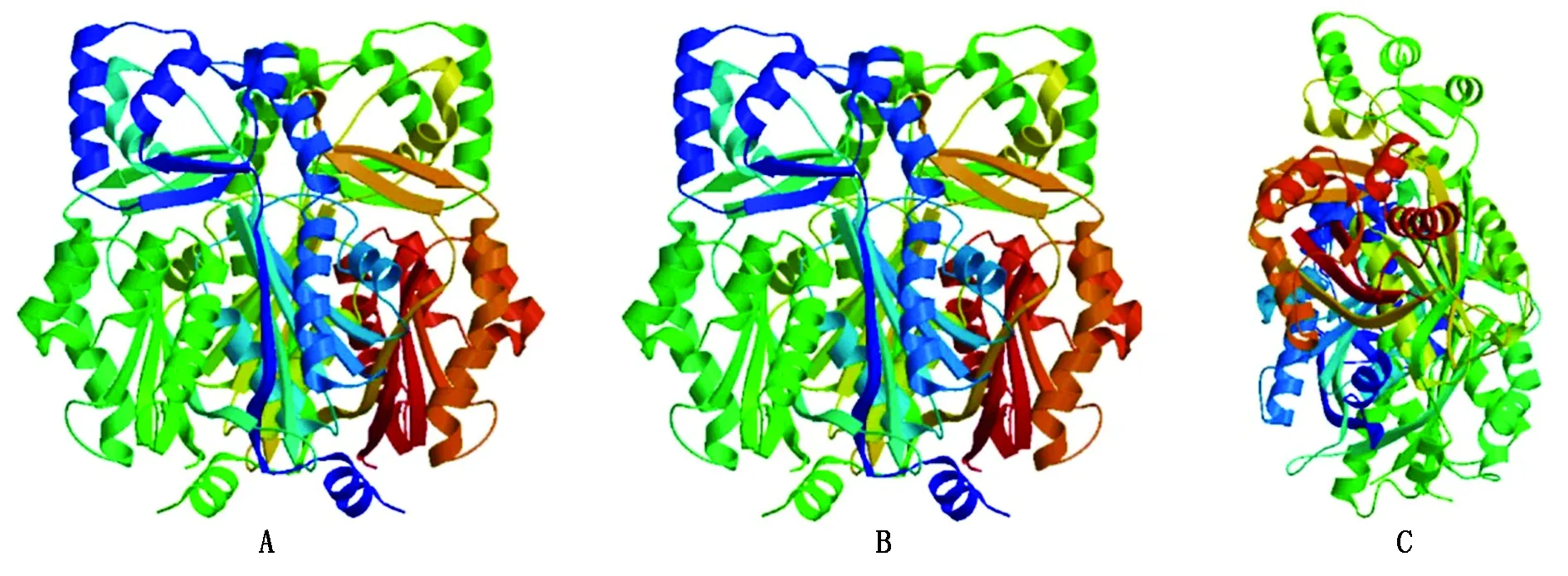
A、B、C分别为圆叶葡萄、巨峰葡萄和落花生蛋白的三级结构。A,B,C,respectively the Round leaf gropes,Kyoho grapes and peanut protein tertiary structure.
2.2.4 Rs蛋白互作预测 通过蛋白互作预测发现Rs与5个蛋白有共表达,其中有4个为假定蛋白,一个为氧-甲基转移酶(OMT2.1)。预测发现这些蛋白的功能可能与次生代谢相关。如图7所示,其中VIT_12s0028g01880.t01基因编码氧-甲基转移酶(OMT2.1),可催化白藜芦醇生物合成紫檀芪,紫檀芪是一种主要存在于紫檀、蓝莓、葡萄和花榈木等植物的有效成分,具有抗真菌和一定的药理学性质,在抗癌、抗氧化等方面具有一定的功效。 故推测Rs与OMT2.1在植物受到病原体侵染时将会高表达以增加植物的抗性。
2.3 亚细胞定位及启动子分析
2.3.1 葡萄Rs基因亚细胞定位预测 如表4所示,亚细胞预测表明:巨峰葡萄Rs基因主要集中在细胞质和叶绿体中表达,而在高尔基体和液泡中均不表达,此外巨峰葡萄Rs基因在细胞核、线粒体、细胞膜和过氧化物酶体中有少量表达。故推测可知,Rs基因表达部位、表达量不同可能与葡萄不同组织中白藜芦醇的含量具有一定的相关性。

图7 Rs蛋白互作分析Fig.7 Rs protein interaction analysis

表4 巨峰葡萄Rs基因亚细胞定位预测Tab.4 Kyoho grapes Rs gene subcellular localization prediction
注:A.细胞质;B.高尔基体;C.叶绿体;D.细胞核;E.线粒体;F.液泡;G.细胞膜;H.过氧化物酶体。
Note:A.Cytoplasm;B.Golgi apparatus;C.Chloroplast;D.Nucleus;E.Mitochondria;F.Vacuole;G.Plasma membrane;H.Peroxisomes.
2.3.2 葡萄Rs基因启动子的motif分析 利用PlantCARE对获得的巨峰葡萄Rs基因启动子序列进行了顺式作用元件的分析及功能预测。序列分析显示,该启动子序列具有典型的核心启动子元件,有32个CAAT-box和50个TATA-box,其中CAAT-box决定了启动子起始转录的效率及频率,可增强启动子的强度[19]。除此之外,如表5所示巨峰葡萄Rs启动子区片段还包含了光响应元件、参与昼夜节律控制的顺式作用调控元件、赤霉素响应元件、参与脱落酸反应的顺式作用元件和MYB Hv1和MYB结合位点以及真菌诱导反应元件,并且具有参与胚乳表达的顺式调控元件。因此推测,巨峰葡萄Rs基因的表达可能受光照、激素、MYB的调控以及真菌的诱导,并且在胚乳中表达可能具有一定的时空特异性。对巨峰葡萄白藜芦醇合酶基因的motif进行分析发现,如图8所示,从图中可以看出,与激素相关的motif主要两类,分别是与赤霉素(GA)和水杨酸(SA)响应相关的motif,推测Rs基因能够响应GA和SA,也进一步表明Rs基因的表达可能受激素的调控。
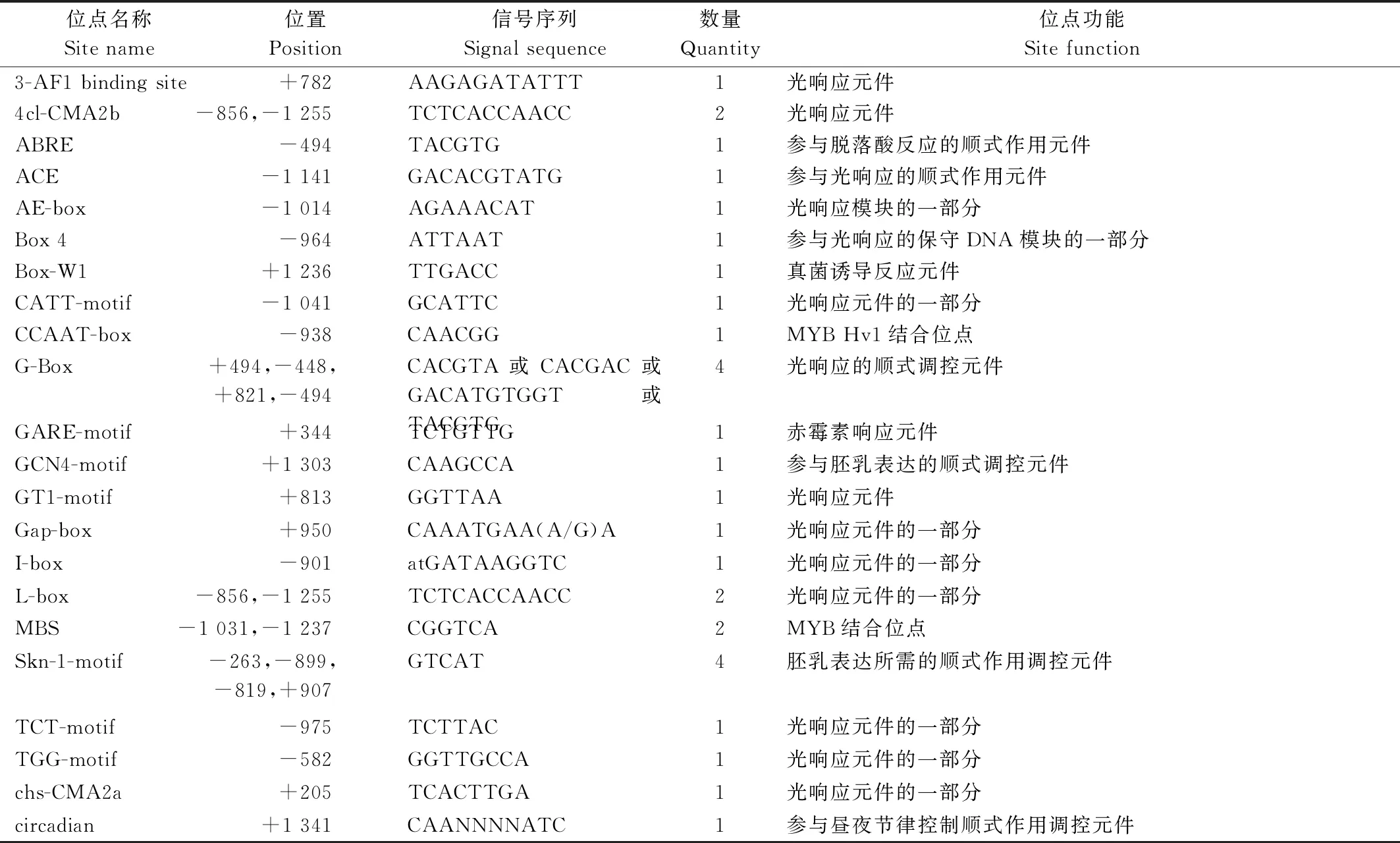
表5 巨峰葡萄Rs基因启动子序列顺式作用元件分析Tab.5 Kyoho grapes Rs gene promoter sequence cis-acting element analysis
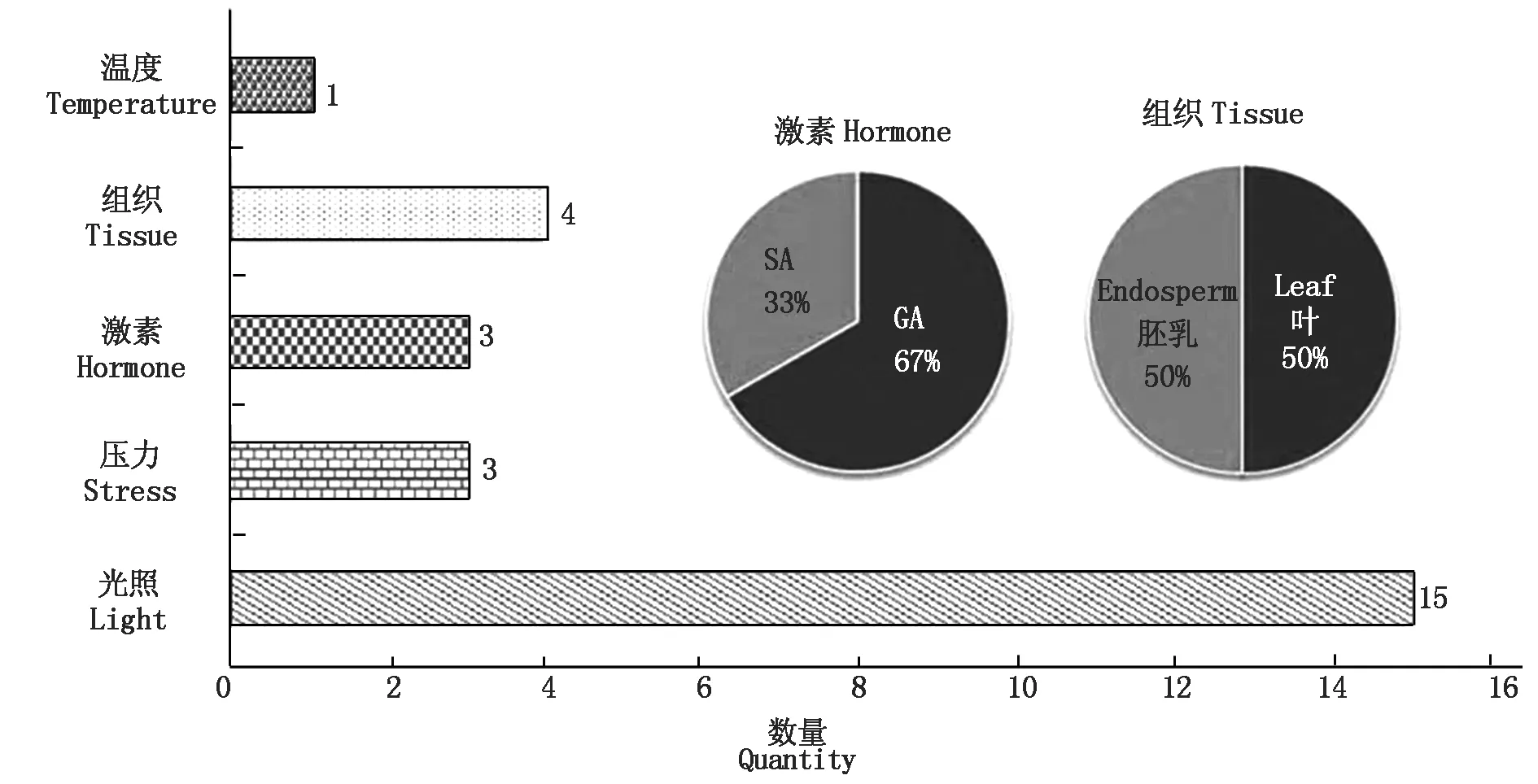
图8 巨峰葡萄Rs基因motif分析Fig.8 Motif analysis of Rs gene in Kyoho grape
2.4 Rs基因的表达特异性分析
采用qRT-PCR技术对巨峰葡萄果实和果皮不同生长发育阶段中Rs基因的相对表达量进行检测,结果如图9所示,Rs基因在葡萄4个不同生长发育阶段(青:花后25 d;微红:花后40 d;全红:花后60 d;深红:花后80 d)的果皮和果肉中均有表达,但表达量有所差异;除在葡萄花后80 d之外,其余3个时期葡萄果皮中Rs基因的表达量均高于果肉;花后25 d时Rs基因的表达量在不同组织中均是最高,之后都有不同程度的变化。综合来看,Rs基因的表达量在巨峰葡萄花后25 d的果皮中表达量最高,之后随着果实颜色的加深,其表达量逐渐减少,到花后80 d时达到最低。定量结果表明,Rs基因在巨峰葡萄果实发育过程中的表达具有时空特异性。

图9 不同生长发育阶段巨峰葡萄果实中Rs基因相对表达量比较Fig.9 Comparison of Rs gene expression in Kyoho grapes at different growth and development stages
3 结论与讨论
随着人们对白藜芦醇的认识逐渐加深,白藜芦醇的开发利用也愈发广泛。同时伴随着葡萄副产品的研发,葡萄酒、果醋等产品层出不穷。白藜芦醇不仅是植物自身分泌的抗毒素,能使植物对某些疾病产生抗性,而且对人体具有重要的保健作用。有研究发现,葡萄果醋中富含大量的白藜芦醇[20],经常食用能够增强机体抵抗力,王茜等[21]、熊赪等[22]发现葡萄果醋中的白藜芦醇具有防癌抗癌的作用。然而Rs基因是白藜芦醇合成途径中最后一个起重要作用的关键酶[23],其属STS中的一类。伴随着人们对白藜芦醇了解的逐渐深入,Rs基因的研究也早已倍受科学家们的关注。
现已在虎杖、花生和豆类等多种植物中克隆得到Rs基因,不同来源的Rs基因在结构存在一定的差异,当然其合成Res的能力也不同,因此关于Rs基因的研究十分活跃[24]。白藜芦醇在葡萄中含量丰富,特别是在葡萄皮和葡萄籽中的含量尤其丰富[25]。然而以往对葡萄果实生长发育过程中白藜芦醇的研究发现,既有研究表明Res含量从果实绿果期到成熟期稳定下降[26],也有在成熟期最高的结果[27]。此外,余兴[28]和代红军等[29]研究表明,在酿酒葡萄蛇龙珠和赤霞珠葡萄生长发育过程中,果实中白藜芦醇的变化趋势呈双峰型。因此,探究白藜芦醇在葡萄果实生长发育过程中的变化趋势显得更加重要。本研究发现,在巨峰葡萄果实不同生长发育阶段Rs基因在果皮和果肉中均有表达,且整体呈稳定下降趋势。主要表现为随着葡萄果实颜色的加深,果皮中表达量递减,而果肉中基本稳定不变。笔者前期研究发现,同属于欧美杂种的峰后和藤稔果皮中白藜芦醇含量的最高时期均出现在转色前的始熟期,且成熟时着色越深果皮中白藜芦醇含量下降越快[30],然而,郑先波等[31]同我们研究发现相左;同时,Jeandet等[32-34]认为Res合成能力在果实成熟期骤然下降,源于葡萄不同生长期Res和花青素苷合成竞争关系,出现了Res合成能力的下降伴随着一系列花青素苷物质的升高现象。本研究主要从鉴定巨峰葡萄Rs基因、蛋白功能分析和预测以及白藜芦醇在葡萄果实中的时空表达特异性进行分析,研究发现Rs基因主要在细胞质和叶绿体中表达,且与OMT2.1具有互作。此外,Rs基因表达可能受光照、MYB、真菌和激素的调控,并且具有一定的时空特异性,主要表现为花后25 d的青皮中表达量最高。

