山羊FGF9基因克隆及其在成肌细胞分化中的 表达模式研究
黄 凯,林亚秋,朱江江,马洁琼,王 永
(1.西南民族大学 生命科学与技术学院,四川 成都 610041;2.青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041)
肌肉是动物运动系统的组成器官,肌纤维是肌肉的最基本单位,它的数量和类型直接影响动物肉产品品质[1],进而影响动物的经济效益。肌肉最终形成需要经历成肌细胞分化、迁移和增殖以及肌管形成几个阶段[2],在这样一个复杂的发育过程中,各种因素相互调节,其中与肌肉发育相关的基因发挥非常重要的作用[3]。成肌细胞调控因子家族MyoD(Myogenic differentiation antigen)是目前研究较为透彻的肌肉发育相关基因,但肌肉的生长发育应该是很多基因共同调控的结果,不只是单个基因发挥作用,因此筛选影响肌肉生长发育相关基因尤为重要。
成纤维细胞生长因子家族(Fibroblast growth factors,FGFs)已发现有23个成员[4-6],它们之间有20%~50%高度同源的氨基酸序列,且分子质量在20~35 ku。FGFs是由垂体和下丘脑经旁分泌或自分泌产生的多肽,它能促进细胞迁移、增殖和分化,使胚胎发育、肿瘤形成,对损伤组织的修复也有较大作用[7-8]。FGF9是成纤维细胞生长因子家族中的重要成员之一,最早在人类神经胶质瘤细胞中分离得到[9],编码208个氨基酸,所具有的三叶草核心结构需要与肝素结合激活受体来发挥作用,受体通常为FGFR2和FGFR3。研究发现FGF9mRNA在人体各组织中广泛表达,尤其是在脑、肾、子宫和骨组织中,但FGF9蛋白在正常生理条件下以相对低的水平表达。FGF9可以促进上皮细胞、神经胶质细胞和成纤维细胞等的增殖,对胚胎期生殖系统和肺组织的发育也有重要作用[10]。此外,FGF9敲除小鼠出生后死于肺细胞缺氧,并表现出各种异常现象,如睾丸发育不全和男女性别逆转[11]。FGF9的异常表达还与几种人类癌症如子宫内膜癌[12]和子宫内膜异位症有关。这些研究提示必须严格控制FGF9的表达以维持机体内平衡。综上所述,目前关于FGF9的研究主要集中在性别决定、骨骼发育与损伤修复、卵巢癌肿瘤等方面[13-16]。尚未见FGF9在山羊中的报道,其是否与山羊肌肉生长有关,是否可作为肌肉生长的关键调控基因还有待进一步地研究。
本试验以生长速度快、肉质特性好的简州大耳羊为研究对象,采用RT-PCR技术克隆获得FGF9基因序列,然后利用实时荧光定量PCR技术分析组织表达特性,构建该基因的组织表达谱,同时检测其在山羊成肌细胞分化过程中的表达模式,旨在为后续研究FGF9基因在山羊成肌细胞分化中的调控作用提供重要数据。
1 材料和方法
1.1 试验材料
1.1.1 试验动物及取材 在四川省简阳市大哥大牧业有限公司挑选6只健康的1周岁简州大耳羊公羊,将其空腹颈动脉放血致死,无菌采集各山羊心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织,用0.1% DEPC水冲洗干净裹上锡箔纸装入冻存管,迅速放入液氮内带回实验室用于提取组织总 RNA。山羊成肌细胞则由实验室前期试验分离得到,并冻存于液氮罐内备用。
1.1.2 主要试剂 TRIzol试剂、pMD-19T载体、荧光定量试剂盒(TaKaRa公司,大连);DNA 聚合酶、总RNA提取试剂盒、大肠杆菌感受态细胞DH5α(天根生化科技有限公司,北京);反转录试剂盒(Thermo公司,美国);胶回收试剂盒(Axygen公司,美国);DEPC、胎牛血清、DMEM培养基、油酸(Sigma公司,美国)。
1.2 试验方法
1.2.1 山羊FGF9基因的克隆测序 根据GenBank公布的山羊FGF9基因预测序列(登录号为XM_005687564.3)在Primer Premier 5.0软件上设计PCR引物(表1)。研磨成年羊肺组织样品,用TRIzol法提取总RNA,电泳检测正确并用紫外分光光度计测得总RNA的OD值在1.8~2.0,符合试验要求。参照反转录试剂盒(Revert Aid First Strand cDNA Synthesis Kit)说明书,按2 μg反转录获得cDNA。PCR反应体系:DNA聚合酶12.5 μL、模板cDNA 1.0 μL、上下游引物(10 μmol/L)各1 μL、ddH2O 9.5 μL。 PCR程序设定:94 ℃预变性4 min;94 ℃ 20 s,58 ℃ 60 s,72 ℃ 90 s,32个循环;72 ℃延伸 10 min。PCR产物经2%琼脂糖凝胶电泳检测正确后,做胶回收再连接pMD-19T 载体,转化感受态细胞DH5α,37 ℃过夜培养,挑取阳性单克隆经菌液PCR鉴定正确后送成都擎科梓熙生物技术有限公司测序。
1.2.2FGF9基因序列分析 测序结果在NCBI的Blast上比对序列同源性,用MEGA 5.0 绘制系统进化树,应用ExPASy分析蛋白质的基本理化性质,利用Signal P 4.1 分析信号肽序列,通过TMHMM 2.0预测蛋白跨膜结构域,使用Net Phos 3.1预测FGF9蛋白磷酸化位点,采用Hopfield和PHYRE2 Server工具进行二级结构和三级结构预测。
1.2.3FGF9基因组织表达谱的构建 用TRIzol法提取成年羊(6只)心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织总RNA,反转录得到cDNA。根据1.2.1中克隆的FGF9基因序列与NCBI公布的山羊磷酸三丁酯(Tributyl phosphate,TBP)序列(登录号为XM_018053502.1),在Primer Premier 5.0 软件上分别设计特异性引物(表1)。采用实时荧光定量 PCR(qPCR)检测FGF9mRNA在简州大耳羊各组织中的表达水平,构建其组织表达谱。qPCR反应体系:SYBR ®Premix ExTaqTM(2×) PCR 10 μL,模板cDNA 1 μL,上下游引物(10 μmol/L)各 1 μL,ddH2O 7 μL。程序设定:95 ℃预变性 3 min;95 ℃ 10 s,66 ℃ 10 s,72 ℃延伸15 s,39个循环。
1.2.4 山羊成肌细胞的复苏 取山羊脂肪代谢实验室前期冻存的山羊成肌细胞,迅速置于37 ℃水浴锅内振荡解冻。待细胞复苏后转入100 mm培养皿,用含10%胎牛血清的DMEM 培养基在 37 ℃、5%CO2培养箱中培养,传代。
1.2.5FGF9基因在山羊成肌细胞分化中的表达差异 成肌细胞传至第3代且有90% 的细胞发生融合时,用终浓度100 μmol/L的油酸诱导完全培养基中的细胞进行分化,收集分化0.0,0.5,1.0,2.0,4.0 d的肌肉细胞,参照细胞RNA提取试剂盒说明书提取细胞中总RNA,再用RNA反转录试剂盒按1 μg将其反转录为cDNA。根据NCBI公布的山羊18SrRNA基因序列(登录号为DQ149973.1),在Primer Premier 5.0 软件上设计特异性引物(表1)。利用qPCR技术,对不同分化天数的肌肉细胞中FGF9基因表达量进行检测,qPCR反应体系及条件同1.2.3。
1.2.6 数据统计与分析 定量数据用2-ΔΔCt方法计算,其中ΔΔCt=(CtFGF9-CtTBP)试验组-(CtFGF9-CtTBP)对照组,计算结果在SPSS 18.0中进行单因素方差分析和显著性检验,P<0.05为差异显著,P<0.01为差异极显著。试验数据均用“平均值±标准差(X±SD)”表示。

表1 引物信息Tab.1 Primer information
注:S.正义链引物; A.反义链引物; TBP.磷酸三丁酯。
Note:S.Sense primer; A.Antisense primer;TBP.Tributyl phosphate.
2 结果与分析
2.1 山羊FGF9基因克隆及同源性分析
经克隆测序得到1条长818 bp的FGF9基因序列,包括627 bp的编码区,编码了208个氨基酸(图1),另有88 bp的 5′UTR序列和103 bp的3′UTR序列,上传全长序列到NCBI获得GenBank登录号:MH358358。同源性分析表明,山羊FGF9基因的CDS区序列与绵羊(XM_004012161.3)、牛(NM001245926.1)和獐鹿(HG326981.1)的同源性高达99%,与猪(AK343298.1)、大鼠(NM_012952.1)的同源性达91%,与小鼠(HM988990.1)和人(NM_002010.2)的同源性为90%。构建的系统进化树(图2)显示,山羊FGF9基因序列在各物种进化上是高度保守的,尤其与绵羊亲缘关系最近。
2.2 FGF9基因生物信息学分析
蛋白质理化性质分析发现,FGF9蛋白理论分子质量为23.38 ku,等电点为7.06,属于不稳定亲水蛋白。利用Signal P 4.1 Server预测FGF9 蛋白的信号肽序列(图3),发现其中并不存在信号肽序列。利用SMART软件预测蛋白结构域,发现该蛋白具有1个跨膜结构域,跨膜结构在第17-33个氨基酸残基,还有1个从第60-190个氨基酸残基的FGF特有结构域。磷酸化位点对蛋白质功能具有重要作用,运用 Net Phos 3.1 软件对FGF9 蛋白可能的磷酸化位点进行分析,发现该蛋白具有6个酪氨酸、7个苏氨酸和8个丝氨酸磷酸化位点(图4),第625个氨基酸残基处还有1个O-糖基化位点,但无N-糖基化位点。

起始密码子用方框表示;跨膜结构域(AA17-33)下划黑色双线;阴影部分(AA60-190)为FGF家族同源性结构域;*表示终止密码子。The start codon (ATG) is represented by the box;Transmembrane spaning domain(AA17-33)is under black double line;FGFs homologous domain is indicated as shaded residues(AA60-190);*Represents the stop codon.
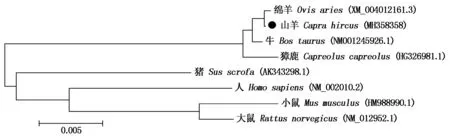
图2 采用MEGA 5.0构建山羊FGF9序列系统进化树Fig.2 Phylogenetic tree was constructed based on FGF9 sequence using MEGA 5.0

图3 山羊FGF9蛋白的信号肽分析Fig.3 Signal peptide analysis of goat FGF9 protein
二级结构预测显示FGF9蛋白主要有3种存在形式,包括66.35% 的无规卷曲(c),17.31% 的β-折叠(e)和16.35% 的α-螺旋(h)。并且用PHYRE2 Server(http://www.sbg.bio.ic.ac.uk/~phyre2/html/page.cgi? id=index)分析了该蛋白的三级结构(图5)。利用STRING数据库搜索到GRB2、MAPK3、FGFR3等蛋白可能和FGF9蛋白存在相互作用(图6)。采用PSORT Ⅱ进行亚细胞定位,发现该蛋白主要在线粒体(30.4%)、细胞质(30.4%)和高尔基体(13.0%)中发挥生物学作用。

图4 山羊FGF9序列的磷酸化位点预测Fig.4 Predicted phosphorylation site in FGF9 sequence
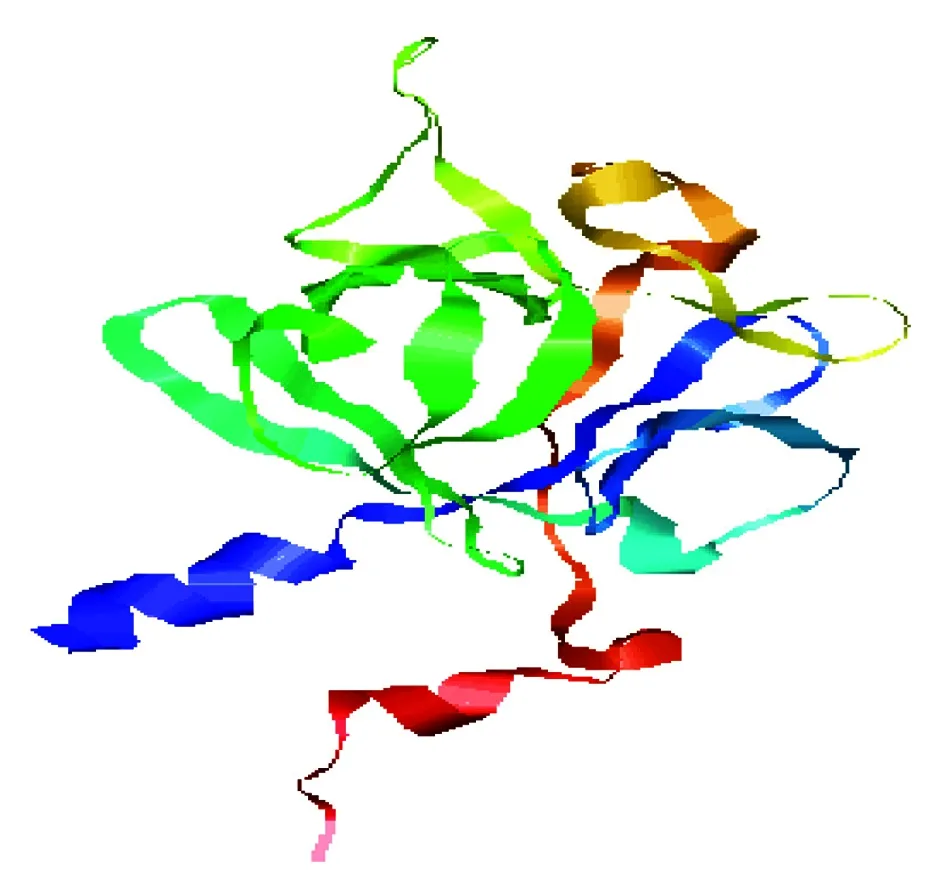
图5 山羊FGF9蛋白三级结构预测Fig.5 Tertiary structure prediction of goat FGF9 protein

图6 与山羊FGF9蛋白相互作用蛋白预测Fig.6 Prediction of proteins interacting with goat FGF9 protein
2.3 山羊FGF9基因组织表达谱的构建
以TBP为内参基因,用qPCR技术检测FGF9基因的组织表达情况,根据在山羊不同组织的表达差异构建组织表达谱。结果发现在心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌中均检测到FGF9的表达,但表达程度不同,肾脏中的相对表达量最高,且极显著高于其他被测组织(P<0.01),小肠组织次之,肝脏和脾脏最低(图7)。

不同大写字母表示差异极显著(P<0.01)。Different capital letter indicate extremely significant differences(P<0.01).
2.4 FGF9基因在山羊成肌细胞分化中的表达差异
以18SrRNA为内参基因,采用qPCR技术检测FGF9基因在山羊成肌细胞不同分化阶段的表达情况(以0 d的表达水平为对照)(图8),结果发现FGF9基因在成肌细胞诱导分化第2天表达水平显著高于分化前(P<0.05),且在第4天达到极显著水平(P<0.01)。
3 结论与讨论
FGF9作为成纤维细胞生长因子家族(FGFs)成员之一,是参与许多生理过程的有效促分裂剂,它能刺激中胚层和神经外胚层细胞生长,促进分化[17]。近年来,有关FGF9的研究不断深入,发现FGF9活化FGFR2、FGFR3可以促进成骨细胞生长,提高骨密度[18-19],揭示FGF/FGFR信号传导是维持成体骨稳态的重要途径。先天性缺乏FGF9可导致显著的骨骼软骨发育不良,同时发现在颅面骨、椎骨和肋骨中还有其他的缺陷,但是给予体外培养的小鼠颅骨FGF9后,发现颅缝愈合、骨细胞分化增强[20]。这说明在骨骼发育中,FGF9可以促进软骨内骨化和膜内成骨。FGF9还可以直接调节骨代谢,裴育等[21]发现FGF9通过MAPK信号通路抑制小鼠MA3T3-E1和C2C12细胞中Cbfa1基因的启动子活性和mRNA水平,推测可能有其他FGF家族成员与FGF9形成互补,共同调节成骨细胞分化。Frontini等[22]报道,FGF9通过SHH和血小板源性生长因子受体β(PDGFRβ) 在刺激平滑肌细胞形成微管的过程中发挥关键作用。但FGF9在山羊肌肉生长中的作用,及其在成肌细胞分化中的研究还尚未见报道。

不同大写字母表示差异极显著(P<0.01);不同小写字母表示差异显著(P<0.05)。Different capital letter indicate extremely significant differences(P<0.01);Different lowercases indicate significant differences (P<0.05).
本试验克隆获得山羊FGF9基因序列818 bp,其中CDS区627 bp,编码208个氨基酸,与NCBI上公布的绵羊、牛、獐鹿、猪、大鼠、小鼠和人的CDS区序列分别有99%,99%,99%,91%,91%,90%,90%的同源性,表明FGF9在不同种属间有着较高的同源性。通过蛋白结构域预测,发现FGF9蛋白具有1个跨膜结构域和1个FGF同源结构域[23]。但是信号肽预测结果显示,在FGF9蛋白中不存在信号肽序列,有文献称FGF9 N端的35个氨基酸作为非剪切信号肽可以替代经典的信号肽,使FGF9同其他分泌蛋白一样分泌到胞外[24]。相互作用蛋白分析则显示该蛋白可能和GRB2、MAPK3、FGFR3等蛋白存在相互作用。
本试验利用qPCR技术进一步研究了FGF9mRNA在1周岁山羊体内的表达情况,根据组织表达谱分析,发现该基因在体内各组织中广泛表达,在肾脏中表达量最高,极显著高于其他组织,其次是小肠,表达最低的是肝脏和脾脏。在牛和小鼠的研究中也同样证明了FGF9基因具有在各组织中广泛表达的特点[17,25]。陈晓怡等[26]研究发现,FGF9在小鼠心、肝、肺、肾、大脑、小脑、骨骼肌等12种组织中均有表达,且在心、肾、小脑和骨骼肌中高表达,在大脑和关节中表达较弱。这些报道与本试验结果存在相似及不同之处。
前人在研究FGF家族时,比较过其他几个分泌型FGFs,发现FGF4、FGF5、FGF6在骨骼肌成肌细胞亚群中以肌管形成的形式表达[27-29],而FGF9则以另一种不同的时空模式在小鼠成肌细胞中表达,在E9.5和E10.5的肌节中检测到FGF9mRNA的表达,在E12.5中通过比较FGF9和α-心肌肌动蛋白探针杂交相邻部分,证明了FGF9在E12.5的小鼠头部和躯干的大部分乃至全部骨骼肌成肌细胞中表达[30]。在本试验中,检测了FGF9在山羊成肌细胞不同分化阶段的表达水平,发现该基因在成肌细胞诱导分化第2天表达水平显著高于分化前(P<0.05),且在第4天达到极显著水平(P<0.01),由此推测其可能参与山羊肌肉组织的生长。
本研究成功克隆山羊FGF9基因,序列长818 bp,其中CDS区627 bp,编码208个氨基酸。获得GenBank登录号:MH358358。FGF9基因在山羊心、肝、脾、肺、肾、小肠、瘤胃、皮下脂肪和背最长肌等组织中存在广泛表达,且在肾脏组织中存在较高水平表达。FGF9在成肌细胞诱导分化第2天表达水平显著高于分化前,且在第4天达到极显著水平,推测其可能作为调控山羊成肌细胞分化的候选基因。本研究为进一步探究FGF9基因在山羊肌肉生长中的作用提供基础数据。

