豆粕和发酵豆粕替代鱼粉对黄河鲤生长和血清抗氧化性能及消化酶活性的影响
■殷海成 黄 进 李昕朔 郑 鑫
(1.国家粮食局粮油食品工程技术研究中心,河南郑州450001;2.河南工业大学生物工程学院,河南郑州450001)
“豫选黄河鲤”(Cyprinus carpio-haematopterus)是国家水产良种认证委员会审定通过的优良推广品种,是河南省区域养殖的主要经济鱼类之一[1],其配合饲料所用蛋白源主要是鱼粉[2]。目前,鱼粉供给紧张、价格偏高等原因,探讨豆粕(soybean meal,SBM)替代鱼粉成为研究的热点。豆粕富含蛋白质以及相对平衡的氨基酸,而且价格低廉,因此,常用豆粕替代鱼粉用于水产动物饲料。然而,豆粕适口性差、蛋氨酸、赖氨酸等必需氨基酸含量偏低以及含有多种抗营养因子,过高比例替代鱼粉对水产养殖鱼类产生不良的影响[3-4]。研究表明,用30%豆粕替代鱼粉饲喂大黄鱼(Larimichthys crocea)[5]和34.25%~45.46%豆粕替代鱼粉饲喂齐口裂腹鱼(Schizothorax prenanti)[6]不影响生长性能,增加豆粕替代水平造成其肠道和肝脏损伤。同样,吴莉芳等[7]在研究鲤、胡鲇(Clarias fuscus)和草鱼饲料中添加大豆球蛋白(60 mg/g)和β-伴大豆球蛋白(40 mg/g)发现均引起3 种鱼的肠道损伤。为降低豆粕中的抗营养因子,常采用发酵技术处理豆粕,以减少豆粕的抗营养因子含量[8]。Gao 等[9]使用短乳杆菌(Lactobacillus brevis)和米曲霉(Aspergillus oryzae)发酵豆粕,发现L.brevis和A.oryzae分别使豆粕中胰蛋白酶抑制因子降低了57.1%和89.2%;Song等[10]利用酿酒酵母(Saccharomyces cerevisiae)发酵豆粕48 h,其发酵豆粕(fermented soybean meal,FSBM)中的大豆抗原蛋白降低了88.0%。除此之外,豆粕经发酵后,还改善其适口性,增加益生菌和其活性组分以改善鱼类肠道菌群和提高鱼对蛋白等营养物质的消化吸收[11]。目前关于“黄河鲤”幼鱼饲料的研究主要集中在饲料蛋白源和脂肪源、蛋白和脂肪水平及豆粕添加量等对生长性能和血清相关指标研究[12-13],但尚未见豆粕和发酵豆粕替代鱼粉效果的比较研究。因此,本试验以“豫选黄河鲤”幼鱼为研究对象,选用豆粕和多菌种发酵豆粕分别替代部分鱼粉,探讨对幼鲤的生长和血清抗氧化性能及消化酶活性的影响,以期为幼鲤蛋白源合理选用和豆粕替代鱼粉配制水产动物饲料提供参考。
1 材料与方法
1.1 试验材料和饲料配制
豆粕由开封正大有限公司提供,同一批次豆粕经本实验室培养的Bacillus sublitis(ACCC 01746)、Sac⁃charomyces sp(CICIM Y0362)和Lactococcus lactis(ACCC 11092)三种菌株按照本课题组Guan 等[14]优化的实验方法,在30 ℃混合液态发酵8 h,经45 ℃风干6 h制成。豆粕和发酵豆粕的营养组成见表1。

表1 豆粕与发酵豆粕的营养组成(%干物质)
试验饲料以酪蛋白、鱼粉、SBM 和FSBM 为蛋白源,鱼油和豆油为脂肪源,α-淀粉、糊精、微晶纤维素为主要碳水化合物,配制42%鱼粉(对照组,FM)、27%鱼粉+25%SBM(SBM25)、27%鱼粉+23%FSBM(FSBM23)、12%鱼粉+50%SBM(SBM50)和12%鱼粉+46%FSBM(FSBM46)的5 组等氮(粗蛋白质约38.50%)等能(粗脂肪约8.0%)的饲料(见表2)。除油脂外的其他各原料组分经粉碎过60 目筛,按配方标准称重,逐级放大混合,加油、加水拌匀,用SLKL-120B 型制粒机(曲阜市圣鲁机械厂)制成直径1.0 mm 的颗粒饲料,于40 ℃下烘干6 h,4 ℃冰箱中保存备用。
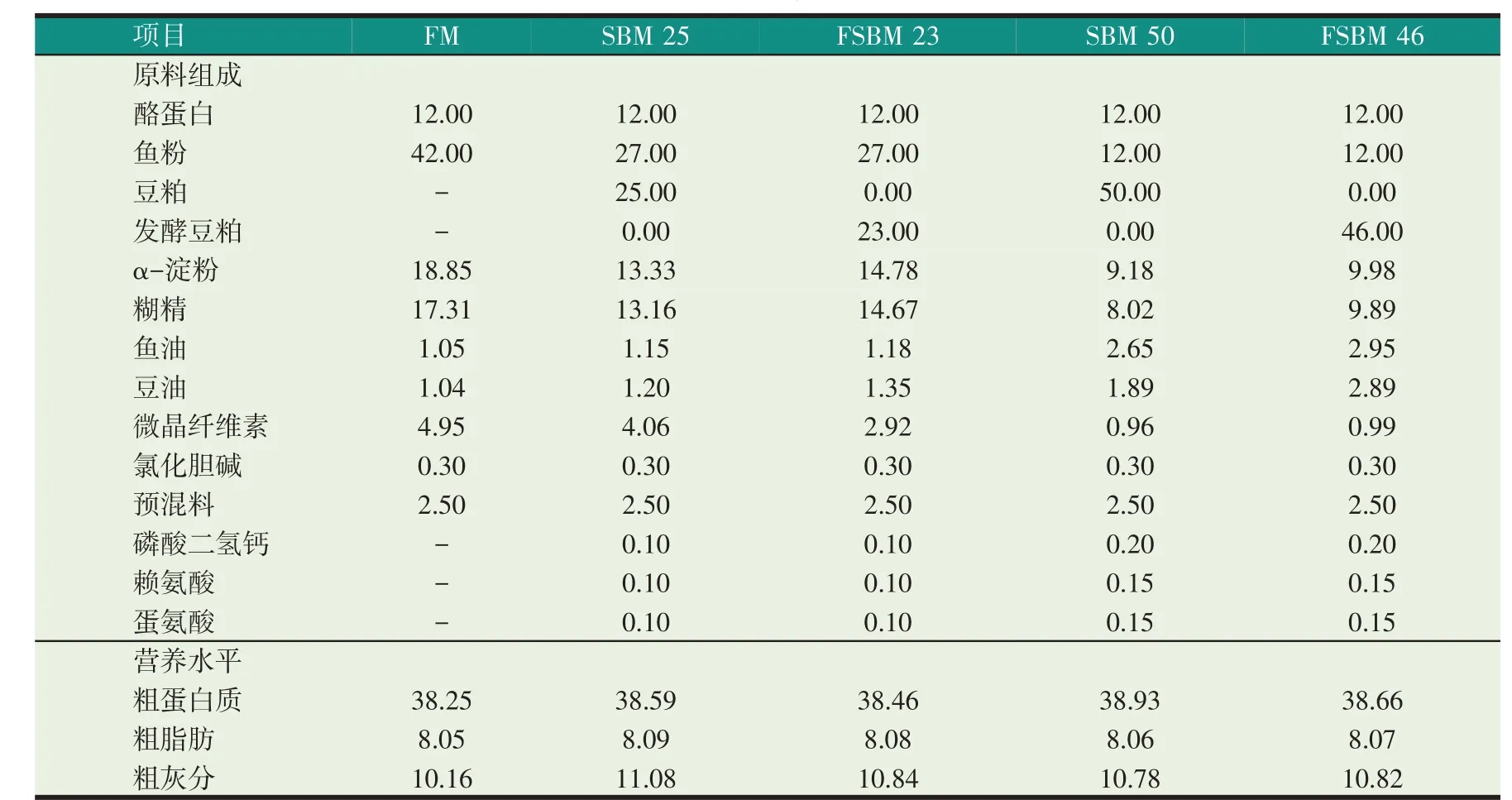
表2 饲料组成及营养水平(%干物质)
1.2 试验鱼与管理
试验用“豫选黄河鲤”幼鱼购于河南省水产科学研究院种鱼繁殖场,并在河南工业大学生物工程学院鱼类营养实验室进行为期2周的驯化(驯化期用鱼粉配制的全价饲料进行饲喂)。驯化结束,随机选择600 尾、体质量为(49.76±0.24)g 幼鲤,分成5 组,每组3 个重复,每个重复养殖幼鲤40尾,分养于15个体积为长(100 cm)×宽(60 cm)×高(70 cm)、安装自动循环微流水系统的深蓝水族箱(有效的水体容积80%)中,进行为期56 d 的养殖试验。试验期间,每天9:00 和17:00 投喂饲料,投喂量分别为体质量的1.2%和1.8%。整个试验期间,养殖用水为曝气的自来水,每日换水量约占总水量的1/3,水温控制在(26±0.5)℃之间、溶氧大于6.0 mg/l、氨氮低于0.1 mg/l、pH值6.8。
1.3 样品采集与测定指标
56 d 的试验结束后,对各组幼鲤禁食24 h,以0.03%的MS-222麻醉,然后计数,测体质量和体长,计算各组平均增重率(SGR)、饲料系数(FCR)、蛋白质效率(PER)和肥满度(CF)。各重复组随机选取幼鲤10 尾,剖腹,心脏取血,分离肠管。血液在3 000 r/min离心25 min,分离血清,-70 ℃冰箱保存,用于测定血清超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)和总抗氧化能力(T-AOC);取出肠道,剔除附着物,第一个肠回转点之前为前肠,最后一个回转点之后为后肠,中间部分为中肠,分别用去离子水冲洗干净并用滤纸吸干,加10 倍体积的去离子水进行匀浆,4 ℃冰箱中静置2 h,随后5 000 r/min离心10 min,取上清液,4 ℃冰箱保存,24 h内用于测定前、中、后肠蛋白酶、淀粉酶和脂肪酶活性。
1.4 血清酶活性、生化指标以及肠消化酶活性检测
血清和肠主要检测指标均采用南京建成生物工程有限公司试剂盒检测,具体步骤按说明书的描述进行。其中,血清CAT 采用紫外吸收法测定,其酶活单位以1 min 内A240减少0.1 的酶量为1 个U;SOD 采用黄嘌呤氧化酶法,当反应体系中有50%的抑制百分率时的酶量定义为一个SOD活力单位(U)、MDA含量采用MDA 与TBA 缩合形成红色复合物,检测532 nm处的最大吸光值可计算MDA 含量;T-AOC 采用可见分光光度法,活力单位表示为37 ℃时,每分钟每毫升血清使反应体系的吸光值每增加0.01 为一个单位[11]。消化酶活性按照检测试剂盒(南京建成生物工程研究所)说明书严格执行操作。37 ℃下,各酶活单位分别为pH 值8.0 时,每毫克(mg)蛋白中含有的蛋白酶,每分钟(min)使吸光度变化0.003 即为一个蛋白酶活单位;每克(g)蛋白与底物反应1 min,每消耗1 μmol 底物为一个脂肪酶活单位;每毫克(mg)蛋白与底物作用30 min,水解10 mg淀粉为一个淀粉酶活性单位,各酶活单位表示为U/mg。
1.5 计算及数据处理
成活率(Survival rate,SR,%)=100×Nt/N0;
增重率(WGR,%)=100×(Wt-W0)/W0;
饲料系数(FCR)=总饲料投喂量/总(Wt-W0+死亡鱼体质量);
蛋白质效率(PER,%)=100×总(Wt-W0)/(总饲料投喂量×饲料蛋白含量);
肥满度(CF,g/cm3)=100×Wt/L3。
式中:Nt、N0——分别为实验结束时和实验开始时“豫选黄河鲤”幼鱼的存活数;
Wt、W0——分别为实验末期和初期的平均体质量(g);
L——体长(cm)。
试验数据以“平均数±标准差”(Mean±SD)表示,各组数据用SPSS 17.0 软件进行单因素方差分析(One-way ANOVA),若组间差异显著再进行Tukey's检验,显著差异水平用P<0.05表示。
2 结果
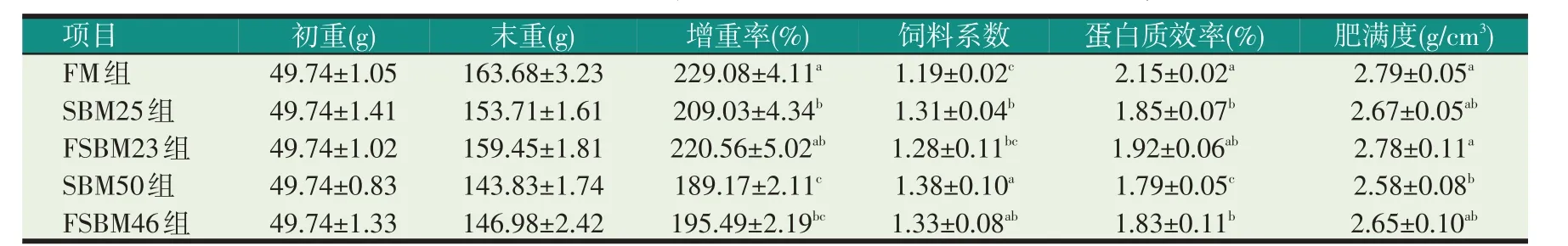
表3 豆粕和发酵豆粕替代鱼粉对幼鲤生长和饲料利用的影响
2.1 豆粕和发酵豆粕替代鱼粉对幼鲤生长及饲料利用率的影响(见表3)
由表3 可知,各组幼鲤的成活率均为100%。对照组(FM)的WGR、PER 和CF 最高,而FCR 最低,其中,WGR 和PER 显著高于SBM25、SBM50 组和FSBM46 组(P<0.05),但与FSBM23 组差异不显著(P>0.05),FCR 显著低于SBM25、SBM50 组和FS⁃BM46 组(P<0.05),但与FSBM23 组差异不显著(P>0.05);对照组(FM)的CF 与SBM25、FSBM23 组和FSBM46 组 差 异 不 显 著(P>0.05),但 显 著 高 于SBM50 组(P<0.05)。SBM25、FSBM23 组和FSBM46组的WGR、FCR、PER 和CF 差异不显著(P>0.05),但SBM25 组和SBM23 组的WGR 和PER 显著高于SBM50 组,FCR 显著低于SBM50 组(P<0.05),而CF在SBM25 组和FSBM46 组与SBM50 组差异不显著(P>0.05)。
2.2 豆粕和发酵豆粕替代鱼粉对幼鲤血清抗氧化性能的影响(见表4)

表4 豆粕和发酵豆粕替代鱼粉对幼鲤血清抗氧化性能的影响
由表4 可知,幼鲤血清中CAT、SOD、GSH-Px 和T-AOC 活 性 在FM 组 最 高,相 反,MDA 含 量 最 低。FSBM23 组CAT 活 性显著高 于SBM25 组和SBM50 组(P<0.05),但与FSBM46 组差异不显著(P>0.05),最低为SBM50 组,但与SBM25 组差异不显著(P>0.05);SOD 活性在SBM25 组、FSBM23 和FSBM46 组以及SBM25 组与SBM50 组差异不显著(P>0.05),但显著低于FM 组(P<0.05);SBM50 组的MDA 含量最高,显 著 高 于FM 和FSBM23 组(P<0.05),但 与SBM25 组和FSBM46 组差异不显著(P>0.05);GSHPx 和T-AOC 活性在FM 组和FSBM23 组组间以及SBM25、FSBM23、SBM50 组和FSBM46 组间差异不显著(P>0.05),但SBM25、SBM50 组和FSBM46 组显著低于FM 组(P<0.05)。
2.3 豆粕和发酵豆粕替代鱼粉对幼鲤消化酶活性的影响(见表5)

表5 豆粕和发酵豆粕替代鱼粉对幼鲤肠道消化酶活性的影响(U/mg)
由表5 可知,前、中、后肠的蛋白酶活性在FM 组均为最高,SBM50 组最低,且两者差异显著(P<0.05)。在前肠和中肠中,SBM25、FSBM23 组和FS⁃BM46组组间差异不显著,但都显著高于SBM50组,显著低于FM 组(FSBM23 组除外)(P<0.05);在后肠中,SBM25、FSBM23 组和FSBM46 组与FM 组差异不显著(P>0.05),但显著高于SBM50组(FSBM46组除外)(P<0.05)。在前肠,FM 组的淀粉酶活性最低,显著低于其他组,FSBM23组最高,显著高于其他组(FSBM46组除外)(P<0.05);在中肠和后肠,FM 组淀粉酶活性最高,其中中肠显著高于SBM25 组和SBM50 组(P<0.05),但与FSBM23 组和FSBM46 组差异不显著(P>0.05),后 肠 显 著 高 于SBM50 组 和FSBM46 组(P<0.05),但与SBM25 组和FSBM23 组差异不显著(P>0.05)。在前肠,FM 组脂肪酶活性最高,显著高于其他组(P<0.05),SBM25 和FSBM23 组显著高于SBM50组和FSBM46 组(P<0.05),但两组间差异不显著(P>0.05);中肠和后肠的脂肪酶活性在FM 组最低,显著低于其他组(P<0.05),其中SBM25 组和FSBM23 组显著高于SBM50组和FSBM46组(中肠FSBM46组除外)(P<0.05)。
3 讨论
3.1 豆粕和发酵豆粕替代鱼粉对幼鲤生长和饲料利用的影响
研究表明,适量豆粕替代鱼粉对水产养殖动物的生长性能无显著性影响,但当替代水平不断提高,则抑制水产动物生长性能[5]。饲料中用豆粕替代少于40%的鱼粉时,其生长性能无显著差异,高于40%则生长性能下降[15]。本试验中,SBM25、SBM50 组和FS⁃BM46组幼鲤WGR显著低于FM组,相反,FCR显著高于FM 组,但FSBM23 组各指标与FM 组差异不显著。由此可知,豆粕对于幼鲤的生长性能影响较大,而适量的发酵豆粕不影响幼鲤生长。发酵豆粕的促生长作用研究较多,李云兰等[16]研究发现,发酵豆粕中胰蛋白酶抑制因子(STI)、大豆抗原蛋白的含量显著降低,替代鱼粉饲喂鲤鱼显著提高其生长性能。类似研究发现,发酵的豆粕替代方正鲫饲料中的鱼粉,具有显著促生长作用[17];同样研究也在南美白对虾(Penae⁃us vannamei)养殖中得以证实[18]。主要原因在于发酵的豆粕中,大豆抗原蛋白等抗营养因子含量显著降低,小肽含量增加,游离的氨基酸含量提高等,使发酵豆粕比豆粕更利于水产养殖动物的消化和吸收[19]。
3.2 豆粕和发酵豆粕替代鱼粉对幼鲤血清抗氧化能力的影响
鱼类机体新陈代谢产生的过量氧自由基,能通过其体内的酶系和非酶系抗氧化系统进行清除,维持机体内稳态[20]。SOD 是生物体内抗氧化系统中唯一以自由基为底物的抗氧化酶,通过歧化反应,清除体内过量的超氧化物自由基,产生的H2O2由CAT催化分解生成H2O和O2,从而避免鱼体内氧化损伤。若氧自由基清除不及时,则产生大量丙二醛,加重组织细胞的氧化损伤[21]。动物机体各抗氧化酶活性互相影响,用T-AOC能体现机体总抗氧化能力,可用于衡量抗氧化性能的综合指标。本研究中,FM 组幼鲤血清鲤的抗氧化能力总体显著高于其他各组,但CAT 活性在FS⁃BM46 组显著低于FM 组,GSH-Px 和T-AOC 活性在FSBM23组与FM组无显著差异,且豆粕组抗氧化活性低于发酵豆粕组,提示幼鲤的抗氧化性能受豆粕和发酵豆粕的影响。已知研究表明,对比豆粕,发酵豆粕含有活性更高的大豆异黄酮和小肽等,具有增强机体抗氧化功能和改善肝功能的作用[22]。原因在于发酵的豆粕中,大豆异黄酮糖苷被降解为大豆异黄酮苷元,具有较强的抗氧化性,此外,高含量的大豆异黄酮能激活CAT 的启动子以促进CAT mRNA 的表达,从而进一步提高CAT 活性,增强机体抗氧化能力[23]。而高水平添加豆粕使血清丙二醛含量显著升高,丙二醛是脂质过氧化终产物,而脂质过氧化导致蛋白质损伤[24]。除此之外,研究证实大多数益生菌具有提高机体抗氧化能力,而发酵豆粕中枯草芽孢杆菌进入幼鲤肠道后能通过分泌抗氧化酶或者作为抗氧化酶激活剂促进其抗氧化酶分泌,从而增强幼鲤的抗氧化性能[25]。因此使用枯草芽孢杆菌等发酵的豆粕适量添加到饲料中可以提高幼鲤抗氧化性能。
3.3 豆粕和发酵豆粕替代鱼粉对幼鲤肠道消化酶活性的影响
消化酶作为反映鱼类对饲料的消化力和饲料利用能力的关键酶,对于同一种鱼(如鲤鱼),不同的消化酶分泌部位其消化酶的活性不同,这与其食性有关[26]。利用豆粕替代鱼粉配制鱼类饲料研究其消化酶的活性,可为豆粕型全价饲料的开发奠定基础。然而,研究显示,鱼类饲料中高水平添加豆粕可抑制其肠道的消化酶活性,其因在于豆粕中含有胰蛋白酶抑制因子、大豆抗原蛋白、植酸等多种抗营养因子[27]。本试验结果显示,FM 组幼鲤前肠和中肠的蛋白酶活性显著高于SBM25、SBM50 组和FSBM46 组,而与FS⁃BM23 组差异不显著;后肠蛋白酶活性FM、SBM25 组和FSBM23 组与FSBM46 组差异不显著,但都显著高于SBM50 组,显然,幼鲤饲料中添加豆粕和发酵豆粕使蛋白酶活性降低,这与大豆胰蛋白酶抑制因子、大豆抗原蛋白等有关[26]。FM组幼鲤前肠淀粉酶活性显著低于其他组,中肠和后肠淀粉酶活性显著高于SBM25(中肠)、SBM50 组和FSBM46 组(后肠)。而FM 组脂肪酶活性在前肠显著高于其他组,中肠和后肠显著低于其他组。这可能原因是豆粕富含碳水化合物,诱导幼鲤前肠分泌淀粉酶,提高了前肠淀粉酶活力[27],关于豆粕和发酵豆粕引起幼鲤中肠和后肠淀粉酶活力下降还需进一步研究。另外,豆粕和发酵豆粕使幼鲤中肠和后肠脂肪酶活性增强,这可能是豆粕和发酵豆粕中胰蛋白酶抑制因子被酶解有关,消除对蛋白酶活性的抑制作用[26]。此外,发酵豆粕对比豆粕发现蛋白酶、淀粉酶活性明显增强,而脂肪酶活性影响较小,甚至略有降低。表明发酵豆粕在促进幼鲤蛋白酶和脂肪酶活性优于豆粕,有利于提高蛋白质和淀粉转化;而对于脂肪酶活性影响还有待进一步研究。
4 结论
本试验表明,从幼鲤的生长、血清抗氧化指标以及肠道消化酶活性等综合分析可知,幼鲤饲料中,鱼粉是不可或缺的组分,使用豆粕和发酵豆粕替代鱼粉对于其生长和饲料利用有较大的影响;饲料中用23%的发酵豆粕替代15%的鱼粉不影响幼鲤生长、蛋白酶活性和总抗氧化能力,但血清CAT 和SOD 活性降低,并使前肠淀粉酶活性、中肠和后肠脂肪酶活性增加,而前肠脂肪酶活性降低。50%豆粕和46%发酵豆粕分别替代30%的鱼粉,幼鲤的生长性能、血清抗氧化以及肠道消化酶活性显著降低。

