酪酸菌对集装箱养殖的宝石鲈生长性能及肠道菌群的影响
■张明清 周惠强 舒 琥* 郭静文 钟东明 侯丽萍 舒 锐
(1.广州大学生命科学学院,广东广州510006;2.广州大学环境科学与工程学院,广东广州510006;3.上海观星农业科技有限公司,上海200125)
在过去的几十年,我国水产养殖业取得了稳步的发展,成功的从“以捕为主”转变为“以养为主”,极大的满足了人们对水产品的需求[1]。但在水产养殖业发展的同时,其也对周边的生态环境产生了显著的影响,成为了一种潜在的污染源[2]。这迫使水产养殖业向着高密度集约化的养殖方式转变,在这一过程中集装箱循环水养殖模式在生产和效益上展现出巨大的优越性。集装箱循环水养殖模式是以集装箱为载体,集成了水质循环与检测、生物过滤以及物理杀菌等功能,能够有效净化水质,减少疾病的发生,具有绿色环保、健康高效等优点[3-4]。但在集装箱循环水养殖过程中,为了进一步提高水产品的成活率,常出现抗生素滥用以及耐药菌产生的情况[5]。而益生菌作为一种饲料添加剂或水体改良剂,具有快速吸收分解水体污染物、提高宿主生长性能和肠道健康等作用,在水产养殖业得到了广泛的应用[6-8]。本实验旨在研究酪酸菌对集装箱养殖条件下澳洲宝石鲈生长性能及肠道菌群的影响,为在集装箱循环水养殖中应用和推广酪酸菌提供依据。
1 材料和方法
1.1 实验饲料
实验饲料包括基础饲料和酪酸菌饲料(酪酸菌饲料由不同用量的酪酸菌和基础饲料混匀制得)。实验所用基础饲料为恒兴牌海水鱼膨化配合饲料9912,其主要营养水平为(%):粗蛋白质42.0、粗脂肪5.0、粗纤维4.0、钙1.0~4.0、总磷1.0、氯化钠0.5~3.0、赖氨酸2.1、水分12.0。按照0.1%、0.5%、1.0%比例称取酪酸菌(Clostridium butyricum)菌粉,溶于100 ml蒸馏水中混匀,均匀喷洒到基础饲料上,避光、风干后即制成了含有不同浓度酪酸菌的实验饲料(见表1)。实验饲料现做现用。
实验用酪酸菌菌粉由广东海大集团股份有限公司研究院提供,酪酸菌的有效活菌数为1×1010cfu/g。

表1 实验饲料组成
1.2 实验用鱼及养殖管理
实验用的宝石鲈由上海观星农业科技有限公司提供,并在该公司河源养殖基地的集装箱循环水养殖系统中进行养殖实验。选取4 800 尾初始体质量为(24.02±2.04)g的宝石鲈,随机均分到4个集装箱中,每个集装箱1 200尾鱼,每个集装箱水体体积均为30 m3。养殖实验设置一个对照组和3个实验组,分别命名为Control、Diet 1、Diet 2、Diet 3组,对应的酪酸菌添加比例为0、0.1%、0.5%、1.0%。养殖实验持续60 d。
在实验期间,每15 d 随机捞取30 尾鱼测量一次体质量、体长,测量前均停食24 h。每天分别于8:00和16:00 各投喂一次,日投喂量为鱼体质量的4%。实验期间,该循环水养殖系统采用自然光源,自来水水源,保持溶解氧≥6.0 mg/l,pH 值7.0~7.5,氨氮≤8.0 mg/l[9]。
1.3 生长指标的测定及分析
根据下列公式分别计算特定生长率、相对增重率、肥满度。
特定生长率(SGR,%/d)=(Ln Wt-Ln W0)/t×100
相对增重率(RW,%)=(Wt-W0)/W0×100
肥满度(K,g/cm3)=Wt/Lt3×100
式中:W0——实验开始前的初始体重(g);
Wt——实验结束时的终末体重(g);
Lt——实验结束时的终末体长(cm);
t——养殖实验的持续时间(d)。
1.4 肠道菌群的采集及分析
1.4.1 实验鱼肠道样品的采集
本实验于第30 d 和第60 d 进行肠道样品的采集。采集开始前,停食24 h,确保宝石鲈肠道菌群的稳定。每个处理组采样10尾鱼。先用75%的酒精棉球擦洗鱼体体表,用消毒后的剪刀打开腹腔,剔除肠道附近的脂肪组织,用无菌水擦洗肠壁,剪下肠道并置于无菌离心管中。将样品编号并登记,置于便携式液氮罐中保存,运回实验室后,保存于-80℃冰箱直至处理。
1.4.2 肠道样品的处理及送检
每个处理组随机取5个肠道样品混合,去除样品的个体差异性,混合后新样品置于新的无菌离心管中,每个处理组混合后样品数为2,重新编号并登记(第60 d 采集的Control 组由于保存不当只有1 个样品)。将处理后样品送至深圳华大基因进行16S rD⁃NA测序。
1.4.3 生物信息学分析
将测序得到的数据经过数据过滤,滤除低质量的reads,剩余高质量的Clean data方可用于后期分析[10]。通过软件FLASH(v1.2.11),利用部分重叠关系将成对的reads 拼接成Tags[11]。利用软件USEARCH(v7.0.1090)将拼接好的Tags 聚类为可操作的分类单元OUT(Operational Taxonomic Unit),聚类相似度为97%[12];利用UCHIME(v4.2.40)将PCR 扩增产生的嵌合体从OTU代表序列中去除[13];使用usearch_global方法将所有Tags 比对回OTU 代表序列,得到每个样品在每个OTU的丰度统计表[14]。得到OUT代表序列后,通 过RDP classifer(v2.2)软 件 将OTU 代 表 序 列 与Greengene 数据库有比对进行物种注释,置信度阈值设置为0.8。
根据每个样品OTU 的丰度文件,通过R(v3.1.1)语言中的VennDiagram包做出Venn图;根据各样品差异性的统计结果,对样品进行聚类分析并计算样品间距离,以判断各样品物种组成的相似性。聚类分析通过QIIME(v1.80)软件进行,以R(v3.1.1)画图,聚类方法 为UPGMA(Unweighted Pair Group Method with Arithmetic mean)[15];根据每个OTU在每个样品的相对丰度信息进行OTU 的PCA 分析,通过R(v3.1.1)语言中ade4 包进行统计作图;通过与数据库比对,对OTU进行物种分类并分别在纲和属两个分类等级对各个样品作物种分析,将物种丰度低于0.5%的物种全部合并成Others。
1.5 数据统计
本实验所有统计分析均采用软件SPSS 22.0 进行,结果采用“平均值±标准误”表示,显著水平为P<0.05,极显著水平为P<0.01。
2 结果
2.1 酪酸菌对宝石鲈生长性能的影响(见表2)
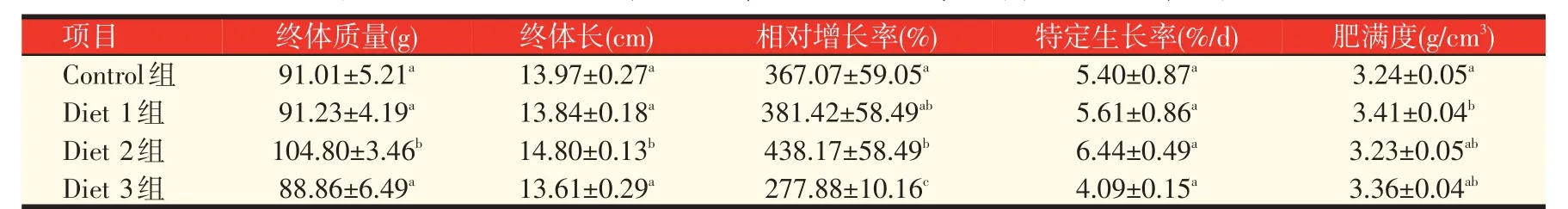
表2 不同浓度酪酸菌对宝石鲈生长性能的影响(平均值±标准误)
如表2 所示,Diet 2 组的终体质量和终体长均显著高于其它组(P<0.05)。Diet 2组的相对增长率高于其他组,且与Control 组、Diet 3 组均有显著差异(P<0.05)。四个实验组的特定生长率均没有显著差异(P>0.05),但Diet 2 组的特定生长率最高。Diet 1 组的肥满度高于其他实验组,与Control 组有显著差异(P<0.05),与Diet 2组、Diet 3组没有显著差异(P>0.05)。
2.2 酪酸菌对宝石鲈肠道菌群的影响
2.2.1 宝石鲈肠道菌群Alpha多样性分析
分别对不同肠道样品的Alpha 多样性指数进行了计算(表3)。通过对比各样品Alpha多样性指数可知,相对于第30 d,在第60 d时除了Diet 1组,其他各组的Sobs指数和Chao 1指数均有所下降;Control组和Diet 2 组的Shannon 指数、Diet 1 组的Simpson 指数和Diet 3 组的Ace 指数均有所下降。并且在第60 d 时,Diet 1 组的Sobs 指数、Chao 1 指数、Ace 指数最大,Di⁃et3 组的Shannon 指数最大、Simpson 指数最小。由于Sobs 指数、Chao1 指数、Ace 指数、Shannon 指数越大,Simpson指数越小,说明样品中的物种Alpha多样性越高。因此在第60 d 时,Diet1 组和Diet3 组的Alpha 多样性相对较高。
2.2.2 宝石鲈肠道菌群Beta多样性分析
根据各样品OTU 差异性的统计结果,对样品进行聚类分析,以判断各样品物种组成的相似性(见图1)。图中相同颜色的样品表示属于同一采集时间,样品越靠近,枝长越短,说明两个样品的物种组成越相似。如图1 所示,第30 d 采集的样品聚为一支,再与B1H22聚为一大支,且这些样品之间物种组成较为相似。剩余的第60 d采集的样品聚为另一大支,且各样品之间物种组成差异较大。

表3 不同肠道样品的Alpha多样性指数
为了进一步揭示各样品物种的分布情况,进行了基于各样品OTU数据的PCA主成分分析(见图2)。宝石鲈肠道菌群OTU 水平的PCA 三维排序图的第一轴(PC1)、第二轴(PC2)、第三轴(PC3)分别能解释50%、25%和13%的物种变化信息。图中各样品间空间距离越近,说明其物种组成越相似。如图2所示,第30 d所采集的样品之间空间距离都十分相近,说明此时宝石鲈肠道菌群组成十分相似。而在第60 d时,各样品分布较为离散,除了B1H22与第30 d所采集的样品菌群组成较为相似,其他样品均远离第30 d所采集的样品。

图1 宝石鲈肠道菌群OTU聚类分析图

图2 宝石鲈肠道菌群OTU水平的PCA三维排序图
2.3 宝石鲈肠道菌群群落组成分析
2.3.1 纲水平上的群落组成分析
在纲的分类水平上,15个宝石鲈肠道样品共检测到17 个细菌纲。如图3 所示,将相对丰度大于1%的纲定义为优势纲。宝石鲈肠道菌群共含有3 个优势纲,分别为芽孢杆菌纲(Bacilli)、Fusobacteriia 和梭菌纲(Clostridia)。在第30 d时,Control组最优势纲为芽孢杆菌纲,平均相对丰度达到96.91%。Diet组最优势纲为芽孢杆菌纲,平均相对丰度为96.14%;其次为Fusobacteriia,平均相对丰度为1.22%。而到第60 d时,Control组最优势纲为Fusobacteriia,平均相对丰度达到76.39%;其次为芽孢杆菌纲,平均相对丰度为13.37%;梭菌纲平均相对丰度为8.74%。Diet 组最优势纲为芽孢杆菌纲,平均相对丰度为52.48%;其次为Fusobacteriia,平均相对丰度为37.30%;梭菌纲,平均相对丰度为7.22%。
2.3.2 属水平上的群落组成分析
在属的分类水平上,15个宝石鲈肠道样品共检测到41 个细菌属。如图4 所示,将相对丰度大于1%的属定义为优势属。宝石鲈肠道菌群共含有5 个优势属,分别为芽孢杆菌属(Bacillus)、鲸杆菌属(Cetobac⁃terium)、微小杆菌属(Exiguobacterium)、乳酸球菌属(Lactococcus)和大洋芽孢杆菌属(Oceanobacillus)。在第30 d 时,Control 组最优势属为芽孢杆菌属,平均相对丰度达到55.19%;其次为大洋芽孢杆菌属,平均相对丰度为26.90%;乳酸球菌属,平均相对丰度为9.87%;微小杆菌属,平均相对丰度为1.36%。Diet 组最优势属为芽孢杆菌属,平均相对丰度为55.88%;其次为大洋芽孢杆菌属,平均相对丰度为26.49%;乳酸球菌属,平均相对丰度为9.14%;微小杆菌属,平均相对丰度为1.24%;鲸杆菌属,平均相对丰度为1.17%。而在第60 d 时,Control 组最优势属为鲸杆菌属,平均相对丰度达到76.38%;其次为芽孢杆菌属,平均相对丰度为8.20%;大洋芽孢杆菌属,平均相对丰度为3.55%;乳酸球菌属,平均相对丰度为1.03%。Diet 组最优势属为鲸杆菌属,平均相对丰度为37.28%;其次为芽孢杆菌属,平均相对丰度为31.85%;大洋芽孢杆菌属,平均相对丰度为13.24%;乳酸球菌属,平均相对丰度为4.81%。
3 讨论
3.1 酪酸菌对宝石鲈生长的影响
在喂养不同浓度的酪酸菌一段时间后,0~0.5%的酪酸菌添加范围内,宝石鲈的相对增长率、特定生长率随着酪酸菌的浓度增加而增加,其中以0.5%的添加组显著高于对照组。在1%的高浓度的添加比例中,宝石鲈的体重、相对增长率、特定生长率比0~0.5%的实验组相对减少。所以,适当浓度的酪酸菌(0~0.5%)会促进宝石鲈的生长,提高其饲料的转化率。但酪酸菌的添加比例过高了,通过与对照组对比,发现宝石鲈的生长发育受到了抑制,其饲料转化率降低。
在王腾浩[16]的研究中,酪酸菌可能通过分泌消化酶来辅助消化,从而提高饲料的转化率。结合王爱民[17]、刘迎春[18]的研究可知:适当浓度的外源酶可以促进动物生长发育,提高其内源酶对营养物质的分解作用,提高生长性能。而过高浓度的外源酶则反之。

图3 宝石鲈肠道菌群纲分类水平相对丰度图

图4 澳洲宝石鲈肠道菌群属分类水平相对丰度图
3.2 酪酸菌对宝石鲈肠道菌群多样性的影响
在喂养不同浓度的酪酸菌一段时间后,通过高通量测序技术,对第30、60 d 的肠道样品进行菌群多样性分析,可以知道:随着养殖时间的增加,宝石鲈肠道菌群物种组成更加复杂更加多样化。
3.3 酪酸菌对宝石鲈肠道菌群群落组成的影响
通过16S rDNA 测序技术与数据库对比,发现在喂养不同浓度的酪酸菌一段时间后,Diet组的芽孢杆菌纲、Fusobacteriia 和梭菌纲的相对丰度远大于其他纲。
在属的分类水平上,发现了随着宝石鲈生长的阶段的不同,其优势菌群发生变化。随着养殖时间的推移,其芽孢杆菌属和大洋芽孢杆菌属成为优势菌群。这与张振男等[19]研究结果相吻合,鱼类的优势菌群可能随着生长阶段的不同发生变化。
在属的分类水平上,在0~0.5%的酪酸菌添加比例中,益生菌群(鲸杆菌属、芽孢杆菌属、海洋芽孢杆菌属和乳球菌属等)相对丰度随着外源酪酸菌浓度增加而增加,条件致病菌如邻单胞菌属、拟杆菌属、类芽孢杆菌属、气球菌属、肠球菌属等,其相对丰度随着外源酪酸菌增加而减少。在1%的酪酸菌添加的实验组中,其益生菌群对比0.5%的实验组反而减少,其致病菌也增加。说明了适当浓度的外源酪酸菌可以改变宝石鲈肠道菌群的结构,提高其益生菌的比例,减少致病菌,提高鱼体的免疫力。樊爱丽等[20]通过酪酸菌治疗感染大肠杆菌的鸡群,发现了酪酸菌可以通过提高乳酸菌和酪酸菌数量来提高机体的免疫力,从而减轻大肠杆菌对肝脏的损伤。有学者研究发现[21],鲸杆菌属可以通过产生维生素B12来提高鱼类的营养吸收能力。海洋芽孢杆菌属[22]可以通过分泌多种生物活性物质,具有高效的作用。酪酸菌[23]可以产生丁酸梭菌素,维持肠道益生菌群的平衡,抑制致病菌,从而提高机体的抗病性。益生菌群[24]可以通过分泌维生素B12、泛酸等物质,提供肠道对营养物质的吸收。
4 结论
饲料中添加酪酸菌能有效的改善宝石鲈肠道菌群,提高益生菌群的比例,降低了致病菌的含量,其中0.5%的酪酸菌添加量显著提高了宝石鲈的生长性能。

