在“三明治”培养大鼠原代肝细胞中研究利福平及联用丹参酮ⅡA对普伐他汀经BSEP转运的影响
刘 蕾,杨玉洁,王 凌,蒋学华
(四川大学华西药学院,四川 成都 610041)
胆汁酸外排泵(bile salte export pump,BSEP)是重要的胆汁酸外排转运体,主要介导一价胆酸盐的转运。BSEP介导的胆汁酸外排在胆汁酸循环中是重要的限速步骤。有研究表明,编码BSEP的基因ABCB11发生突变,可导致进行性家族性肝内胆汁淤积,抑制BSEP的转运能力也可导致胆汁淤积[1]。利福平(rifampin,RFP)是治疗结核病的一线药物。在临床使用中,RFP给药剂量大,服药周期长,常引发肝损伤等不良反应,其中,以胆汁淤积型肝损伤最为常见[2]。目前,RFP致淤胆的机制尚不清楚,是否可能通过抑制胆汁酸转运体BSEP的转运能力导致胆汁淤积,需要进一步研究。丹参酮 ⅡA(tanshinone ⅡA,TAN ⅡA)是中药丹参的脂溶性活性成分,具有抗氧化、抗纤维化、保肝等作用。TAN ⅡA能改善肿瘤坏死因子和过氧化氢所致的肝细胞损伤[3],也能激活NF-E2相关因子2(NF-E2-related factor 2, Nrf2)信号通路,预防对乙酰氨基酚引起的肝损伤[4]。有研究表明,BSEP的启动子区域存在Nrf2的结合位点[5]。本课题组前期研究发现,TAN ⅡA能够激活Nrf2,诱导下游BSEP的表达。但目前尚未有研究报道TAN ⅡA对BSEP转运能力的影响,所以我们猜想,TAN ⅡA是否能增加转运体BSEP的转运能力,对抗RFP所致的胆汁淤积型肝损伤。
“三明治”培养大鼠原代肝细胞模型(sandwich-cultured rat hepatocytes,SCRH)是指将大鼠原代肝细胞铺于鼠尾胶与基质胶之间,形成夹层培养。原代肝细胞在该模型下培养3~5 d,肝细胞间能够形成胆管样结构,且转运体和代谢酶的表达维持较高水平,可以较好地模拟体内环境,是体外研究肝脏转运体功能的主要模型[6]。本文旨在SCRH中考察RFP及联用TAN ⅡA对BSEP转运能力的影响,进一步阐明RFP导致胆汁淤积的机制,同时也为寻找有效减轻RFP胆汁淤积的药物提供理论依据。
1 材料与方法
1.1 实验动物健康SD大鼠,♂,体质量(250±20)g,由成都达硕实验动物有限责任公司提供,生产许可证号:SCXK(川)2015-030。采用标准饲料喂养,自由饮水及进食,适应性饲养1周。饲养环境采用昼夜对半的循环模式,控制相对湿度(75±15)%,温度(25±5)℃。所有动物实验均按照四川大学关于实验动物的饲养和实验准则进行,并且通过了四川大学华西药学院动物保护委员会批准。
1.2 药物与试剂RFP(纯度99%,批号:S01023 YA14)、TAN ⅡA(纯度98%,批号:Y20J8C49264),均购自上海源叶生物科技有限公司;格列本脲(纯度99%,批号:A0225A,大连美仑生物技术有限公司);普伐他汀(纯度98%,批号:C1721027,阿拉丁);卡马西平(纯度99.7%,批号:100142-201004,中国药品生物制品检定所);BCA蛋白浓度测定试剂盒、BSA牛血清白蛋白,均购自万类生物科技有限公司;EGTA购自Sigma公司;含Ca2+/Mg2+Hanks缓冲液、不含Ca2+/Mg2+Hanks缓冲液,购自Solarbio公司;Ⅱ型胶原酶,购自Gibco公司;Matrigel胶、鼠尾胶,均购自Corning公司;甲醇、乙腈均为色谱级,购自Spectrum公司;色谱级甲酸,购自DIKMA公司。
1.3 仪器API 3000三重四极杆质谱(美国AB Sciex公司)联用高效液相色谱仪(日本SHIMADZU);Minipuls 3蠕动泵法国(GILSON);涡旋振荡器、酶标仪(美国Thermo Scientific公司);H-1600A台式高速离心机 (上海利鑫坚离心机有限公司);倒置相差生物显微镜(上海巴拓仪器有限公司);二氧化碳细胞培养箱日本(Sanyo公司)。
1.4 SCRH模型的建立采用半原位胶原酶灌流法分离大鼠原代肝细胞。禁食24 h的SD大鼠腹腔注射500 IU·kg-1肝素钠抗凝,并用4 mg·kg-1水合氯醛麻醉。75%酒精消毒大鼠腹部,在无菌条件下打开腹腔,游离门静脉与下腔静脉,门静脉插管。用EGTA灌流液匀速灌注,流速为20 mL·min-1,待肝脏肿胀时剪开下腔静脉,继续灌注10 min肝脏变成土黄色后停止灌流;完整摘除肝脏,用无菌PBS清洗3次,在无菌条件下钝性撕破肝包膜,撕碎肝脏并转移到无菌离心管中,加入20 mL Ⅱ型胶原酶,37 ℃水浴中震荡7 min;100目筛网过滤肝细胞悬液,加入含5% FBS的DMEM培养基20 mL,50×g、4 ℃离心3 min,重复2次,用10 mL相同培养基重悬沉淀,加入5 mL密度为1.08 kg·L-1的Percoll,混匀后,200×g、4 ℃离心5 min,所得沉淀以含5% FBS的DMEM培养基重悬,将细胞活率在90%以上的细胞按5×108·L-1的密度接种于铺有鼠尾胶的细胞培养板上,4 h后更换新的含5% FBS的DMEM培养基,以去除未贴壁细胞。培养24 h后,更换含Matrigel胶(0.25 g·L-1)的无血清DMEM培养基,以形成“三明治”夹层状态,随后每24 h更换新的无血清DMEM培养基,直至d 4长出胆管。
1.5 MTT实验将新鲜分离的大鼠原代肝细胞按2.5×104个/孔接种于铺有鼠尾胶的96孔板中,按“三明治”模型的培养条件培养至d 4,分别以RFP(0、0.5、1、2、5、10、25、50、80、100 μmol·L-1),TAN ⅡA(0、0.5、1、2、5、10、25、50、80、100 μmol·L-1)联用50 μmol·L-1RFP,以及格列本脲(0、1、2、4、10、20、50、100、160、200 μmol·L-1)处理细胞12、24、48 h;以浓度为0、0.2、0.5、1、2、5 μmol·L-1普伐他汀处理细胞6、12、24 h。于相应的时间点弃去含药培养基,改用5 g·L-1MTT孵育细胞4 h,吸弃MTT,加入150 μL DMSO震荡10 min以充分溶解结晶物甲臜。在492 nm波长下测定各孔的吸光度值。细胞抑制率计算公式为:细胞抑制率/%=(Acontrol-Atest)/Acontrol×100%
1.6 液相色谱-质谱条件色谱柱:phenomenex Luna 3u C18(2)(50 mm×2.00 mm 3 μm);流动相:A相为0.1%甲酸的水溶液;B相为乙腈,梯度洗脱(0~0.5 min 10% B;0.51~1.5 min 10%~90% B;1.5~3 min 90% B;3.01~4.5 min 90%~10% B;4.51~5 min 10% B);流速为0.4 mL·min-1;柱温为40 ℃,进样量10 μL。离子源为ESI,采用多反应监测模式(MRM),正离子扫描,离子喷射电压(IS)为5.0 kV;气帘气(CUR)为82.74 kPa;碰撞气(CAD)为68.95 kPa;雾化气(NEB)为55.16 kPa。普伐他汀和内标卡马西平的离子对分别为m/z 447.1→327.4、m/z 237.1→194.1,去簇电压(DP)分别为79 V、20 V,碰撞能量分别为30 V、12 V。
1.7 溶液配制用90%的甲醇溶液配制浓度为240.0 mg·L-1的普伐他汀储备液和浓度为3.000 g·L-1的卡马西平储备液。将普伐他汀储备液用50%的甲醇溶液继续稀释为0.600、1.200、3.000、6.000、12.00、24.00、30.00 mg·L-1的系列普伐他汀工作溶液。将卡马西平储备液用50%的甲醇溶液稀释为4.500 mg·L-1的内标溶液。
1.8 原代肝细胞样品的处理方法取原代肝细胞裂解液90 μL,向其中加入50%甲醇溶液10 μL以及内标工作溶液10 μL,涡旋1 min;加入300 μL乙腈沉淀蛋白,涡旋振荡3 min,12 000 r·min-1离心5 min,吸取上清液80 μL入进样瓶中,依次放置于自动进样器样品盘中,进样10 μL分析。记录普伐他汀面积(Aanalyte)与内标峰面积(AIS),代入标准曲线中,计算样品中浓度。
1.9 细胞转运实验普伐他汀是BSEP的已知底物[7],本文用普伐他汀在胆管中的浓度评价RFP及联用TAN ⅡA对BSEP转运能力的影响。SCRH形成胆管结构后,用含Ca2+/Mg2+的Hanks孵育细胞,细胞间的胆管结构保持完整,进入细胞的普伐他汀可被转运到胆管中;用不含Ca2+/Mg2+的Hanks孵育细胞,细胞间胆管结构被破坏,细胞内的普伐他汀被转运到培养液里,由此差值可得排入胆管中普伐他汀的浓度[8]。SCRH培养至d 4,分别以格列本脲(100 μmol·L-1)、RFP(10、25、50 μmol·L-1)、TAN ⅡA(5、10、20 μmol·L-1)联用50 μmol·L-1RFP处理细胞12、24、48 h。其中,格列本脲是BSEP的已知抑制剂,作为阳性对照药。随后用37 ℃预热的含Ca2+/Mg2+或不含Ca2+/Mg2+的Hanks孵育细胞15 min后吸弃,加入含1 μmol·L-1普伐他汀的Hanks孵育20 min,用冰冷的Hanks快速清洗细胞3次终止转运,用反复冻融法裂解细胞并进行BCA蛋白定量。细胞裂解液样品按“1.8”项下操作,计算样品中普伐他汀的浓度及胆管外排指数(bile efflux index,BEI):BEI=(Acell+bile-Acell)/Acell+bile×100%,其中,Acell+bile为在含Ca2+/Mg2+时细胞和胆管结构内普伐他汀的蓄积量;Acell为在不含Ca2+/Mg2+时细胞内普伐他汀的蓄积量。
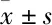
2 结果
2.1 药物对细胞活性的影响Fig 1的MTT结果显示,RFP、TAN ⅡA联用RFP(50 μmol·L-1)、格列本脲、普伐他汀浓度分别在0~50 μmol·L-1、0~25 μmol·L-1、0~100 μmol·L-1、0~2 μmol·L-1范围内,对细胞的生长抑制率低于20%,几乎不抑制细胞生长。最终选定RFP的给药浓度为10、25、50 μmol·L-1,TAN ⅡA的给药浓度为5、10、20 μmol·L-1,格列本脲的给药浓度为100 μmol·L-1,普伐他汀的给药浓度为1 μmol·L-1。
2.2 普伐他汀UPLC-MS/MS的方法学考察在选定的液相-质谱条件下,分别测定空白细胞裂解液、空白细胞裂解液+普伐他汀、空白细胞裂解液+卡马西平、空白细胞裂解液+普伐他汀+卡马西平。Fig 2结果表明,细胞裂解液中的其他杂质不干扰普伐他汀和内标卡马西平的分离测定,普伐他汀和卡马西平的保留时间分别为1.78 min、1.85 min。
Fig 1 Growth inhibitions on rat primary hepatocytes by RFP(A), TAN ⅡA(B), glibenclamide(C),

Fig 2 Representative chromatograms of pravastatin and internal standard(carbamazepine) in cell lysates
A: Blank rat primary hepatocytes lysis solution; B: Blank rat primary hepatocytes lysis solution with pravastatin; C: Blank rat primary hepatocytes lysis solution with carbamazepine; D: Blank rat primary hepatocytes lysis solution with pravastatin and carbamazepine.

Fig 3 The standard curve diagram of pravastatin in cells
按“1.8”项下操作,将普伐他汀系列工作溶液加入空白细胞裂解液中,制备成浓度为60.0、120.0、300.0、600.0、1 200、2 400、3 000 μg·L-1的标准曲线溶液,以待测物和内标峰面积的比值(Y)为纵坐标,以普伐他汀的浓度为横坐标,进行加权回归,权重为1/C2,得到回归方程和相关系数:Y=0.00148X+0.0173(r2=0.9954),表明在60.00~3 000 μg·L-1浓度范围内普伐他汀线性良好,定量下限为60.00 μg·L-1。标准曲线代表图见Fig 3。
按“1.8”项下操作,用空白细胞裂解液将普伐他汀工作溶液稀释为60.00、120.0、600.0、2 250 μg·L-1的极低、低、中、高4个浓度的质控样品,每个浓度制备6份。其中,用极低、低、中、高浓度的质控样品考察精密度与准确度。由Tab 1结果可知,普伐他汀极低、低、中、高浓度质控样品的准确度分别为(104.67±4.27)%、(106.80±6.45)%、(107.53±8.56)%、(90.80±4.49)%,表明方法准确度良好,日内精密度在2.41%~11.74%之内,日间精密度在4.17%~11.93%之内,表明方法精密度良好。用低、中、高浓度的质控样品考察提取回收率,Tab 1结果表明,低、中、高3个浓度样品的提取回收率分别为106.06%、88.39%、108.09%。用低、高两种不同浓度的质控样品考察基质效应与稳定性,结果如Tab 2所示,低、高浓度普伐他汀的相对基质效分别是3.8%、4.4%。稳定性结果如Tab 3所示,与0 h相比,室温放置4 h、自动进样器(4 ℃)放置8 h、-70 ℃放置10 d以及反复冻融3次后,样品测得值的偏差均小于15%。因此,普伐他汀在以上条件下稳定性良好。
Tab 1 Accuracy, precision and extraction recovery of pravastatin in cell
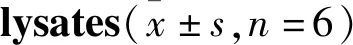
Tab 2 Matrix effect of pravastatin in cell
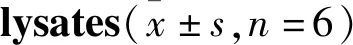
Tab 3 Stability of pravastatin in cell
2.3 普伐他汀在SCRH的胆管外排格列本脲、RFP、TAN ⅡA孵育细胞12、24、48 h后,普伐他汀在胆管中的浓度变化结果如Fig 4所示。与空白对照组比,格列本脲明显降低胆管内普伐他汀的浓度(P<0.01),RFP也能降低胆管内普伐他汀的浓度,其中RFP高浓度组处理细胞12、24、48 h后,胆管内的普伐他汀浓度分别降低至对照组的22.2%、24.2%、19.6%,差异具有显著性(P<0.01);与高浓度RFP组比,当RFP与不同浓度的TAN ⅡA联用后,胆管内普伐他汀的浓度呈增加趋势,其中RFP与TAN ⅡA高剂量组联合用药处理细胞12、24、48 h后,胆管内普伐他汀浓度分别增加至RFP高剂量组的3.81倍、2.51倍、3.50倍,差异具有显著性(P<0.05)。
此外,BEI也是评价药物胆管外排的重要指标,格列本脲、RFP、TAN ⅡA对普伐他汀BEI的影响结果见Fig 5。结果显示,与空白对照组相比,格列本脲能明显降低普伐他汀的BEI(P<0.05),RFP也能降低普伐他汀的BEI,其中高浓度RFP处理细胞12、24、48 h均能明显降低普伐他汀的BEI,分别是对照组的42.6%、45.2%、38.4%,差异具有显著性(P<0.01);与高浓度RFP组相比,RFP与TAN ⅡA联用后,普伐他汀的BEI呈上调趋势,其中高浓度TAN ⅡA上调趋势最明显,处理细胞12、24、48 h后,普伐他汀的BEI分别增加至高浓度RFP组的1.51倍、1.91倍、2.74倍,差异具有显著性(P<0.01)。由此说明,RFP能够抑制BSEP的转运能力,TAN ⅡA与RFP联用后能够逆转RFP对BSEP转运能力的抑制作用。提示RFP致淤胆的机制可能与抑制BSEP的转运能力有关,TAN ⅡA能够上调BSEP的转运能力,具有治疗RFP所致胆汁淤积的潜力。
3 讨论
原代肝细胞最经典的提取方法是Seglen两步灌流法[9],但该法胶原酶用量大、灌流时间长,本文选用半原位胶原酶灌流法提取大鼠原代肝细胞,并对该方法进行了改良。分别对胶原酶的类别、浓度、温度、消化时间等条件进行考察,发现影响原代细胞得率和活率的关键因素包括:① 胶原酶的类别:本研究分别尝试用Ⅰ型胶原酶、Ⅱ型胶原酶、Ⅳ型胶原酶提取原代肝细胞,发现在相同操作下,Ⅱ型胶原酶处理后的细胞得率高于Ⅰ型胶原酶和Ⅳ型胶原酶;② 灌流速度:灌流速度快会对肝脏造成机械性损伤,降低细胞活率;灌流速度慢,肝脏易淤血,导致灌流不充分;反复摸索后发现,20 mL·min-1的灌流速度能快速清除肝脏淤血并能保证细胞活率;③ 消化时间:胶原酶消化时间过短,细胞得率低;消化时间长,细胞因缺氧而死亡,影响细胞活率。因此,本文最终采用42 ℃、0.05% Ⅱ型胶原酶离体消化肝脏10 min。相比于传统方法,该实验条件既保证了细胞得率和活率,又大大降低了实验成本。

Fig 4 Effects of rifampin and tanshinone ⅡA on accumulation of pravastatin in bile
1:Control;2:Glibenclamide;3:RFP 10;4:RFP 25;5:RFP 50;6:RFP 50+TAN 5;7:RFP 50+TAN 10;8:RFP 50+TAN 20.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsRFP 50 group
用HPLC-MS/MS测定普伐他汀血样浓度时,常用的样品前处理方法有液-液萃取法[10]、固-液萃取法[11]。这些方法操作繁琐、实验成本高。相比于血液样品,细胞样品成分较单一,本文采用乙腈沉淀蛋白法处理样品,发现普伐他汀响应好、回收率高,满足生物样品的分析要求。此外,流动相也是影响药物定量分析的重要因素,通过考察乙腈-水(补充0.1%甲酸)、甲醇-水(补充0.1%甲酸)对普伐他汀测定的影响,发现有机相为乙腈时药物峰形平滑,响应好;有机相为甲醇时药物峰出现裂峰,响应低,且有拖尾现象。故最终确定用乙腈沉淀蛋白法处理样品,流动相用乙腈-水(补充0.1%甲酸)。

Fig 5 Effects of rifampin and tanshinone ⅡA on BEI of
1:Control;2:Glibenclamide;3:RFP 10;4:RFP 25;5:RFP 50;6:RFP 50+TAN 5;7:RFP 50+TAN 10;8:RFP 50+TAN 20.*P<0.05,**P<0.01vscontrol group;##P<0.01vsRFP 50 group
药源性肝损伤是药物撤市的原因之一,国际医学组织理事会将药物性肝损伤分为3类:肝细胞损伤型、胆汁淤积型和混合型[12]。利福平造成的肝损伤是胆汁淤积型肝损伤。胆汁淤积是多种原因导致的胆汁生成、分泌及转运障碍,而钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide, NTCP)、有机阴离子转运多肽( organic anion transporting polypeptide,OATP)、多药耐药相关蛋白2(multidrug-associated protein 2,MRP2)、BSEP等转运体在胆汁酸的转运中发挥了重要作用。研究发现,RFP能抑制Oatp2的摄取[13];也能抑制Mrp2的功能,从而减少胆红素和胆汁酸的转运[14]。本研究发现,RFP能够抑制BSEP的转运能力,这可能是RFP导致胆汁淤积的原因之一。此外,中药疗效稳定、副作用较小,常与西药联合用药降低西药的毒副作用。目前常用的保肝药物较多,如姜黄、三七、冬虫夏草等。丹参也是重要的保肝药物,其主要有效成分是TAN ⅡA,临床上将TAN ⅡA磺酸钠和还原性谷胱甘肽联合使用治疗胆汁淤积型药物性肝炎,TAN ⅡA磺酸钠通过诱导CYP450的活性,加速肝毒性物质代谢,减少肝损伤。本研究发现,TAN ⅡA能够逆转RFP对BSEP转运能力的抑制作用,表明TAN ⅡA可能通过增强BSEP的功能,加速胆汁排泄,从而减缓胆汁淤积。
综上所述,本文主要研究了RFP和TAN ⅡA对BSEP转运能力的影响,结果表明,RFP能够抑制BSEP的转运能力,TAN ⅡA与RFP联用后,BSEP的转运能力上调。本研究进一步阐明了RFP诱导胆汁淤积的分子机制,为临床治疗RFP诱导的胆汁淤积提供了新的靶点,同时为TAN ⅡA用于预防RFP所致的胆汁淤积提供了依据。