趋化因子CCL2对大鼠学习记忆的影响及其机制
陈健民,谭丽秋,蒋俊俊,梁冰玉,周 燕,
(广西医科大学1. 药学院、2. 广西艾滋病防治研究重点实验室,广西 南宁 530021)
趋化因子是细胞因子家族中的重要组成成员之一,根据其N末端半胱氨酸残基的数量和排列不同,可进一步将趋化因子分为4类,即C类、CC类、CXC类以及CX3C类。最初认为趋化因子是免疫调节的重要参与者之一,具有募集、趋化免疫细胞到达炎症部分并发挥免疫应答的作用。近年来的研究发现,趋化因子在中枢神经系统(central nervous system, CNS)中扮演着重要且多重的角色,其中,CC类趋化因子配体2(chemokine CC motif ligand 2, CCL2)作为趋化作用最强的因子之一,近年来备受关注。在CNS中,CCL2具有维持神经元正常活性,并参与神经元通讯交流等生理功能。然而,过表达的CCL2参与了如中风、癫痫、神经退行性疾病[1-3]等CNS疾病发生的病理生理过程。在脑部,CCL2主要由星形胶质细胞和小胶质细胞产生,此外,血管内皮细胞以及来源于外周并迁移至CNS的巨噬细胞等,也可产生CCL2[4]。这些细胞释放的CCL2能通过诱导炎症反应、兴奋毒性、氧化应激等途径损伤神经元,并可能导致患者出现学习记忆力减退及认知功能低下的临床表现。研究人员在阿尔茨海默症(Alzheimer′s disease, AD)、艾滋性认知功能障碍(HIV-associated neurocognitive disorder, HAND)等患者的脑脊液中检测到了高水平的CCL2,而这些患者均伴随有不同程度的认知功能障碍[5-6],提示CCL2可能与认知功能损害有关。但由于相关的实验数据和结论太少,导致对CCL2的致病机制还不是十分清楚。故本研究采用脑部立体定位技术,首次将CCL2注射至大鼠双侧海马脑区,制备一种动物模型来研究CCL2对大鼠学习记忆的影响及机制。我们利用Morris水迷宫(Morris water maze, MWM)检测CCL2对大鼠的学习记忆的影响,实时荧光定量PCR(RT-PCR)检测海马组织中参与细胞凋亡相关蛋白caspase-8、caspase-3 mRNA的表达水平,探讨其诱导海马神经元凋亡的机制;RT-PCR法检测各组大鼠海马组织内磷酸激活谷氨酰胺酶(phosphate-activated glutaminase, PAG))mRNA的表达,ELISA法检测各组大鼠海马组织内肿瘤坏死因子ɑ(tumor necrosis factorɑ, TNF-ɑ)、乙酰胆碱酯酶(cholinesterase, AChE)的含量以及谷氨酰胺合成酶(glutamine synthetase, GS)的活力,来探究其诱发神经损伤的机制。该研究旨在探究CCL2对学习记忆的影响和机制,为后续的临床治疗提供研究基础和治疗见解。
1 材料与方法
1.1 实验动物及分组40只SPF级♂SD大鼠,体质量(215±15)g,购自于广西医科大学实验动物中心,实验动物生产许可证:SCXK桂2014-0002,实验动物使用许可证:SCXK桂2014-0003。适应性喂养1周,给予规律光照(9 ∶00~17 ∶00),允许自由摄食饮水。SD大鼠随机分为5组:空白对照组(control)、假手术组(sham)、CCL2(0.5、5、50 ng)组,每组8只。将CCL2先配成100 mg·L-1的母液,用时用无菌生理盐水分别稀释成0.1、1、10 mg·L-1,除空白对照组外,其余各组均进行双侧海马内注射,每侧注射体积为2.5 μL,假手术组给予等量无菌生理盐水。
1.2 试剂与仪器CCL2(R&D systems,批号:279-MC/CF);caspase-8、caspase-3、PAG、GAPDH引物(上海捷瑞生物工程有限公司);AxyPrep总RNA制备试剂盒(康宁生命科学有限公司,批号:07418KD1);逆转录试剂盒(TaKaRa,批号:RR047A);SYBR荧光染料扩增试剂盒(TaKaRa,批号:RR820A);大鼠TNF-ɑ、GS、AChE酶联免疫分析试剂盒(北京安迪华泰生物科技有限公司);BCA蛋白浓度测定试剂盒(碧云天,批号:P0010S)。脑立体定位仪(深圳瑞沃德生命科技有限公司);10 μL Hamilton微量注射器(Hamilton公司,型号:701N);Morris水迷宫实验装置及分析系统(淮北正华生物仪器设备有限公司)。
1.3 模型制备配制1%的戊巴比妥钠,按45 mg·kg-1剂量腹腔注射麻醉。待动物麻醉后,颅顶区常规备皮,碘伏消毒。参照大鼠脑立体定位图谱,以前囟为原点,按AP=-3.7 mm、ML=±3.0 mm、DV=-3.0 mm的坐标位置进行海马区注射,注射速度为0.3 μL·min-1,注射完成后停针5 min避免药物外漏,随后缓慢提针。注射完成后缝合皮肤,并注射青霉素(30万单位·kg-1)防止感染。
1.4 Morris水迷宫实验术后的d 3开始进行Morris水迷宫实验。水池直径为160 cm,池壁分为NW、SW、SE、EN四个象限,每个象限水池壁的中心位置各放置1个不同形状的标志物,水温控制在(22±1)℃,在SW象限中心的水面下2 cm处放置1个平台。实验由3部分组成:① 适应阶段:在正式实验前1 d将大鼠放置水池中任意游60 s,目的是让其适应环境;② 定位航行实验:该阶段共进行5 d,每天进行4次,每次将大鼠从不同的象限放入水中,记录每次从入水点到找到水下平台的时间(即逃避潜伏期)、游泳速度及游泳路程。实验记录的总时长为90 s,若大鼠在90 s内未能找到平台,则手动引导其到达平台30 s,此次的逃避潜伏期记为90 s。③ 空间探索实验:该阶段在定位航行实验结束后的24 h进行,在本实验中撤去水下平台,将大鼠从任一象限放入水中,记录其在90 s内在原平台所在象限的路程百分比及原平台穿越次数。
1.5 qPCR检测caspase-8、caspase-3、PAG mRNA的表达Morris水迷宫实验结束后,于d 10分离各组大鼠海马组织,按柱式RNA提取试剂盒的说明提取总RNA,按逆转录试剂盒的说明将RNA逆转录成cDNA,按扩增试剂盒的说明对目的基因进行扩增,获得目的基因的扩增曲线和熔解曲线,记录各基因的Ct值,GAPDH为内参基因,引物序列见Tab 1。结果用2-ΔΔCt法进行计算。

Tab 1 Primer sequence of target genes
1.6 ELISA法检测海马组织内TNF-α、AChE的含量以及GS的活力将各组大鼠于冰上迅速断头取脑,分离海马组织,并制备10%的海马匀浆,BCA法检测各样本蛋白总浓度,TNF-α、AChE的含量检测以及GS的活力检测按照相关试剂盒的说明操作。
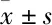
2 结果
2.1 各组大鼠游泳速度、逃避潜伏期和游泳路程的结果比较Tab 2结果显示,与假手术组相比,在各组大鼠游泳速度无明显差异的前提下,各CCL2处理组大鼠的逃避潜伏期及游泳路程均明显增长,且呈剂量依赖性,差异具有统计学意义(P<0.05)。d 5各组大鼠的游泳轨迹见Fig 1。
2.2 各组大鼠原平台穿越次数、原平台所在象限路程百分比结果Tab 3结果显示,与假手术组相比,各CCL2处理组大鼠原平台穿越次数及原平台所在象限的路程百分比均明显减少,并呈现剂量依赖性,差异具有统计学意义(P<0.05)。
2.3 海马组织内caspase-8、caspase-3、PAG mRNA的表达结果如Fig 2所示,与假手术组相比,各CCL2处理组大鼠海马组织内caspase-8 mRNA的相对表达有升高趋势,结果呈现剂量依赖性关系,50 ng CCL2组差异有统计学意义(P<0.01)。caspase-3 mRNA的相对表达量均有升高趋势,结果呈现剂量依赖性关系,但差异无统计学意义。PAG mRNA的相对表达呈现剂量依赖性关系增加,50 ng CCL2组差异有统计学意义(P<0.05)。

Fig 1 Typical swim-tracking path in probe trial on 5th training day
A:Control; B: Sham; C: 0.5 ng CCL2; D:5 ng CCL2; E: 50 ng CCL2.

Tab 2 Results of swimming speed, escape time and swimming distance of each
*P<0.05,**P<0.01vssham

Tab 3 Results of crossing times, percentage of distance spent in target quadrant of each
*P<0.05,**P<0.01vssham
2.4 海马组织内TNF-α、AChE的含量以及GS的活性检测如Fig 3所示,与假手术组相比,各CCL2处理组大鼠海马组织内TNF-α、AChE含量均升高,50 ng CCL2组结果有统计学意义(P<0.05);GS的活力均降低,5、50 ng CCL2组差异具有统计学意义(P<0.01)。
3 讨论
CCL2又被称为单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1),是CC趋化家族的重要成员,是目前已知的趋化作用最强的细胞因子之一,在颅脑创伤、多发性硬化症,脑缺血等多种中枢神经系统疾病中具有重要作用[7-9]。研究发现,CCL2主要与CC类趋化因子受体2(CCR2)结合,并募集单核细胞到达特定部位,介导炎症反应的发生。CCL2-CCR2轴在老年痴呆、艾滋性痴呆以及帕金森病患者表现出的抑郁症等疾病的病理生理过程中扮演了重要的角色,研究人员从这些患者的脑脊液中检测到了高表达的CCL2以及CCR2,而这些患者通常伴有不同程度的认知功能障碍,说明CCL2可能影响患者的学习记忆、认知能力以及情绪活动[5,10-11],但其具体的作用和机制仍不是十分明确。因此,本研究首次将不同剂量的CCL2注射至大鼠双侧海马脑区制备动物模型,来研究CCL2对学习记忆的影响及其机制。我们利用Morris水迷宫实验检测大鼠的学习记忆能力,探究CCL2对大鼠的学习记忆功能的影响。经典的Morris水迷宫实验由定位航行实验和空间探索实验两部分组成,前者着重检测啮齿动物的学习能力,后者主要用于检测动物记忆的维持能力。本研究结果表明,在各组大鼠游泳速度无明显差异的前提下,不同剂量的CCL2均能明显延长大鼠的逃避潜伏期,增加游泳路程,且结果呈剂量依赖性关系,表明CCL2能够损伤大鼠的学习能力。在空间探索实验中,不同剂量的CCL2均能明显减少平台的穿越次数以及原平台所在象限的路程百分比,表明各模型组大鼠的空间记忆受到不同程度的损害,且呈剂量依赖性关系。提示CCL2能剂量依赖性地损伤大鼠的学习记忆能力。此外,临床研究也发现,患者出现认知障碍的程度与脑脊液中CCL2表达水平呈正相关。
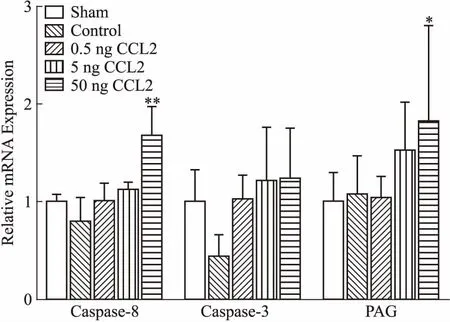
Fig 2 The relative expression of caspase-8, caspase-3 and PAG mRNA in rat
*P<0.05,**P<0.01vssham

Fig 3 Expression of TNF-α, AChE and activity of
*P<0.05,**P<0.01vssham
上述行为学实验已经表明,CCL2能损伤大鼠的学习记忆和认知功能,而胆碱能神经系统在学习记忆中发挥了重要的作用,在阿尔茨海默症患者中能观察到胆碱能神经元的丢失,而高表达的AChE能水解ACh,降低ACh的含量,从而降低患者的学习记忆能力。故我们进一步检测了大鼠海马组织内AChE的表达,探究CCL2是否能影响ACh的水平。结果表明,各模型组大鼠海马组织内AChE的活性升高,表明CCL2可通过升高AChE,减少ACh的含量,降低大鼠的学习记忆力。
中枢神经炎症和兴奋性毒性是CNS疾病发病过程涉及的两大机制。CCL2的促炎症反应已经是公认的事实,CCL2作为一种促炎性趋化因子,能诱导多种炎性细胞因子和趋化因子的表达,放大炎症反应并损伤组织细胞。在本研究中,我们检测了各组大鼠海马组织内TNF-α的表达,结果证明0.5~50 ng的CCL2能增加TNF-α的水平,且该效应呈剂量依赖关系,表明CCL2能诱导TNF-α的表达,促进炎症反应的发生。
CNS的兴奋性在突触传递中具有重要意义,谷氨酸是脑内重要的兴奋性氨基酸,通过激活突触后膜上的NMDA受体,增强长时程增强效应(long-term potentiation,LTP),而该效应被认为是学习记忆重要的分子机制之一。但是,突触间隙过多累积的谷氨酸能过度激活NMDA受体,导致细胞内Ca2+超载,并由此引发细胞凋亡,因此,神经系统过度兴奋会导致兴奋性毒性的发生。我们前期的研究发现[12-13],CCL2不仅仅是增强NMDA受体介导的兴奋性突触后电流(excitatory postsynaptic current,EPSC),介导Ca2+内流增加,并且还能导致神经元结构损伤,并引起神经元死亡,表明CCL2介导突触传递的增强过程与兴奋毒性有关。故我们进一步猜测CCL2与谷氨酸的生成有关。在神经元和神经胶质细胞中存在一个谷氨酸-谷氨酰胺循环,其中GS和PAG是该循环中具有重要调节作用的两种酶。GS能将摄入到胶质细胞中的谷氨酸变成谷氨酰胺,降低谷氨酸的水平,而PAG则能使谷氨酰胺脱氨基生成谷氨酸,从而提高谷氨酸的水平。故我们检测了上述两种酶的表达。实验结果表明,CCL2能降低GS的活力,同时上调PAG的表达,这两种效应的综合结果使得谷氨酸的合成增加。我们前期研究结果表明,CCL2能增加NMDA受体介导的EPSC幅度,在给予NMDA受体阻断剂后,其幅度明显下降,而谷氨酸具有激活NMDA受体的作用。因此,我们认为CCL2促进神经兴奋毒性发生的机制可能与增加谷氨酸在神经突触间隙的浓度,并过度兴奋NMDA受体有关。
综上,我们发现CCL2参与了炎症反应和兴奋性毒性的发生。这些伤害性刺激往往能诱导神经元凋亡的发生,且神经元凋亡导致神经元丢失应该是引起学习记忆力下降的证据之一。细胞凋亡是机体内清除老化、坏死的细胞结构,维持内环境稳态的程序性细胞死亡过程,对于保证机体的正常生理功能具有重要意义。然而,在如炎症、兴奋性毒性引起的Ca2+超载、氧化应激等条件的刺激下,导致凋亡异常发生,进而参与肿瘤、自身免疫性疾病、神经退行性疾病等疾病的病理生理过程。细胞凋亡途径分为caspase依赖性途径和非caspase依赖性途径,前者主要由caspase分子执行,又主要分为两类:①线粒体通路,由线粒体内的细胞色素c释放至胞质中,并切割caspase-9前体,激活caspase-9启动凋亡程序,该通路又被称为内源性途径。②外源性通路,也被称为死亡受体通路,即Fas/FasL通路,由FasL与Fas结合并活化caspase-8启动级联反应。死亡受体隶属于肿瘤坏死因子受体超家族,因此,TNF-ɑ能激活神经元细胞膜上的死亡结构域,进而引起caspase级联效应,此外,兴奋性毒性也能诱导细胞凋亡的发生。前已述及CCL2能促进TNF-ɑ和谷氨酸的表达,故本研究进一步检测了参与外源性凋亡途径中caspase-8、caspase-3的相对表达,将炎症反应、兴奋性毒性与外源性凋亡途径联系起来,探讨CCL2诱导海马神经元凋亡的机制。实验结果表明,各剂量CCL2能够以剂量依赖性关系上调海马组织内caspase-8、caspae-3 mRNA的相对表达,尤其是高剂量CCL2对caspase-8 mRNA相对表达的上调作用明显,证明CCL2可通过外源性细胞凋亡途径,导致海马神经元发生细胞凋亡。
综上,本研究发现,在行为学实验中,0.5~50 ng的CCL2剂量依赖性地损伤大鼠的学习记忆能力,并有以下几个方面作用:① 通过促进TNF-α表达,诱导炎症反应的发生;② 通过上调PAG表达,抑制GS活性,并促进EPSCNMDAR的幅度,介导神经兴奋毒性的发生;③ 通过上调AChE的表达,水解ACh,降低ACh的含量;④ 可活化caspase-8依赖的外源性细胞凋亡途径,介导细胞凋亡的发生。由此可以得出结论,0.5~50 ng的CCL2能剂量依赖性损伤学习记忆力,其机制和脑组织炎症反应、神经兴奋毒性及ACh含量下降有关,并最终诱导caspase-8依赖的外源性细胞凋亡途径,介导神经细胞凋亡的发生。
(致谢:本文中水迷宫实验在广西医科大学公共卫生学院完成,ELISA、RT-PCR在广西医科大学医学实验中心细胞与免疫实验室完成。感谢各位老师和同学给予的帮助。)