抗肺动脉高压药物研究进展
梁 宇,杜冠华
(中国医学科学院北京协和医学院药物研究所,北京市药物靶点研究与新药筛选重点实验室,北京 100050)
肺动脉高压(pulmonary hypertension,PH)是现今较难治愈的慢性心血管系统疾病之一,其主要表现为静息状态下平均肺动脉压≥25 mmHg。全球约有1%的人口受PH影响,65岁以上人群发病率可达5%~10%[1]。该病病因复杂,而机制尚不明确[2]。目前,临床诊断中没有明确的生物标志物,手术与介入治疗仅对少数特定类型有效。公认疗法是采用舒张血管药物进行对症治疗,但该方法不能降低患者的死亡率,治疗效果差。因此,继续探明病因、寻找有效的治疗药物是药物研发工作的重要任务。本文针对以PH和其他适应症为主的上市药物在PH治疗中的研究进展及作用特点进行综述。
1 PH发病机制及临床治疗策略
PH的发病机制尚不明确,目前认为,肺血管重构是最重要的病理变化,继发的肺血管与右心室病变,最终可引发右心功能衰退,甚至死亡。其他方面,炎症不仅参与血管重构,多种炎症因子与免疫细胞也能调控PH进程[3];能量供应障碍如糖酵解减少、脂肪酸氧化增加、谷氨酰胺分解增强与线粒体功能障碍,也会影响病理过程,且与右心功能密切相关[4];负责编码转化生长因子β(transforming growth factor β,TGF-β)受体的骨形态发生蛋白受体2(bone morphogenetic protein receptor type 2,BMPR2)基因易突变,是诱发PH的遗传性因素,而恢复AMPK/BMP/Smad通路表达能抑制肺动脉平滑肌细胞增殖,逆转血管病变[5],见Fig 1。
目前,针对改善肺血管结构功能的药物治疗主要基于以下两大策略:① 靶向肺血管收缩过程,促进肺血管舒张。此类药物选择性作用于表达异常的前列环素通路、内皮素通路与一氧化氮/环磷酸鸟苷(NO/cGMP)通路,舒张受损血管,恢复心肺正常血流供应。② 靶向肺血管重构过程,抑制肺血管增生。以逆转血管细胞凋亡抵抗型增殖、促进异常细胞凋亡、恢复血管细胞正常形态功能为目标,多针对受体酪氨酸激酶等生长因子受体等。目前临床治疗中主要应用血管舒张药物,但这些药物仅能减轻症状,无法逆转疾病进程。因此,研发治疗PH的药物迫在眉睫。
2 临床抗PH药物现状
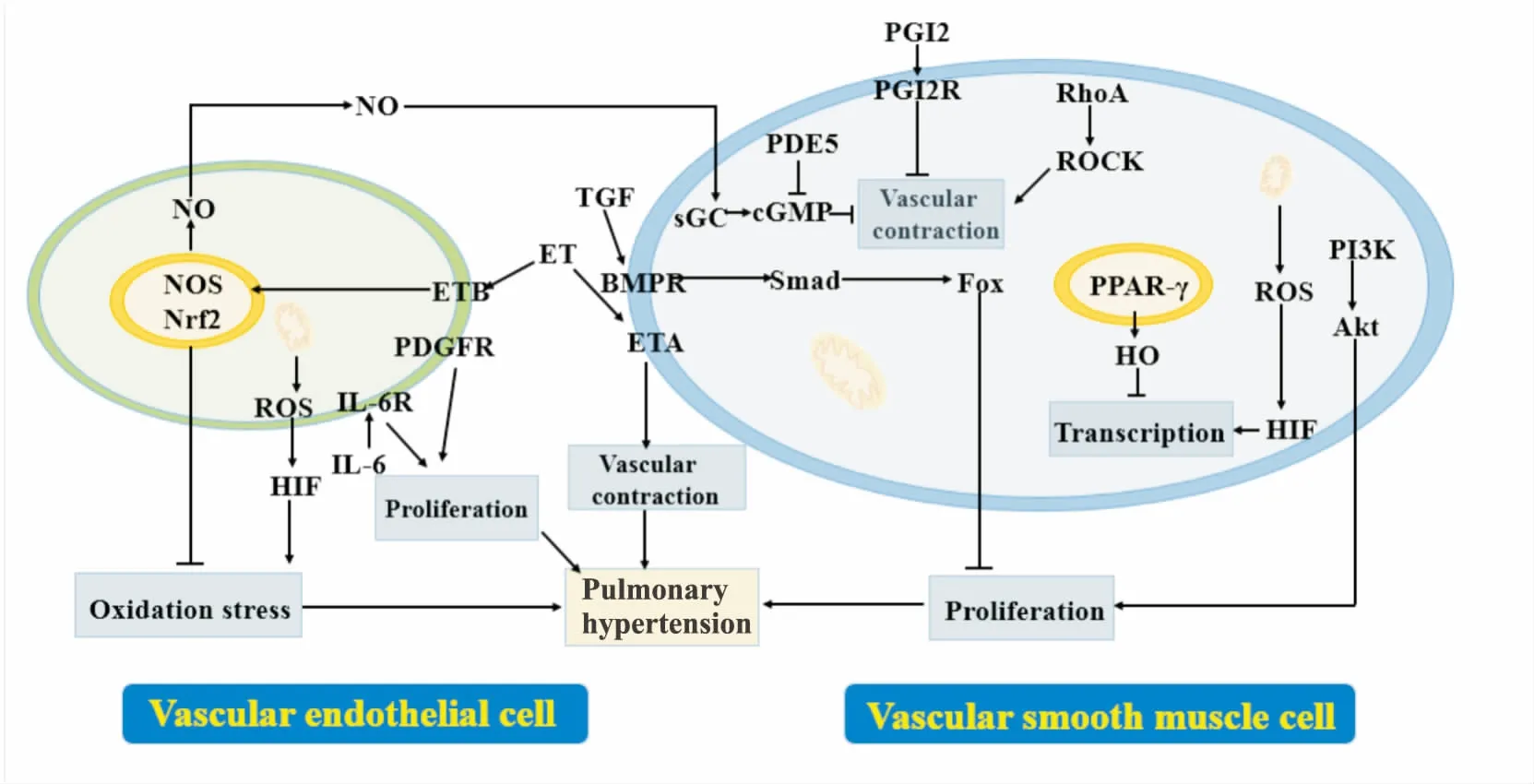
Fig 1 Partial pathological mechanism of pulmonary hypertension
目前已上市的抗PH药物包括前列环素类似物、前列环素受体激动剂、内皮素受体拮抗剂(endothelial receptor antagonist,ERA)、磷酸二酯酶-5抑制剂(phosphodiesterase-5 inhibitor,PDE-5i)和可溶性鸟苷酸环化酶受体激活剂(soluble guanylate cyclase stimulators,sGC),通过抑制部分通路发挥疗效,但均有不同程度的缺陷,见Tab 1。
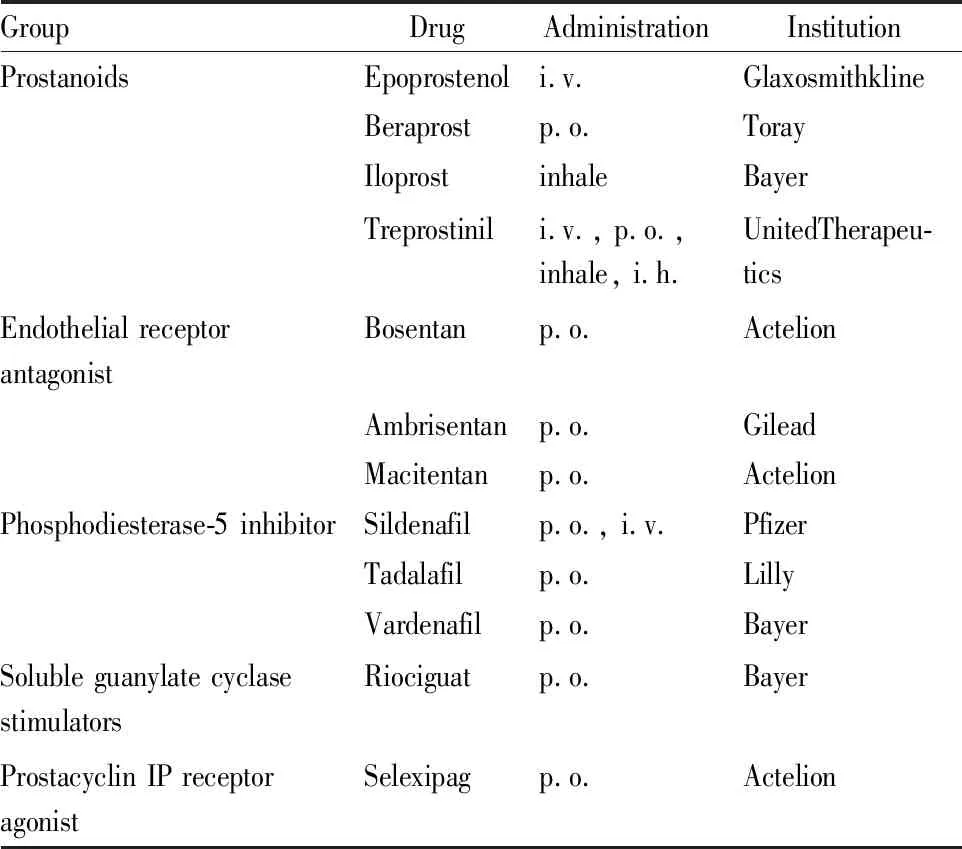
Tab 1 Approved anti-pulmonary hypertension drugs
All of the data come from Thomson Reuters Integrity and Drug bank (updated to June 1st, 2018).
2.1 靶向前列环素通路药物靶向前列环素通路药物主要包括前列环素类似物与前列环素受体激动剂两大类。
依前列醇(epoprostenol)作为第一个上市的前列环素类似物,可引发多种不良反应,如头痛、面部潮红、腹痛等,严重的反跳现象可致命[6]。贝前列环素(beraprost)疗效不稳定,无法作为PH治疗的首选药物。伊洛前列素(iloprost)作为吸入制剂,可能是治疗严重PH患者的有效药物。曲前列环素(treprostinil)最初主要通过皮下或静脉注射给药,现有多种衍生剂型。尽管短期口服可能会代替静脉、皮下给药,但静脉滴注疗效更佳,因此,有关口服制剂是否能够长期使用还有待观察[7]。
赛乐西帕(selexipag)是非前列环素类药物,靶向作用于前列环素受体,不易产生快速耐受现象,适于持续治疗,同时还能减少恶心、呕吐等不良反应,较为安全,但长期治疗的疗效仍需进一步观察[8]。
2.2 靶向内皮素通路药物波生坦(bosentan)作为内皮素受体A/B(endothelial receptor A/B, ETR-A/B)拮抗剂,在治疗时可能有肝功异常以外的不良反应,这是与其他药物合用时需要注意的因素。安贝生坦(ambrisentan)选择性作用于ETR-A受体,但治疗时仍有贫血、外周水肿、头痛、肝功能异常等药物不良反应[9]。马西替坦(macitentan)是一种新型口服、作用持久的双受体内皮素受体拮抗剂,在临床治疗中应密切观察患者的肝功指标与其他临床表现,如恶心、呕吐、右上腹疼痛、尿色异常等[10]。
2.3 靶向NO/cGMP通路药物西地那非(sildenafil)是第1个上市的磷酸二酯酶V抑制剂,易快速失效。右心功能障碍是预后不良的主要原因,但西地那非对此没有明显的改善作用,因此治疗具有局限性[11]。他达拉非(tadalafil)在人体中的半衰期长达17.5 h,给药频率低。与以上两种药物相比,伐地那非(vardenafil)的作用特点在于更快速地舒张肺血管,但患者预后仍不尽人意。
利奥西呱(riociguat)作为鸟苷酸环化酶激活剂,多改善临床中对PDE-5i治疗结果不理想的患者症状。然而,引发低血压是限制利奥西呱使用的主要因素,还会引起胃肠道不适、出血等[12]。
2.4 联合治疗与固定剂量组合药物临床治疗结果显示,单一药物治疗往往会引起耐受现象,疗效不佳,因此,采用药物联用是常见改良方式。联合使用作用于不同靶点的药物,共同促进一氧化氮合成或直接舒张血管发挥抗PH作用,同时较单药治疗可将临床恶化率降低35%[13]。2016年,美国FDA授予两种联合治疗方案,即安贝生坦/他达拉非与马西替坦/他达拉非固定剂量组合治疗PH。因此,ERA/PDE-5i固定剂量组合可能是未来临床治疗的更佳选择。
2.5 辅助治疗药物辅助心血管与呼吸系统疾病治疗药物可减轻患者的症状,提高疗效。氧疗法可以舒张血管,降低血管阻力,利尿药、抗凝药通过消除水肿、减少血栓形成也可辅助治疗。钙离子通道阻滞剂可以降低肺血管阻力,但仅对少数血管活性测试良好的患者具有治疗效果[14]。总之,辅助治疗药物仅能非特异性缓解病情。
3 以其他适应症为主的上市药物抗PH研究进展
正在进行临床研究的药物种类众多(Tab 2),主要集中在以下两方面:第一,对已有药物结构改造或靶点整合;第二,以其他适应症为主的新型抗PH药物临床研究也是目前研发的重点,主要对此进行讨论。
3.1 受体酪氨酸激酶抑制剂伊马替尼(imatinib)抑制酪氨酸激酶,阻断细胞增殖,目前用于治疗费城染色体阳性慢性粒细胞白血病。伊马替尼通过阻止血小板衍生生长因子受体激活,进而抑制新生血管内膜的形成与平滑肌细胞向内皮层转移,遏制PH的发展[15]。但高剂量伊马替尼在临床治疗中,因严重不良反应事件与给药问题而终止治疗的患者占93.8%,这对该药治疗PH形成重大阻碍[16]。伊马替尼(15 mg·kg-1)逆转动物心肺重构,提示低剂量即可产生一定的抗PH功效[17]。虽然降低给药剂量可降低不良事件的发生率,但能否用伊马替尼治疗PH仍有待进一步研究。
3.2 Rho激酶抑制剂法舒地尔(fasudil)作为Rho激酶抑制剂用于治疗蛛网膜下腔出血术后的血管痉挛。法舒地尔与其代谢产物羟基法舒地尔均能缓解不同PH动物模型的血管重构,提高存活率,具有良好的治疗效果[18]。患者在法舒地尔治疗后,心功能指数明显增高,但高剂量法舒地尔可能会引发肾损伤,因此,寻找合适的剂量是后续研究法舒地尔抗PH的关键[19]。
3.3 脂肪酸氧化抑制剂右心功能是影响PH患者预后与功能分期的决定性因素之一,抑制糖酵解与脂肪酸氧化,对后负荷增加与右心功能障碍具有改善作用。
在女性PH患者的肺血管平滑肌细胞中,促进雄激素转化为雌激素的芳香酶表达上调,促进PH病理进程。抑制芳香酶,调节雌激素水平可能对治疗PH有重要意义。雷诺嗪(ranolazine)是治疗慢性稳定型心绞痛的脂肪酸氧化抑制剂。8位接受雷诺嗪治疗的患者左心参数(容积、大小与舒缩功能)无明显变化,但右心室缩减,运动期间右心功能得到改善[20]。但该药物对患者血流动力学参数影响较小,无法解决肺血管功能异常。
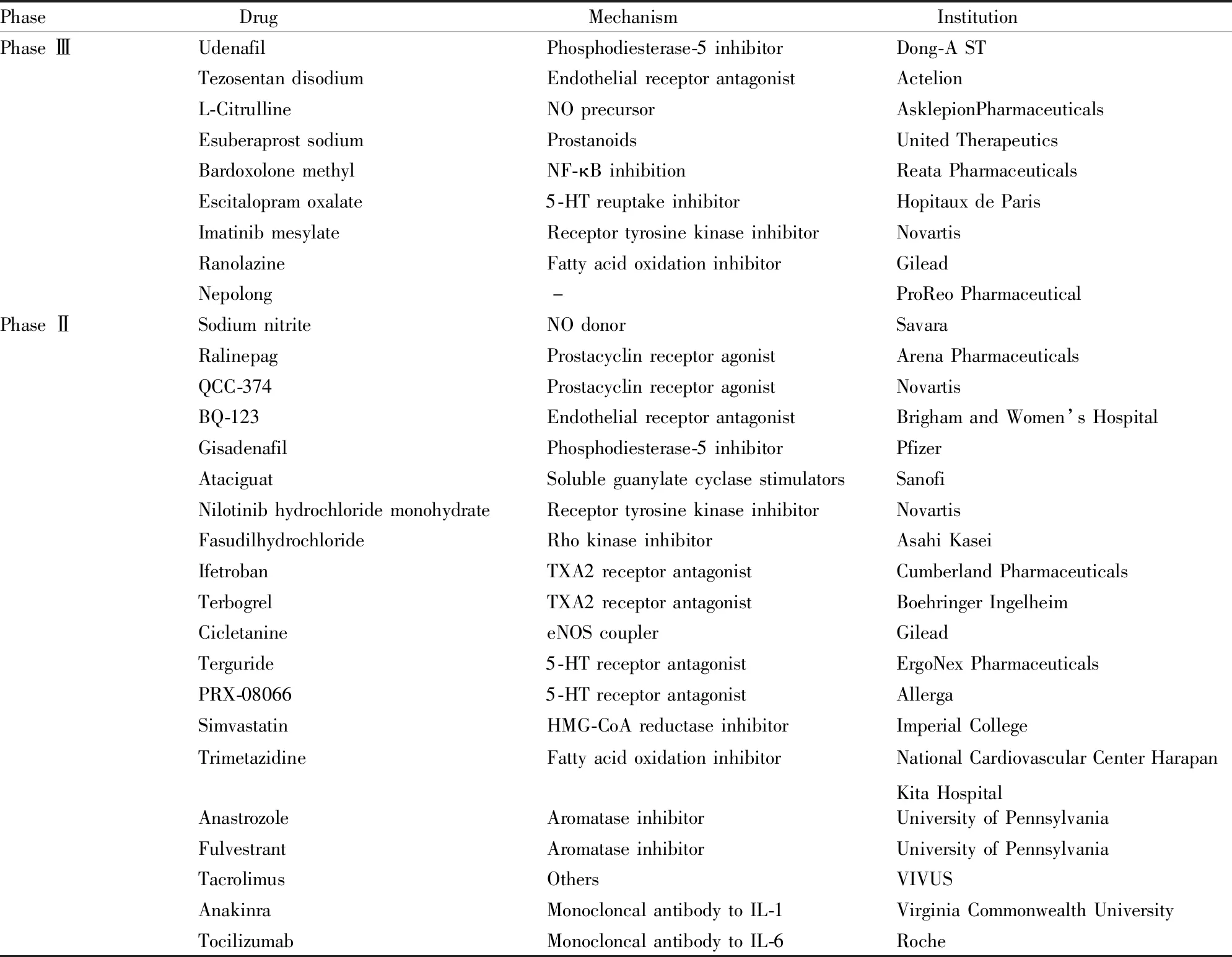
Tab 2 Anti-pulmonary hypertension drugs in clinical research (phase Ⅱ,Ⅲ)
All of the data come from Thomson Reuters Integrity and Drug bank (updated to June 1st, 2018).
3.4 雌激素水平抑制剂阿那曲唑是治疗绝经后妇女晚期乳腺癌的苄基三唑衍生物。雌激素抑制剂氟维司群(fulvestrant)和阿那曲唑(anastrozole)均能预防并治疗BMPR2基因突变引发的PH,氟维司群通过竞争性结合雌激素受体而下调受体的活性及表达,促进受体的降解,抑制雌激素诱发的乳腺癌,其对PH的作用与之类似[21],但相关临床试验仍在进行中。
3.5 其他药物治疗高血压的西氯他宁(cicletanine)可通过恢复内皮型一氧化氮合成酶(endothelial nitric oxide synthase,eNOS)结构,改善部分血管内皮功能。西氯他宁治疗后,对其他疗法无应答的患者的功能分级由IV级转为II级,氨基末端脑钠肽前体(N terminal pro B type natriuretic peptide,NT-proBNP)水平降低,可作为一种靶向血管重构与右心功能障碍的新疗法,但目前并无其他最新进展[22]。
他克莫司(tacrolimus)在2015年、2017年分别被美国、欧盟批准作为孤儿药治疗PH。TGF-β通过调控内皮间质转化与多条信号通路调节PH,BMPR2亦受其调节。BMPR2易发生基因突变,其表达下调是诱发PH的危险因素,他克莫司逆转野百合碱诱导PH大鼠中膜增厚与新内膜增生,促进PH患者体内BMPR2表达[23]。然而,其治疗潜力受药物自身特性限制,如溶解度低、不稳定等,但具有极佳的研发前景。
很多以其他适应症为主的上市药物,在抗PH研究中具有极大潜力,不同于传统的舒张血管药物,这些药物作用特点各异,具有抑制细胞增殖、改善右心功能、调节雌激素水平、调控基因表达等多种作用。辛伐他汀(simvastatin)作为降脂药物,通过降低脂质含量、减少脂质过氧化产生的自由基,发挥抗PH的作用。5-羟色胺(5-hydroxytryptamine,5-HT)受体是抗PH的重要靶点,特麦角脲(terguride)通过调控5-HT受体逆转血管重构,呈现出从根源抗PH的可能性[24]。此外,血栓烷A2(thromboxane A2,TXA2)受体拮抗剂、抗炎类药物都在动物实验中有较好活性,其在临床试验中的药物作用有待观察。
单一药物治疗仍具有较大局限,与血管舒张类药物合用可能会有更好的效果。同时,许多上市的中药提取物具有良好的抗PH活性,白藜芦醇通过影响单核细胞趋化蛋白-1,调控急性肺栓塞性PH等,这类药物也是目前国内研发的重点[25]。
4 抗PH药物研发的问题与展望
PH治疗效果差,疾病死亡率居高不下,而抗PH药物研发的难度大,进展缓慢,其原因主要有以下几点。
4.1 PH病理机制复杂,个体差异大PH分型多,病理机制不明,因此,继续探究病因是后续提高临床治疗成功率的关键[2]。基因突变常见于PH患者中,多靶点联合治疗是抗PH的关键。
4.2 现有药物未能改善血管结构功能目前,临床上的药物仅通过上调前列环素类水平、促进一氧化氮和环磷酸鸟苷表达等,调控血管功能,无法从根源上全面解决内皮功能障碍。因此,调控血管活性因子的表达是抗PH药物研发的重要目标。
4.3 现有药物缺乏改善右心功能的特性决定PH患者死亡率最重要因素之一是右心室血流动力学功能,但针对改善右心功能的治疗方案较少,患者预后差。寻找逆转心室重构、改善右心功能的药物,可以提高患者生存率,许多已上市药物呈现良好的治疗潜力。
4.4 临床前研究模型单一缺少不同模型研究结果的融合,是目前药物研发的难题之一。动物模型与人体实际环境不一致是药物开发中常见问题,增加人源模型的使用可能是解决此问题的途径之一。
近年来,临床上对PH的诊断与治疗已取得一定进展,药物的开发也在持续进行,但目前仍急需价格低廉、对因治疗的治疗药物,针对多靶点的联合治疗是未来治疗的主要方向。此外,目前很多已上市药物(其他适应症)在PH动物模型上具有较好的治疗效果,相关临床研究正在进行中,虽然有各自的治疗局限性,但上市药物适应症再开发,无论从应用性还是经济角度都具有重大意义,与现有药物合用可能会产生更好的治疗效果。尽管新型抗PH药物研发之路万分艰难,但随着对相关研究的深入,相信PH的死亡率与预后终会得到控制及改善。