靶向干扰Kv1.3通道基因表达对大鼠调节性T细胞的影响
李梦佳,徐 琦,程路峰
(新疆医科大学1. 药学院药理学教研室、2. 基础医学院免疫学教研室,新疆 乌鲁木齐 830011)
心肌纤维化是慢性心衰发展过程中的最重要的病理表现,但发病机制尚未完全揭示,主要认为肾素-血管紧张素系统(renin-angiotensin system,RAS)过度激活是导致心肌纤维化的因素。抗心肌纤维化的一线药物血管紧张素转化酶抑制剂(angiotensin coverting enzyme inhibitor,ACEI)或血管紧张素Ⅱ一型受体拮抗剂(angiotensinⅡ type1 receptor antagonist,AT1)长期应用出现“醛固酮逃逸”现象[1]。醛固酮将会促进转化生长因子β(transforming growth factor β,TGF-β)等的表达,进而刺激多种细胞向纤维母细胞转化,增加基质蛋白等的合成而促纤维化[2-3]。因此,阐明心肌纤维化发生、发展的机制,及预防和治疗是现代医学研究领域的热点。
有报道称[4],多种免疫细胞参与炎症反应,而调节性T细胞(regulatory T lymphocytes,Tregs)构建了T细胞的抗炎体系。自然性Tregs来源于胸腺,诱导型则依赖局部炎症环境产生。CD4+T淋巴细胞活化后,TGF-β的促进下向Tregs细胞分化,且通过进一步自分泌TGF-β等因子而被活化增殖(正反馈)。Tregs主要分泌TGF-β和IL-10,有报道[5],静脉回输Tregs主要通过IL-10介导而逆转心肌纤维化。但是,TGF-β又是重要的致纤维化因子,故Tregs细胞在心肌纤维化进程中扮演怎样的角色还需进一步证实。
Kv1.3通道作为调控T淋巴细胞增殖的靶点意义重大,其通过维持细胞静息膜电位,使T细胞处于能被活化的状态[8],T细胞活化后,促进第二信使Ca2+内流,增加细胞因子TGF-β的转录。通过阻断Kv1.3通道能抑制促炎细胞因子的产生和体外增殖[6-7]。前期研究发现[8],Tregs可通过分泌较多的TGF-β,促进心肌成纤维细胞(cardiac fibroblasts,CFs)的增殖,而依普利酮则可能通过阻断Kv1.3通道,抑制Tregs细胞活化增殖,减少TGF-β的分泌,而未引起CFs的增殖。基于此,本研究通过沉默Kv1.3通道基因并转染Tregs细胞,拟进一步明确Kv1.3通道在Tregs细胞活化增殖致心肌纤维化的靶点地位,明确依普利酮是否通过直接阻断Kv1.3通道功能,抑制Tregs细胞活化增殖而抑制纤维化进程。
1 材料与方法
1.1 实验动物SPF级SD大鼠,♂,体质量(200±20)g,由新疆维吾尔自治区实验动物研究中心提供,实验动物生产许可证号: SYXK(新)2016-0003。
1.2 药物与试剂Biotin小鼠抗兔CD4(BD554836)、PE小鼠抗大鼠CD25(BD554866),购自美国BD公司;Multisort microbeads Kit、Anti-PE Microbeads,购自德国Miltenyi Biotic公司;依普利酮、大鼠淋巴分离液(LTS 1083)、胎牛血清,购自Sigma公司;RPMI 1640培养基,购自HyClone公司;SYBRTMSelect Master Mix,购自Life Technologies;抗大鼠CD3单抗、抗大鼠CD28单抗,购自Thermofisher eBioscience公司;重组大鼠IL-2、TGF-β1,购自Peprotech公司;IL-10、TGF-β试剂盒,购自武汉华美生物技术有限公司;靶向抑制Kv1.3的慢病毒载体及阴性对照病毒载体,由上海吉凯基因公司构建及包装。
1.3 仪器Midi型磁力架分选器、25LS型分选柱(德国Miltenyi);KDC 40低速离心机(中科中佳科学仪器有限公司);HF 240二氧化碳培养箱(Heal Force);CT15RE型低温离心机(日本Hitachi);Port-a-path®工作站、负压控制器、NPC®-1芯片(德国Nanion,Part-a-Patch®NPC®-1);EPC-10放大器(德国HEKA)。
1.4 方法
1.4.1大鼠Tregs细胞的分选及活化 摘取正常大鼠脾脏,通过加入大鼠淋巴分离液,密度梯度离心得到单个核细胞;免疫磁珠双阳性分选两步法获得Tregs细胞(纯度≥95%)。将分离好的Tregs细胞接种于前1 d由CD3抗体包被过夜,并于次日吸出CD3抗体,用等体积的PBS体积洗板1次,含CD28抗体(2 mg·L-1)的24孔板中,在37 ℃、5% CO2饱和湿度下,用含IL-2(10 g·L-1)、TGF-β1(5 μg·L-1)、双抗100 kU·L-1及RPMI 1640培养基500 μL培养活化该细胞,细胞在刺激24 h后体积略微增大,进入活化状态,刺激48 h可进行病毒感染。
1.4.2RNAi-Kv1.3通道基因转染大鼠Tregs细胞 收集活化的Tregs细胞,以无血清培养基饥饿Tregs细胞12 h,以备转染。按每孔1×105个细胞的浓度接种于24孔板中,按MOI=100,将LV-KCNA3(64803-1)、LV-KCNA3(64804-1)、LV-KCNA3(64805-1)3个不同的干扰靶点及阴性对照病毒CON077(No target Kv1.3)(Tab 1),分别加入活化的Tregs细胞,同时加入感染增强液聚凝胺至终浓度6 μg ·L-1,最终感染体积为500 μL,十字交叉法晃动24孔板以保证铺板均匀;于1 000 r·min-1离心感染60 min。离心结束后,将平板放入37 ℃、5% CO2培养箱中培养12 h,于次日加入500 μL含IL-2 (10 μg·L-1)、TGF-β1(5 μg·L-1)、双抗100 kU·L-1及RPMI 1640培养基继续培养。倒置荧光显微镜观察细胞转染后荧光。

Tab 1 Targeted interference sequences
1.4.3实时定量PCR检测Kv1.3通道基因的表达 将LV-KCNA3(64803-1)、LV-KCNA3(64804-1)、LV-KCNA3(64805-1)三个不同的干扰靶点及阴性对照病毒CON077(No target Kv1.3),感染Tregs细胞成功后,TRIzol法提取总RNA,逆转录cDNA,于冰上将2.0 μL cDNA加入扩增体系(SYBR 5 μL、Prim 0.7 μL、H2O 1.6 μL),共10 μL。反应条件为:61 ℃、5 min,42 ℃、1 h,70 ℃、5 min,4 ℃循环。PCR反应以GAPDH作为内参照(管家基因),每个样本均以GAPDH的表达来标准化,所有孔均设3个复孔,实验重复3次,每次实验设标准曲线。以相对定量2-△△CT表示目的基因的表达相对于对照组的变化倍数,△△CT=实验组(目的基因的拷贝数-管家基因的拷贝数)/对照组(目的基因的拷贝数-管家基因的拷贝数)。同时比较干扰载体组及阴性对照病毒组基因的表达量,计算干扰效果。引物序列见Tab 2。

Tab 2 Primer sequences
1.4.4全细胞膜片钳检测正常组Tregs、RNAi-Kv1.3 Tregs细胞电流变化 使用EPC10放大器,负压控制器通过数据转换器与计算机连接,刺激信号及电流、电压输人信号的采集均由软件控制。NPC®-1芯片内层注入5 μL电极内液,NPC®-1芯片电极入水阻抗为8~12 MΩ。膜电位钳制在-80 mV,Tregs细胞Kv1.3钾通道予以-80~+40 mV斜率刺激,刺激时长为500 ms。记录得到Kv1.3钾通道的电流-电压(I-V)曲线。
1.4.5细胞因子水平检测 将细胞分为Tregs组、Tregs+EPL组、RNAi-Tregs组、RNAi-Tregs+EPL组,收集各组细胞培养液,外液通过1 300 r·min-1离心10 min,收集上清液,分装置于200 μL EP管(避免反复冻融);内液细胞分泌因子通过PBS清洗,放在-20 ℃冰箱10 min,37 ℃水浴锅中5 min,如此反复冻融3~5次,离心收集上清液。按照试剂盒说明书检测各组细胞内外液分泌的IL-10、TGF-β水平。
2 结果
2.1 Treg细胞的分选免疫磁珠分选的Tregs细胞经过CD3/CD28刺激活化,细胞体积变大,边缘透亮(Fig 1)。
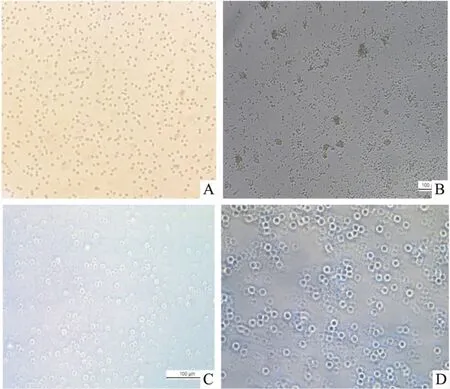
Fig 1 Tregs and CFs cell separation
A: Immunomagnetic beads separation Tregs cell (×200); B: Stimulate the activation of Tregs by CD3/CD28 (×100); C: Stimulate the activation of Tregs by CD3/CD28 (×200); D: Lentivirus infects Tregs cell(×200).
2.2 RNAi-Kv1.3转染大鼠Tregs细胞Tregs细胞在MOI=100、感染增强液聚凝胺6 μg L-1、离心转染条件下,进行GFP慢病毒转染后,在荧光倒置显微镜下可观察到GFP绿色荧光蛋白(Fig 2)。
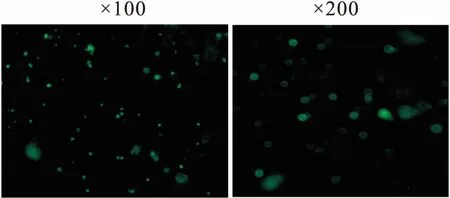
Fig 2 Tregs cells infected by lentivirus
2.3 RNAi Kv1.3转染Treg细胞对Kv1.3通道mRNA表达的影响LV-Kcna3 64803-1(Kv1.3-64803)、LV-Kcna3 64804-1(Kv1.3-64804)、LV-Kcna3 64805-1(Kv1.3-64805)三个不同的干扰靶点及阴性对照病毒CON077(No target Kv1.3)感染Tregs细胞成功后,Kv1.3-64803转染Tregs细胞Kv1.3 mRNA表达较其他各组表达明显较低(P<0.01),其中干扰靶点Kv1.3-64803对Tregs细胞mRNA抑制率最大为78%(Fig 3)。

Fig 3 Relative expression and inhibition rate of Kv1.3 channel mRNA in each
A:Control;B:NO-target kv1.3;C:KV1.3-64803;D:KV1.3-64804;E:KV1.3-64805.*P<0.05,**P<0.01vscontrol;##P<0.01vsKv1.3-64804orKv1.3-64805
2.4 RNAi-Kv1.3转染Treg细胞对Kv1.3通道电流密度的影响全细胞膜片钳模式测定正常Tregs细胞与沉默组Tregs细胞在+40 mV Kv1.3钾通道电流变化,与正常组Tregs细胞Kv1.3钾通道+40 mV的电流峰值密度[(601.7±11.76) pA/pF,n=10]相比,沉默组峰值电流密度[(172.5± 16.94) pA/pF,n=12],抑制率为71.3%(Fig 4)。

Fig 4 Kv1.3 channel current changes between normal group and silent group
A: The original graph of the current density with the slope stimulation,the dotted line is the standard error; B: The Kv1.3 current density bar chart under +40 mv.**P<0.01vscontrol.
Tab 3 IL-10,TGF-β levels secreted by Tregs(ng·L-1,n=8)

GroupIL-10IntracellularExtracellularTGF-βIntracellularExtracellularTregs28.48±2.7938.37±4.88174.18±4.15154.96±1.29Tregs+EPL26.53±4.6027.01±3.90∗139.54±3.90∗∗124.05±0.56∗RNAi-Tregs26.58±1.8633.96±2.88123.49±1.91∗∗111.59±4.27∗∗RNAi-Tregs+EPL21.47±1.5132.79±1.92120.56±2.47110.66±0.91
*P<0.05,**P<0.01vsTregs
2.5 Tregs细胞分泌IL-10、TGF-βELSIA法检测细胞Tregs组、Tregs+EPL组、RNAi-Tregs组、RNAi-Tregs+EPL组IL-10、TGF-β分泌水平,EPL浓度为30 μmol·L-1。与Tregs组相比,RNAi-Tregs组内外液TGF-β水平明显降低(P<0.01),Tregs+EPL组内外液TGF-β水平亦降低(P<0.05);与RNAi-Tregs组相比,RNAi-Tregs+EPL组内外液TGF-β水平无明显变化;而Tregs组、Tregs+EPL组、RNAi-Tregs组和RNAi-Tregs+EPL组内外液IL-10水平无明显变化(Tab 3)。
3 讨论
Tregs在机体免疫与平衡中占据着重要地位。但是,Tregs在炎症情况下对器官纤维化的作用并未引起足够重视,而且有争议:一种假设认为免疫抑制Tregs能引起器官纤维化;另一种观点却认为,Tregs主要分泌TGF-β而导致了纤维化。因此,减少不必要的T淋巴细胞活化或增强Tregs细胞调节作用,有可能作为治疗心力衰竭的新靶标[9-10]。
越来越多的间接和直接证据提示,Kv1.3通道与Tregs细胞的关系密切。Varga等[11]在多发性硬化患者的Tregs中发现Kv1.3通道含量较少。Estes等[12]利用高通量定量方法,分析了人初始淋巴细胞的K+通道功能性活动,结果提示Kv1.3通道的活性可作为T细胞的功能活性标志物。而既往的研究[13-15]发现,可以通过沉默记忆T细胞上的Kv1.3通道,作为治疗自身性免疫性疾病的一种手段。因此,RNAi技术在细胞与分子水平上很大程度上都得到了广泛应用。本研究通过采用RNAi技术,将RNAi-Kv1.3慢病毒载体转染至大鼠Tregs细胞。Tregs细胞主要为悬浮细胞,非贴壁生长,难转染。经慢病毒转染后,沉默组Kv1.3通道基因水平抑制率达到78.0%,电流降低71.3%。ELSIA法检测Tregs细胞分泌因子水平,Tregs+EPL组内外液TGF-β水平降低,RNAi-Tregs组内外液TGF-β水平也明显降低,但是RNAi-Tregs+EPL组内外液TGF-β水平相比RNAi-Tregs组却无明显变化。而体外不给予EPL或给予EPL情况下,RNAi-Kv1.3 Tregs组并没有任何变化,这表明沉默Kv1.3通道后,EPL不再发挥抑制Tregs细胞分泌TGF-β水平;且沉默Kv1.3通道后,可抑制Tregs细胞内外液分泌的TGF-β水平,与EPL可通过下调Tregs细胞Kv1.3通道表达,进而抑制Tregs细胞内外液分泌的TGF-β水平结果相一致。这表明Kv1.3通道在Tregs细胞调控纤维化的作用中扮演着重要角色。
以上研究结果阐明了Kv1.3通道介导着Tregs细胞的活化增殖,而EPL可通过直接抑制Kv1.3通道,进而减少TGF-β的分泌,从而抑制心肌纤维化,这与我们前期分子对接显示结果相一致[16]。提示Kv1.3通道可作为心衰诊治的潜在免疫学靶点。