BCL2-938C>A基因多态性与儿童急性淋巴细胞白血病危险度的相关性研究*
黄体龙,李曾丽,桑宝华,雷庆龄,宋春艳,杨春会,林云碧,吕 瑜,田 新,杨跃煌
(云南省昆明市儿童医院血液科 650228)
儿童血液系统恶性肿瘤以急性淋巴细胞白血病(ALL)最常见,每年发病率3/10万~4/10万,多见于学龄前期和学龄期儿童。儿童ALL分低、中、高危组,不同危险度ALL的治疗强度不同、预后不同。危险度分级由多种预后危险因素综合评估。随着危险度分组的不断精确和治疗方案的不断改进,儿童ALL的治愈率在近半个世纪来得到了显著的提高,目前化疗可以使儿童ALL的5年总生存率(OS)超过80%[1-2]。然而,长期化疗会引起严重的不良反应,尤其对高危患者而言,高强度的化疗不良反应更加严重[3]。因此,不断发掘新的预后因素、进一步精确危险度分级,制定更加合理有效的化疗方案是提高ALL患儿治愈率,减少不良反应的关键。
1984年TSUJIMOTO等首次在滤泡性淋巴瘤患者的肿瘤细胞中发现位于18号和14 号染色体(t14;18)易位连接处的BCL2基因。BCL2基因能够促进细胞生长、抗细胞凋亡[4]。BCL2基因位于18号染色体长臂2区1带(18q21),含3个外显子和2个启动子,其编码产物为1个由239个氨基酸组成的膜蛋白[5]。已有多篇文献报道BCL2-938 C>A与癌症易感性和预后相关[6-7]。本文旨在研究BCL2-938 C>A基因多态性在儿童ALL危险度分组及治疗分层中的意义,以使危险度分组更加精确,进一步提高儿童ALL的治愈率、减少过度治疗及治疗相关的不良反应。
1 资料与方法
1.1一般资料 收集2007年5月至2017年1月昆明市儿童医院血液科诊断和治疗的69例ALL儿童作为研究对象,69例患儿均按照细胞形态学、免疫学、细胞遗传学和分子生物学分型(MICM)确诊,并排除其他恶性肿瘤。按CCLG-ALL-2008方案进行危险度分组及治疗[8]。本研究经昆明市儿童医院伦理委员会批准且患儿家属均签署知情同意书。69例ALL患儿中,男42例,女27例;初诊年龄0.8~12.9岁,平均为(5.8±3.2)岁;随访时间为2~117个月,中位随访时间为15个月。其中低危组28例,中危组20例,高危组21例;B系急性淋巴细胞白血病(B-ALL)55例,急性T淋巴细胞白血病(T-ALL) 14例;55例患儿初发白细胞计数(WBC)为0~50×109/L,14例在50×109/L以上。检测到分子遗传学改变有19例,包括5例Ph阳性(其中1例BCR/ABL阳性同时伴有IKZF1基因缺失),9例TEL/AML1融合基因阳性,3例SIL/TAL1阳性,1例ASSI基因缺失,1例有MYC基因分离重排。复发8例,其中骨髓复发5例,髓外复发3例。死亡4例,放弃治疗1例。
1.2仪器与试剂 PCR仪(美国ABI,GeneAmp®9700 384 Dual);点样仪(美国Agena,MassARRAY Nanodispenser RS1000);质谱分析仪(美国Agena,MassARRAY Compact System)。主要试剂:血液基因组提取试剂盒(中国天根Tiangen,DP319);基因分型试剂盒(美国Agena,Complete Genotyping Reagent Kit,10148-2)。
1.3方法
1.3.1标本的采集与保存 留取初诊ALL患儿的骨髓1.5 mL,乙二胺四乙酸(EDTA)抗凝,置于-80 ℃冰箱保存。
1.3.2基因组DNA的提取和SNPs分型
1.3.2.1从患儿EDTA抗凝骨髓1.5 mL中提取DNA,紫外分光光度法检测OD260/OD280。
1.3.2.2PCR扩增及纯化目的基因检测位点为rs2279115,根据SNP位点使用Agena公司的Assay Design 3.1软件进行引物设计并用基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF-MS)对合成的引物进行质检。PCR反应体系(5 μL):去离子水1.8 μL,正向与反向引物各0.5 μL,DNA模板1.0 μL,10×buffer液0.5 μL,Mg2+0.4 μL,dNTP 0.1 μL,Hotstar 0.2 μL。PCR反应条件:95 ℃预变性2 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,共45个循环;最后72 ℃延伸5 min。SAP酶消化非特异性产物。
1.3.2.3单碱基延伸反应延伸反应体系(2 μL):0.619 μL水,10×iplex buffer 0.2 μL,Terminator mix 0.2 μL,引物0.94 μL,单碱基延伸酶0.041 μL。循环条件:94 ℃ 30 s,94 ℃ 5 s,52 ℃ 5 s,80 ℃ 5 s,内部5个循环,共45个循环,72 ℃ 3 min结束。在每个延伸反应物加入树脂35 min,脱盐;将脱盐后的样品点样在样品靶上,自然结晶。
1.3.2.4MALDI-TOF-MS分型检测时向延伸反应产物的384孔板中加入16 μL三蒸馏水,在离心机中以2 000 r/min离心3 min;加入树脂,在反向摇匀仪上做树脂纯化反应35 min,脱盐;反应完成后,在离心机中以2 000 r/min离心3 min;将脱盐后的样品点样在样品靶上,自然结晶。用Typer 4.0软件检测质谱峰,并根据质谱峰图鉴定各样本靶位点基因型。Mass Array®SNP检测SNP多态性,用MALDI-TOF-MS检测延伸产物的相对分子质量,分析软件Mass Array TYPER 4.0 进行基因分型分析。

2 结 果
2.1BCL2-938 C>A基因型分布特点 C等位基因在这个样本中的频率为0.53,A等位基因的频率为0.47,基因型分布情况符合Hardy-Weinberg平衡。69例ALL儿童BCL2-938 C>A基因型的检测结果显示,CC基因型有23例,CA型27例,AA型19例,见表1。
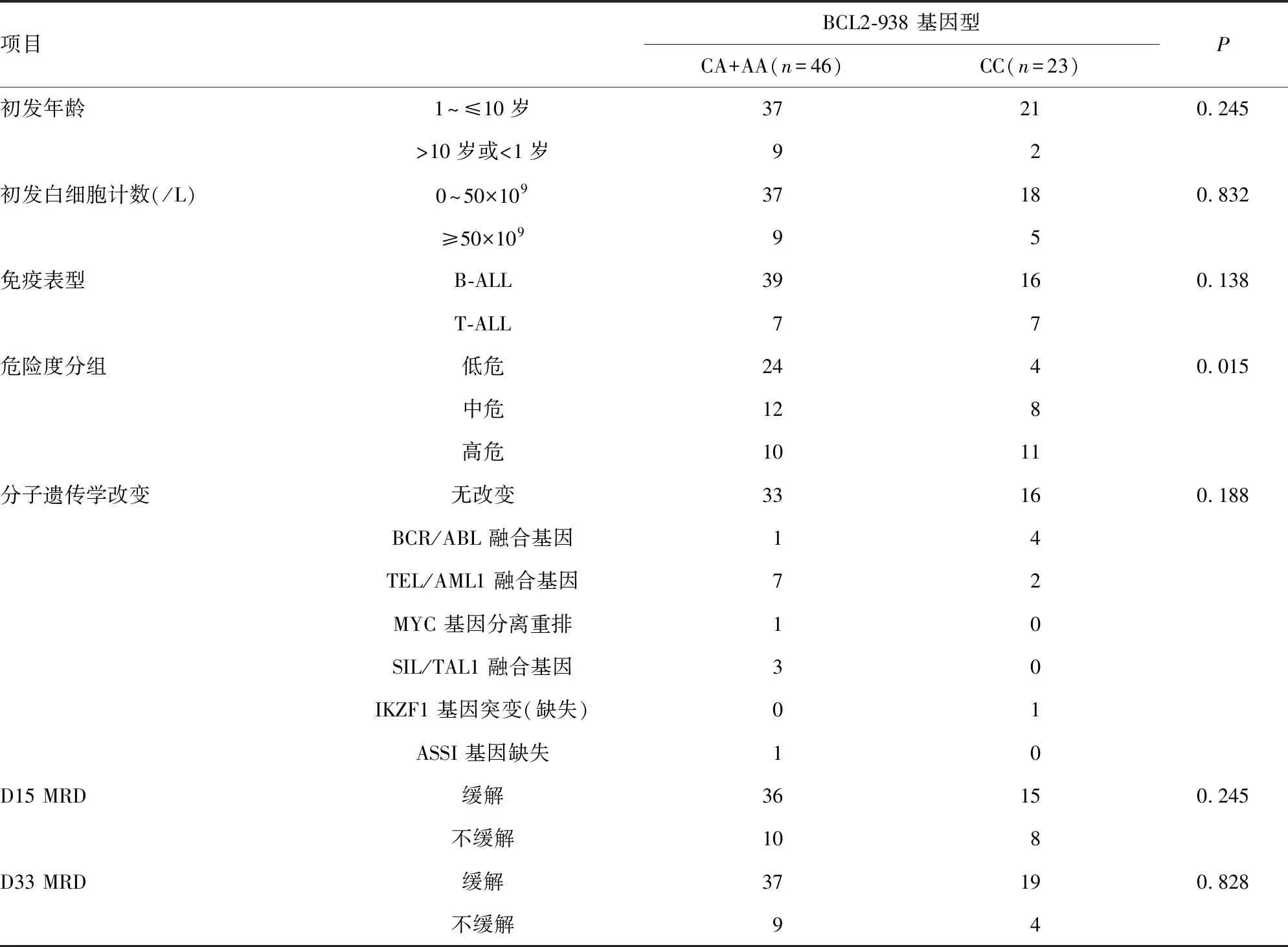
表1 BCL2-938C>A基因型与临床危险因素
2.2BCL2-938C>A基因型与临床危险因素相关性 ALL患儿预后与发病年龄(1~≤10岁或>10岁)、初发外周血白细胞计数(≥50×109/L)、免疫表型(T-ALL)、预后不良的分子遗传学改变(BCR-ABL融合基因等)、早期治疗反应不良(D15及D33MRD未缓解)等危险因素有关。本研究提示BCL2-938C>A基因型与儿童ALL危险因素差异无统计学意义,包括患儿的发病年龄、免疫表型、分子遗传学改变、初发外周血白细胞计数、早期治疗反应不良,见表1。
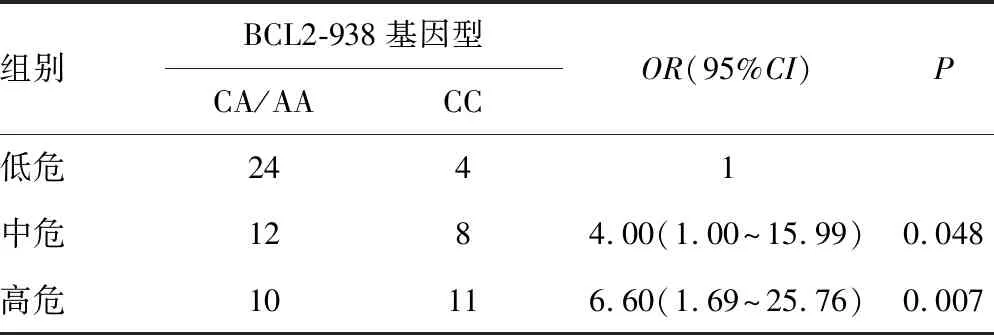
表2 BCL2-938基因型与不同危险度ALL的相关性
2.3BCL2-938基因型多态性与ALL的危险度相关性 不同BCL2-938基因型间ALL的危险度差异有统计学意义(P=0.015),见表1。CC基因型患儿的百分比在低危(14.3%)、中危(40.0%)、高危组(52.4%)中呈逐渐上升趋势。携带CC基因型ALL患儿出现在中高危组的频率较CA/AA基因型患儿高。CC基因型的ALL患儿比CA/AA基因型患儿有更高风险分布于中、高危组(P<0.05),见表2。
3 讨 论
儿童急性淋巴细胞白血病的治疗是一个漫长且复杂的过程,包括早期诱导治疗、巩固治疗和继续治疗3个阶段。早期的诱导治疗是为了减少肿瘤细胞的负荷并恢复骨髓正常的造血功能,是决定患儿能否获得长期无病生存的关键。巩固治疗的目的是进一步清除诱导治疗后残留的白血病细胞。继续治疗包括再诱导治疗及为期2~3年的维持治疗,目的在于防止白血病在诱导、巩固、缓解后出现复发。在过去20年中,ALL儿童生存率得到了显著改善,这归功于危险度分组的不断完善及化疗方案的不断改进。儿童ALL危险度分组的不断精确,得益于人们对ALL细胞遗传学及其他生物学特征等遗传相关预后因素的不断发现、认识及利用[9]。儿童ALL分为低、中、高危险度组,不同危险度给予不同的治疗强度[10]。低危患儿通常预后较好,予以低强度的化疗方案就可达到长期无病生存,而相对预后较差的中高危组患儿需要更高强度的化疗来避免复发。分层治疗使得高危患者接受更强的治疗以寻求长期无病生存,让不存在高危因素的患儿治疗强度降低,从而避免过度治疗、减少化疗相关不良反应的发生。
BCL2是在调节细胞凋亡和延迟细胞周期中起重要作用的抗凋亡蛋白[11]。目前BCL2基因启动子区域仅有1个SNP,其位于核苷酸-938位置(BCL2-938 C>A)。有研究表明,BCL2-938 C>A启动子多态性显著影响了多种癌症的BCL2基因启动子活性及BCL2的表达[12-13]。BCL2-938 C>A多态性与不同类型癌症的风险关联不同,这取决于组织细胞的特异性。LIU等[14]发现BCL2-938 AA基因型与食管癌的易感性有关;LI等[15]的研究显示BCL2-938 CC基因型会导致人群罹患食管癌及其癌前病变的风险增加。有文献[16]报道BCL2在成年ALL的诱导治疗期间是一个潜在的治疗反应指标。本文研究了BCL2-938 C>A多态性与ALL危险度的关系,发现基因多态性与儿童ALL的危险度分组密切相关,CC基因型ALL患儿出现在中高危组的频率更高。此外,本文研究了BCL2-938 C>A基因多态性与目前儿童ALL常见的危险因素相关性,发现BCL2-938 C>A基因型与发病年龄、初发白细胞计数、分子遗传学改变、D15及D33 MRD等危险因素无明显相关性。本研究提示CC基因型可能是儿童ALL危险分组的重要因素。
综上所述,BCL2-938 C>A基因多态性与儿童ALL的危险度分组密切相关,BCL2-938 CC基因型可能是儿童ALL重要的危险因素。在儿童ALL中,BCL2-938 C>A基因多态性的表达可能有利于精确危险度分组及进一步指导临床治疗。

