ADC值评估早期宫颈癌淋巴管侵犯的价值*
徐晓曦,韩云,王鹏,张蔚,宋琼
430022 武汉,武汉市第一医院 放射科(徐晓曦、韩云、王鹏、张蔚); 430081 武汉,武汉市第九医院 药剂科(宋琼)
宫颈癌是女性常见的恶性肿瘤,其致死率在发展中国家位居第2位[1]。不同于进展期宫颈癌,对于早期宫颈癌患者(Ⅰ期、Ⅱa期)而言,以手术为主的综合治疗能够使大多数患者获益[2]。然而,术后复发极大地限制了患者远期生存率以及生存质量;因此,尽早甄别宫颈癌术后复发的危险因素,并针对性调整治疗方案,对改善患者预后有着非常积极的意义。近年来研究指出[3-6]:在导致宫颈癌术后复发的诸多危险因素中,淋巴管侵犯(lymphovascular invasion,LVI)介导了非常关键的环节,正逐渐引起了临床研究人员的重视。
目前,对宫颈癌LVI的诊断主要依赖病理学检查,一方面由于取材不足或位置不当,穿刺到的组织难以反映病灶整体特征,易造成结果误差;此外,穿刺属于有创性操作,病人接受度较差[7]。随着影像学的发展衍进,以组织病理学为基础的影像学检查,能够在宏观征象上实现对微观病理变化的预测,为临床提供无创、全局化的诊断信息[8]。磁共振扩散加权成像(diffusion weighted imaging,DWI)是近年来在宫颈癌应用较为成熟的功能序列,能够通过对活体水分子扩散受限程度的监测来反映病变的细胞密度、核质比等生物学信息,并能够通过表观扩散系数(apparent diffusion coefficient,ADC)进行定量分析。研究指出:MR-DWI在对宫颈癌的定性诊断[9]、组织病理分级的预测[10]以及放化疗效果的评估[11]等方面具有较高的应用价值。然而,将MR-DWI值运用在宫颈癌LVI的预测研究尚鲜有文献报道,本研究旨在分析不同ADC值与宫颈癌LVI的相关性,为宫颈癌LVI的最优化定量诊断提供参考依据。
1 资料与方法
1.1 临床资料
收集武汉市第一医院2014年6月至2018年6月收治的宫颈癌患者资料进行回顾性分析。并设定入组标准如下:纳入标准:① 均行常规MR及MR-DWI序列扫描;② 国际妇产科联合会(International Federation of Gynecology and Obstetrics, FIGO)分期为宫颈癌Ⅰ期、Ⅱa期;③ 均行手术治疗,术后获取到确切病理结果。排除标准:① 行放化疗等宫颈癌相关性治疗; ② 合并其他恶性肿瘤等。经过本研究入组标准严格筛选后,最终入组宫颈癌患者81例,平均年龄(48.15±11.45)岁。本研究经我院伦理委员会审核通过,并遵守其相关的章程、接受其监督。
1.2 磁共振扫描检查
采用1.5T超导磁共振扫描仪(GE,HD signal),患者取仰卧位,充盈膀胱,扫描范围从主动脉分叉到耻骨联合下缘。扫描序列包括:轴位快速自旋回波(FSE)T1WI,TE 7.3ms,TR 800ms,FOV 38cm×38cm,矩阵 386× 256,激励次数(NEX)=2,层厚 4mm,层间距 1mm;轴位 FSE T2WI,TE 130ms,TR 3 700ms,FOV 38cm×38cm,矩阵 240×260,激励次数(NEX)=2,层厚 4mm,层间距 1mm。动态增强扫描:应用横向面快速扰相梯度回波(fast Spoiled Gradient Recalled,FSPGR)序列,造影剂(马根维显,拜耳)以0.1mmol/kg体重计算注射剂量,注射速率2~3mL/s。嘱患者单次屏气,分别于16s、32s以及48s各进行一次扫描。FSPGR ,TE 1.4ms,TR 155ms,FOV 38cm×38cm,矩阵 320×220,激励次数(NEX)=1,层厚 4mm,层间距 1mm。MR-DWI扫描:TE 65ms,TR 2 000ms,FOV 38cm×32cm,矩阵 380×362,层厚 4mm,层间距 1mm,b值取0、800mm2/s,ADC mapping由配置的后处理工作站自动生成。
1.3 图像采集及数据处理
在系统后处理工作站上进行图像的采集以及各ADC值的获取。对比常规MR与增强扫描图像,在ADCmapping上测量方式具体如下(图1、2):①参照Liu等[10]的方法,避开较为明显的坏死、囊变层面,选取病灶最佳层面,在肿瘤实性部分沿病灶边缘勾画(region of interest, ROI),获取瘤灶平均ADC值(Tumor-ADCmean值)、瘤灶最小ADC值(Tumor-ADCmin值);②在瘤灶边缘宫颈组织放置20~30mm2的ROI,获取瘤周ADC值(Peritum-ADC值);③ 通过计算Peritum-ADC值/ Tumor-ADCmin值,得到标准化ADC值(ADC-normalized值)。以上操作均由两名有10年以上工作经验的高年资影像科医师在未知病理结果的情况下独立进行,并在不同的时间段完成,以避免回忆偏倚,取两名医师测量的均值作为所需的ADC值。
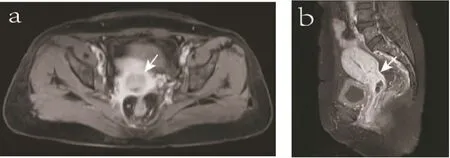
图1 宫颈癌常规磁共振扫描序列
Figure 1. Routine Magnetic Resonance Imaging Sequence of Cervical Cancer
AxialenhancedT1WIshowedslightenhancementofthelesion(asindicatedbythearrow)(Panela);SagittalenhancedT1WI(Panelb).
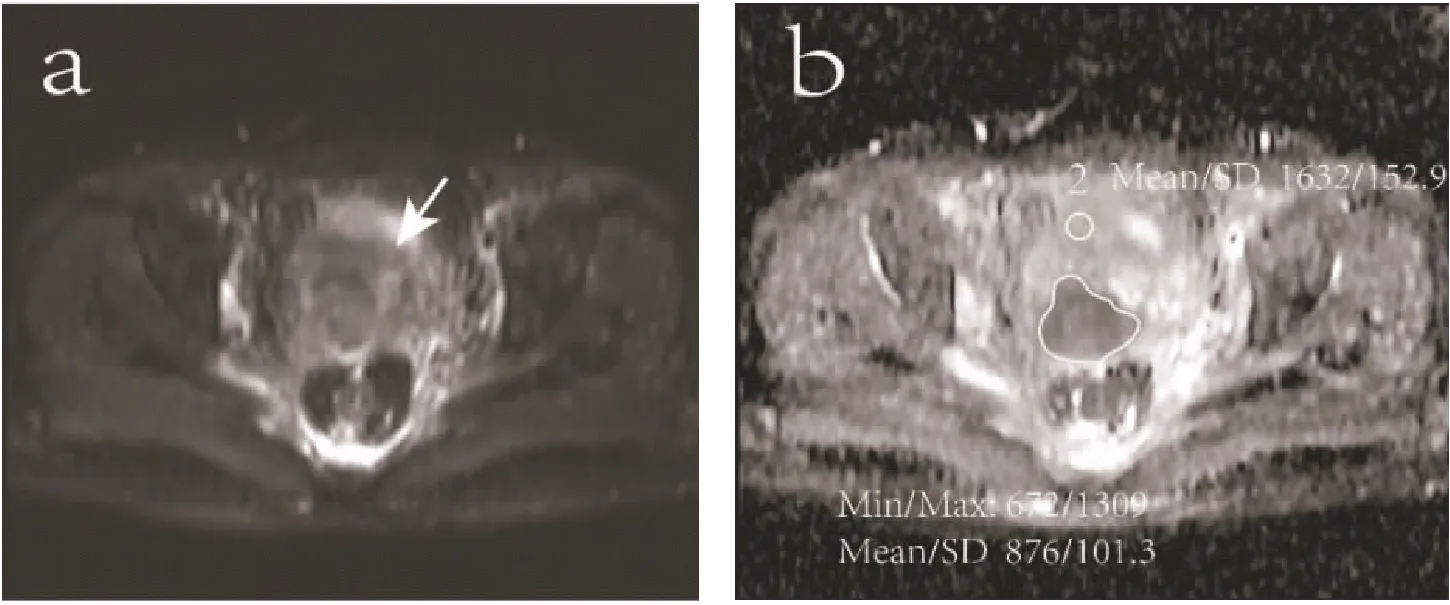
图2 宫颈癌DWI序列及ADC图
Figure 2. DWI Sequence and ADC Diagram of Cervical Cancer
AxialDWIshowingslightlyhighersignalintensity(asindicatedbythearrow) (Panela);ADCmapsshowingthemeasurementofeachADCvalue.Tumor-ADCminvalue,Tumor-ADCmeanvalue,Peritum-ADCvalueandADC-normalizedvalueis0.672×10-3mm2/s,0.876×10-3mm2/s,1.632×10-3mm2/sand2.429,respectively(Panelb).
1.4 临床病理资料收集
收集并记录患者临床病理资料,包括:淋巴管侵犯、年龄、组织类型、肌层侵犯深度、FIGO分期、肿瘤直径、淋巴结转移等。
1.5 统计学处理
使用SPSS 17.0,对宫颈癌LVI阳性与阴性组基线资料[计量资料(年龄),独立样本t检验;计数资料(组织类型、肌层侵犯深度、FIGO分期、肿瘤直径、淋巴结转移),卡方检验]进行差异性检验。通过Kolmogorov-Smirnov法对各ADC值进行正态性分布检验,并采用独立样本t检验比较宫颈癌LVI阳性组与LVI阴性组的差异性;使用MedCalc V15.2软件包,通过受试者工作曲线(receiver operating curve,ROC)评估各ADC值对宫颈癌LVI的诊断效能,计算相应的曲线下面积(area under curve,AUC)以及敏感度、特异度、准确度,并进一步通过非参数检验对不同ROC曲线进行两两比较。以上均以P<0.05表示差异具有统计学意义(双尾)。
2 结 果2.1 基线资料的比较
在81例早期宫颈癌患者中,包括:LVI阳性26例、LVI阴性55例。两组患者年龄、组织类型差异无统计学意义(均P>0.05);肿瘤直径、肌层侵犯深度、FIGO分期、淋巴结转移差异有统计学意义(均P<0.05)(表1)。
2.2 各ADC值的比较
对LVI阳性与阴性早期宫颈癌患者患者各ADC值的比较显示:Tumor-ADCmean值、Peritum-ADC值差异均无统计学意义(均P>0.05),而Tumor-ADCmin值、ADC-normalized值差异有统计学意义(均P<0.05);LVI阳性组Tumor-ADCmin值低于LVI阴性组(t=5.307,P<0.001),分别为[(0.76±0.15)×10-3mm2/svs(0.97±0.18) ×10-3mm2/s];LVI阳性组ADC-normalized值高于LVI阴性组(t=-6.803,P<0.001),分别为[(2.02±0.29)vs(1.53±0.31)](表2)。
表1 LVI阳性与阴性早期宫颈癌患者基线资料的比较
Table 1. Baseline Data of LVI-Positive and LVI-Negative Patients with Early Cervical Cancer

VariableLVI-positive(n=26)LVI-negative(n=55)TestvaluePAge(year)47.5±12.6848.45±10.94t=0.3480.729Histologicaltype Squamouscellcarcinoma20(76.9%)36(65.5%)χ2=1.0880.297 Adenocarcinoma6(23.1%)19(34.5%)Tumordiameter(cm) <410(38.5%)44(80.0%)χ2=13.708P<0.001∗ ≥416(61.5%)11(20.0%)Muscleinvasion <1/28(30.8%)40(72.7%)χ2=12.873P<0.001∗ ≥1/218(69.2%)15(27.3%)FIGOstage Ⅰ12(46.2%)40(72.7%)χ2=5.4240.020∗ Ⅱa14(53.8%)15(27.3%)Lymphnodemetastasis Yes13(50.0%)10(18.2%)χ2=8.7910.003∗ No13(50.0%)45(81.8%)
LVI: lymphovascular invasion; FIGO: International Federation of Gynecology and Obstetrics.
*Indicates the difference in specific statistical significance.
表2 LVI阳性与阴性早期宫颈癌患者各ADC值的比较
Table 2. ADC Values of LVI-Positive and LVI-Negative Patients with Early Cervical Cancer

VariableTumor-ADCmean(×10-3mm2/s)Tumor-ADCmin(×10-3mm2/s)Peritum-ADC(×10-3mm2/s)ADC-normalizedLVI-positive(n=26)1.02±0.160.76±0.151.50±0.232.02±0.29LVI-negative(n=55)1.08±0.170.97±0.181.45±0.181.53±0.31t1.6545.307-1.157-6.803P0.102P<0.001∗0.251P<0.001∗
ADC: apparent diffusion coefficient; LVI: lymphovascular invasion.
*Indicates the difference in specific statistical significance.
2.3 Tumor-ADCmin值与ADC-normalized值诊断早期宫颈癌LVI的诊断效能分析
经ROC曲线分析:取Tumor-ADCmin值=0.88作为诊断阈值时,Tumor-ADCmin值可获最佳诊断效能,诊断早期宫颈癌LVI阳性的AUC为0.833;取ADC-normalized值=1.80作为诊断阈值时,ADC-normalized值可获最佳诊断效能,诊断早期宫颈癌LVI阳性的AUC为0.922。ADC-normalized值诊断效能优于Tumor-ADCmin值(Z=2.202,P=0.028)(图3)。对应的敏感度、特异度以及准确度见表3。

图3 Tumor-ADCmin值与ADC-normalized值诊断早期宫颈癌LVI的ROC曲线分析
Figure 3. ROC Curve Showing Tumor-ADCminValue and ADC-normalized Value in the Diagnosis of Lymphovascular Invasion in Early Cervical Cancer
表3 Tumor-ADCmin值与ADC-normalized值对早期宫颈癌LVI的诊断效能
Table 3. Diagnostic Efficacy of Tumor-ADCminValue and ADC-Normalized Value on Lymphovascular Invasion in Early Cervical Cancer

VariableAUCSensitivitySpecificityAccuracyTumor-ADCminvalue0.83376.90%81.80%80.25%ADC-normalizedvalue0.92288.50%89.09%88.89%
ADC: apparent diffusion coefficient; AUC: area under curve.
3 讨 论
LVI作为宫颈癌不良预后的重要危险因素,尤其是LVI阳性的早期宫颈癌患者,其术后复发率是LVI阴性患者的2.64倍[12]。目前宫颈癌患者的发病年龄存在下降的趋势,年轻早期宫颈癌患者在提高远期预后的同时,还对保留生育能力提出了要求[13];因此,术前对早期宫颈癌患者术后不良预后的有效预测,对患者治疗方案的调整、个体化治疗策略的制定有着重要的价值:当早期宫颈癌患者LVI阴性时,其手术方式选择以保守方案为主,如筋膜外子宫切除术等;而早期宫颈癌患者LVI阳性则应选择根治术、改良根治术或单纯子宫全切加盆腔淋巴结清扫等[14-15]。有鉴于此,本研究旨在通过MR-DWI与早期宫颈癌LVI建立关联性研究,进一步丰富MR对早期宫颈癌的诊断信息。
LVI阳性与阴性组临床病理资料比较显示,LVI阳性早期宫颈癌患者肿瘤直径更大、肌层侵犯深度更大、FIGO分期更高、存在淋巴结转移占比更多,该结果表明:LVI阳性的宫颈癌患者,肿瘤侵袭性更高,具有更强的生物学恶性行为;这也从侧面进一步提示了此类宫颈癌患者术后不良预后的原因。通过对LVI阳性与阴性早期宫颈癌患者各ADC值的比较,结果显示:LVI阳性组Tumor-ADCmin值与Tumor-ADCmean值低于LVI阴性组,而Peritum-ADC值与ADC-normalized值高于LVI阴性组;独立样本t检验显示,Tumor-ADCmin值、ADC-normalized值差异存在统计学意义,而Tumor-ADCmean值与Peritum-ADC值差异均无统计学意义。笔者通过对既往文献的复习[10,16-17]考虑其原因可能在于:① 由于宫颈癌固有的生物学异构性,整个瘤灶的肿瘤细胞呈不均质分布,瘤灶微小粘液、坏死以及间质纤维等不同病理成分可能干扰ADC值结果的真实性;另一方面,由于肿瘤细胞致密性更大、核质比更高,这就造成了水分子扩散受限更加显著,ADC值也就更低,因此Tumor-ADCmin值更能反映肿瘤细胞聚集区域,更能体现肿瘤的恶性程度,这也在一定程度上解释了Tumor-ADCmean值差异无统计学意义的原因。此外,Liu等[10]、张娜等[16]研究指出,Tumor-ADCmin值与宫颈癌的组织病理分级密切相关,Tumor-ADCmin值越低、宫颈癌组织病理级别更高,故存在LVI的可能性更大。类似的,Mori等[17]研究亦表明,乳腺癌LVI阳性的Tumor-ADCmin值低于LVI阴性组,与本研究结果相接近;② 通过计算Peritum-ADC值/Tumor-ADCmin值获取到ADC-normalized值,以ADC-normalized值诊断宫颈癌LVI的诊断效能更优。首先,这是因为ADC值并不是一个绝对的数值,其测量结果可以受到磁共振机型、场强、信噪比、b值以及受检者的基础代谢水平等因素的影响[17-19]。因此,ADC-normalized值作为一种相对数值,能够消除以上混杂因素对ADC值真实性的干扰[17],能够更真实客观反映水分子扩散情况,从而起到标准化的作用,故而对宫颈癌LVI的诊断效能更优。此外,LVI阳性的早期宫颈癌患者,瘤周淋巴组织丰富度更高[12,14-15],由于新生脉管组织的不成熟引起的漏出性水肿、癌栓造成的阻塞性水肿等因素,因此该区域水分子扩散受限程度更不显著,ADC值更大;本研究结果亦显示,LVI阳性组Peritum-ADC值高于阴性组,然而差异不存在统计学意义,这可能是由于本研究ROI放置区域与真实淋巴管癌栓侵犯区域并不一定完全匹配,此外不同生理周期、不同年龄段宫颈组织ADC值亦存在一定的差异[20],造成了LVI阳性与阴性组Peritum-ADC值重叠范围过大,故差异不存在统计学意义。通过公式ADC-normalized值=Peritum-ADC值/Tumor-ADCmin值,可以看出:LVI阳性组分母更大、而分子更小,LVI阴性组分母更小、而分子更大,因此ADC-normalized值在两组之间的差异性更大、可比性更强,其诊断效能也就相应升高。
综上所述,淋巴管侵犯是宫颈癌恶性生物学行为的一种表现,是宫颈癌不良预后的重要危险因素;Tumor-ADCmin值、ADC-normalized值能够有效预测宫颈癌淋巴管侵犯的发生,其中以ADC-normalized值的诊断效能最优,为宫颈癌淋巴管侵犯的判断提供了无创、量化的参考依据。本研究还存在一定的局限性:首先,本研究是一项单中心研究,未能对其他磁共振机型、不同场强以及不同b值情况进行分组分析;其次,本研究未能针对宫颈癌鳞癌与腺癌等不同病理类型进行分组分析;最后,本研究入组的病例数较少,仍有待在后续的研究进一步补足,以获取更为丰富的研究成果。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
- 肿瘤预防与治疗的其它文章
- 基于公共数据库分析脯氨酸羟化酶3在非小细胞肺癌中的表达及预后价值
- 肿瘤体积及瘤体缩减率在同步放化疗的宫颈癌患者预后中的价值*
- 1989~2014年中国胃癌发病率与统计年鉴指标的相关性分析*
- 中性粒细胞/淋巴细胞比值对早期原发乳腺弥漫大B细胞淋巴瘤的临床特征及预后的影响*
- 50例经口腔前庭入路腔镜甲状腺手术临床应用体会*
- Clinical Benefit of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors Plus Radiotherapy for Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small Cell Lung Cancer: A Retrospective Analysis on Real World Data

