肿瘤体积及瘤体缩减率在同步放化疗的宫颈癌患者预后中的价值*
孙畅,路顺,张菡奕,张佳瑜,王苒霖,谭明宇,郎锦义
646000 四川 泸州,西南医科大学 临床医学院(孙畅、张菡奕、王苒霖、郎锦义);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院(路顺、张佳瑜、谭明宇、郎锦义)
宫颈癌以14.3/100,000的发病率位居全球女性常见肿瘤发病率第四位[1],我国大部分首次确诊的宫颈癌患者已是局部晚期[2]。对于2009年国际妇产科联盟(International Federation of Gynecology and Obstetrics, FIGO)分期ⅡA~ⅣA期宫颈癌患者,应用铂类为基础的同步化疗联合外照射(external beam radiotherapy, EBRT)及腔内后装治疗(intracavitary brachytherapy, ICBT)是目前标准的治疗方式[3-4],但局部晚期患者的预后仍不够理想[5]。已有研究报道了局部淋巴结状态、初始肿瘤大小、FIGO分期、年龄、病理学特征等可以作为预测宫颈癌患者同步放化疗(concurrent chemoradiotherapy, CCRT)预后的指标[6]。此外,其他因素包括人乳头瘤病毒、血清鳞状细胞癌抗原(SCC-ag)水平和某些基因的表达也被证明具有评估宫颈癌患者预后的作用[7-9]。然而,这些预后指标大多为治疗初始所测得,并未涉及治疗过程中肿瘤对放疗的反应。众所周知,放疗在宫颈癌的治疗中起着重要作用[10]。因此,肿瘤对放疗的反应可能是影响预后的重要因素。寻找能够反映肿瘤放射敏感性的早期标志物,提供在治疗期间调整治疗策略的机会尤为值得关注[11],例如EBRT后经核磁共振成像(magnetic resonance imaging, MRI)评估的前后瘤体体积差值所占放疗前体积的百分比,即瘤体缩减率(tumor volume reduction rate, TVRR)[12]。本研究回顾性分析217例接受CCRT的局部晚期宫颈癌患者预后与肿瘤大小(tumor size,TS)和肿瘤体积(tumor volume, TV)以及TVRR的关系,进一步确定TS、TV和TVRR在宫颈癌预后评估的价值。
1 材料与方法
1.1 一般资料
回顾性分析2009~2016年我院收治的宫颈癌患者。纳入标准为:(1)所有患者均接受根治性CCRT及高剂量率近距离放射治疗(high dose rate intracavitary brachytherapy, HDR-ICBT);(2)本次入院前均未接受任何抗肿瘤治疗;(3)患者FIGO分期大于Ib期且瘤体最大径大于4 cm;(4)所有患者经病理检查确诊为宫颈鳞状细胞癌;(5)所有患者均在放疗前及EBRT后接受了MRI检查。本研究排除了以下情况的患者:(1)病理确诊有其他肿瘤者;(2)初诊时肿瘤为复发或已转移者;(3)除鳞状细胞癌以外的病理类型者;(4)实体肿瘤在治疗前或后装治疗前难以通过MRI测量者;(5)全程治疗结束前放弃治疗自动出院者;(6)随访资料有缺失者。纳入患者一般资料见表1。
表1 纳入患者一般资料
Table 1.Characteristics of Patient
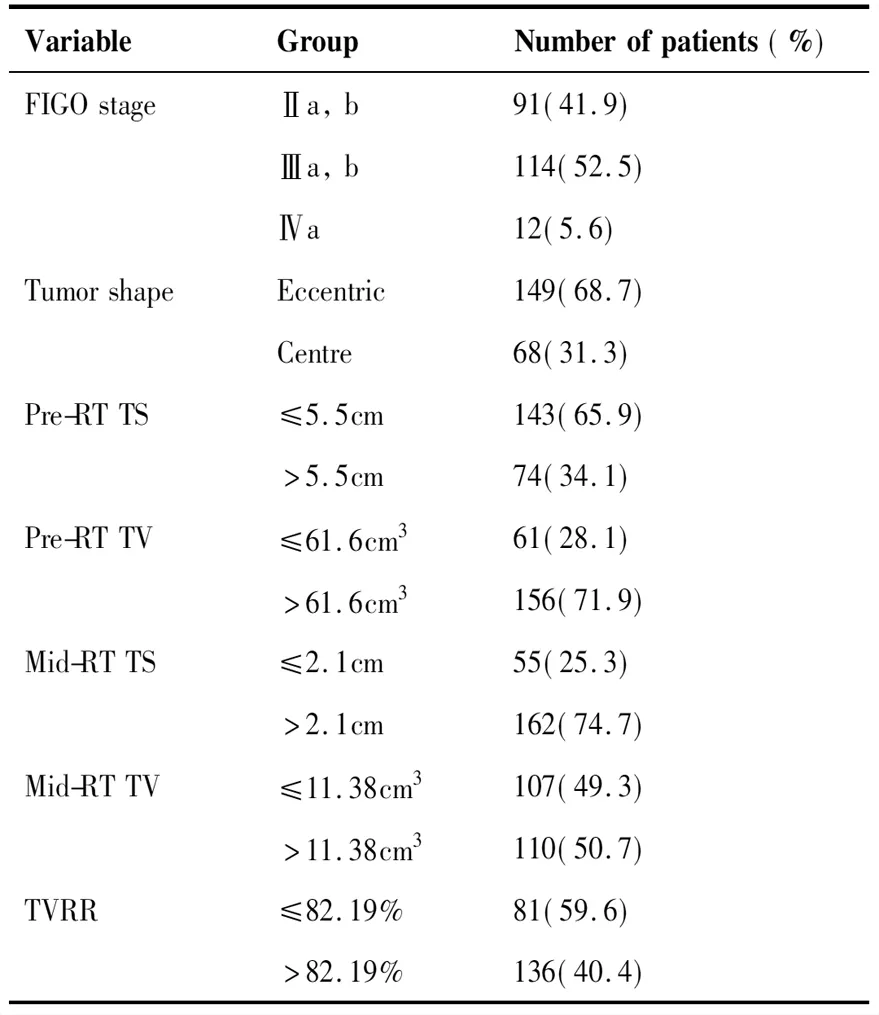
VariableGroupNumberofpatients(%)FIGOstageⅡa,b91(41.9) Ⅲa,b114(52.5) Ⅳa12(5.6)TumorshapeEccentric149(68.7) Centre68(31.3)Pre-RTTS≤5.5cm143(65.9) >5.5cm74(34.1)Pre-RTTV≤61.6cm361(28.1) >61.6cm3156(71.9)Mid-RTTS≤2.1cm55(25.3) >2.1cm162(74.7)Mid-RTTV≤11.38cm3107(49.3) >11.38cm3110(50.7)TVRR≤82.19%81(59.6) >82.19%136(40.4)
FIGO: International Federation of Gynecology and Obstetrics; RT: radiotherapy; TS: tumor size; TV: tumor volume; TVRR: tumor volume reduction rate.
1.2 治疗方法
1.2.1 放疗 所有患者均接受EBRT加ICRT的标准放疗模式。EBRT的方式为适形调强放射治疗(intensity-modulated radiotherapy, IMRT),根据治疗前的MRI及CT图像由靶区勾画系统定义肿瘤靶区,临床靶区(Clinical Target Volume, CTV)和计划靶区。处方剂量平均为45Gy,1.8Gy/次,每周放疗5次。EBRT结束后,所有患者均接受HDR-ICBT,靶区处方剂量HR CTV(high risk clinical target volume) 7Gy/次,IR CTV(intermediate risk clinical target volume) 5~6Gy/次,共4次,每周进行2次。
1.2.2 化疗 在放疗期间所有患者均接受以顺铂为基础的同步化疗方式(具体方案为:顺铂75mg/m2, q3w)。
1.3 肿瘤体积参数测量
所有患者的肿瘤最大径及体积均在治疗前及后装治疗开始前2周内行MRI进行评估。得到放疗前瘤体最大径pre-RT TS及体积pre-RT TV,外照射后瘤体最大径mid-RT TS和体积mid-RT TV,其中肿瘤形状的偏心性及正中生长被定义为瘤体中心是否偏离盆腔的中轴2cm以上[13]。经1.5T或3.0T的核磁扫描后,患者的肿瘤呈现为层高5mm的多张图像。在有效的MRI的图像中,我们定义肿瘤为T2加权的高信号病灶并与周围组织分界清楚。由两位放疗科医师共同确定每张图像中的肿瘤区域面积,最终汇总所有的肿瘤平面面积再乘以5mm的层高,得到实体肿瘤的体积。所有参与的放射肿瘤科医师均遵循RTOG指南进行瘤体勾画[14]。最终每名患者得到两组肿瘤体积的数据:放疗前瘤体体积[pre-RT TV (V1)]和后装治疗前体积[mid-RT TV(V2)]。TVRR被定义为放疗前体积与后装前体积的差值所占放疗前体积的百分比。即:TVRR=(V1-V2)/V1×100%[15]。
1.4 疗效评价及随访
所有患者通过门诊或住院复查、电话随访等方式进行长期随访。治疗结束的前2年每3个月复查一次,第3年时每半年复查一次,而后的随访除开病情变化等情况,每年复查一次。随访内容包括询问病史、妇科检查、液基薄层细胞学检测、大小便常规、肿瘤标志物,影像学检查包括B 超、胸腹盆部CT 或MRI或其他必要的检查。定义治疗失败的模式包括局部复发及远处转移。本研究的观察终点主要包括肿瘤复发、肿瘤转移与患者死亡,统计所有患者总生存期(overall survival, OS)、疾病无进展生存期(progression free survival, PFS)和局部无复发生存期(local failure-free survival, LFFS)。
1.5 统计分析
统计学软件为SPSS 19.0,我们使用t检验比较肿瘤参数在EBRT前后的变化,Kaplan-Meier法用于计算患者OS、PFS及LFFS,预后相关因素,例如年龄,FIGO分期、放疗前和后装前的TS与TV,TVRR等使用log-rank检验行单因素分析,Cox回归法行多因素分析。本研究使用MedCalc 18.2.1软件中受试者工作特征(receive operating characteristic, ROC)分析中计算得出的约登(Youden)指数值,来确定最佳影响肿瘤预后的参数截断点[16]。最后,我们定义P<0.05为差异具有统计学意义。
2 结 果
2.1 患者一般情况
共收集2009~2016年在我院收治的217名经病理确诊为宫颈鳞癌的患者,中位年龄为48岁(29~76岁)。随访的时间截至2018年8月,最终有3例患者失访(截止最后一次随访未出现复发或转移),中位随访时间为51个月(7~111月)。所有患者的中位年龄为48 (29~76)岁。根据2009年版FIGO分期,患者中Ⅱa与Ⅱb期共计91例(41.9%);Ⅲa和Ⅲb期共计114例(52.5%);Ⅳa有12例(5.6%),见表1。在CCRT期间,短期疗效评估(全程治疗结束3个月内)中共207例(95.4%)患者显示完全缓解和9例(4.1%)患者部分缓解,无患者出现疾病进展。
2.2 ROC相关分析
本研究中应用ROC曲线中Youden指数点确定连续肿瘤参数中敏感性与特异性最佳的数据截断点,相应数据结果见表2。
表2 ROC相关参数及截断值
Table 2. ROC Relevant Parameters and Cut-off Values

VariableYoudenindexSensitivitySpecificityCut-offvaluesAUCPAge0.09751.3558.3347year0.5230.674Pre-RTTS0.14345.9568.335.5cm0.5320.574Pre-RTTV0.11737.8473.8961.6cm30.5230.673Mid-RTTS0.07781.0826.672.1cm0.5060.896Mid-RTTV0.43189.1953.8911.38cm30.696<0.001TVRR0.43786.5057.2082.19%0.712<0.001
ROC: receive operating characteristic;AUC: area under curve; RT: radiotherapy; TS: tumor size; TV: tumor volume; TVRR: tumor volume reduction rate.
2.3 失败模式分析
在随访期间,共有31例(14.3%)患者治疗后肿瘤发生进展,其中单纯发生局部复发者13例(6%);单纯发生远处转移者18例(8.7%)[17]。EBRT前后的瘤体参数的范围,均数±标准差及变化见表3。
表3 瘤体参数范围及EBRT前后的变化
Table 3.Range of Tumor Parameters and Changes before and after EBRT

VariableMedianRangeMean±SDtPPre-TS(cm)5.21.6-9.95.39±1.1130.500<0.001Mid-TS(cm)2.80-6.32.88±0.94Pre-TV(cm3)95.93.9-540.0112.27±76.8719.009<0.001Mid-TV(cm3)11.50-99.118.76±19.44TVRR(%)86.716.9-100.081±17
EBRT: external beam radiotherapy; SD: standard deviation; TS: tumor size; TV: tumor volume; TVRR: tumor volume reduction rate.
2.4 生存预后因素分析
所有患者5年总生存率、无进展生存率和局部无复发生存率分别为81.3%、85.1%及92.9%。单因素分析显示肿瘤参数包括:FIGO分期在Ⅲ期及以上 (P=0.015),pre-RT TS>5.5 cm (P=0.050),mid-RT TV>11.38 cm3(P<0.001) 及TVRR≤82.19% (P<0.001),以上均是影响OS的重要不良预后因素(图1);多因素分析提示:其中FIGO分期>Ⅱ 期(P=0.029),pre-RT TV>61.6 cm3(P=0.032)以及mid-RT TV>11.38 cm3(P=0.034)是影响OS的独立不良预后因素,见表4。在PFS相关预后因素分析中未见阳性结果。在LFFS相关的单因素分析中显示TVRR≤82.19%(P=0.050)是LFFS重要的不良预后因素(图2),见表5。
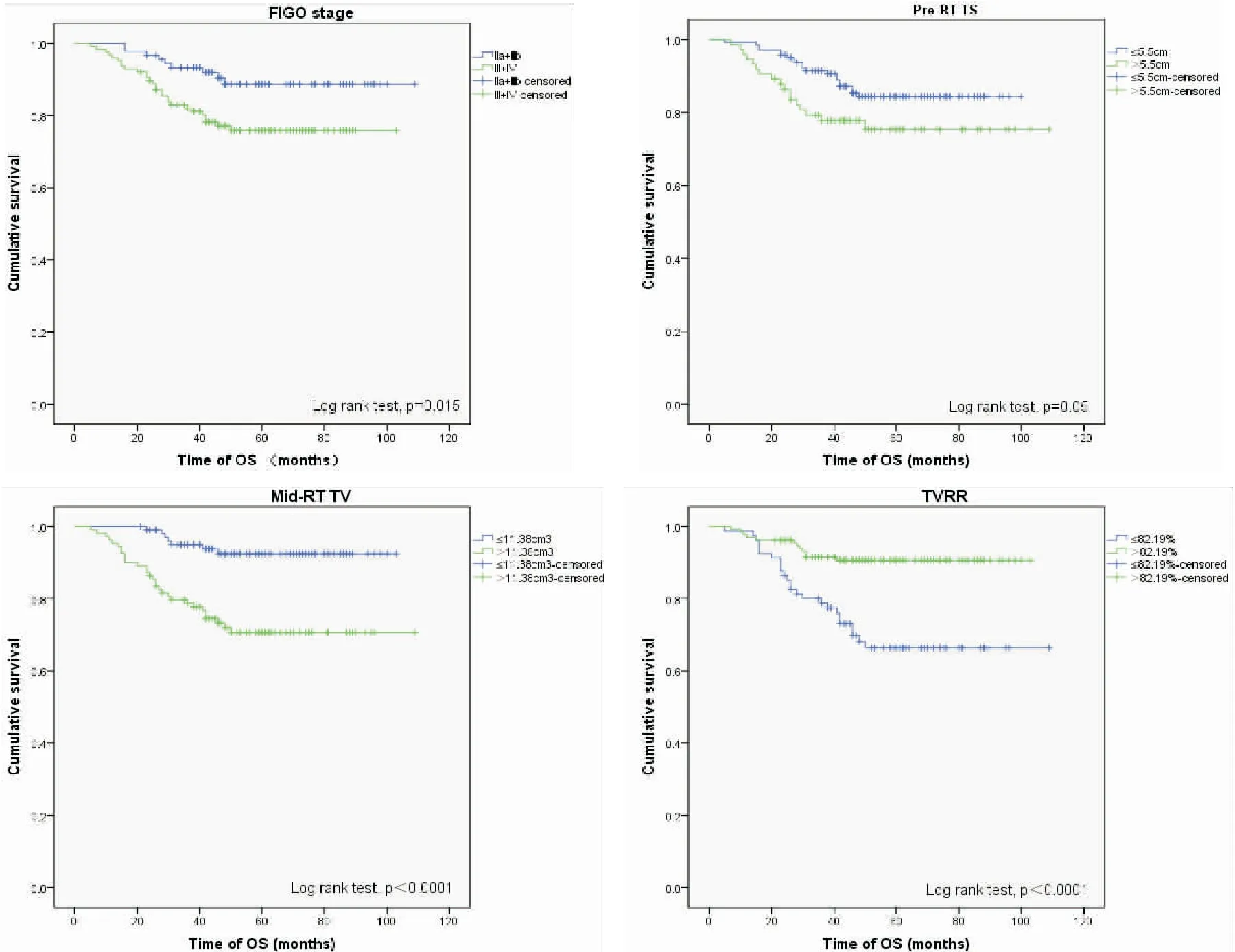
图1 与 OS相关的预后因素
Figure 1. OS-related Prognostic Factors
PanelA:InternationalFederationofGynecologyandObstetricsstage(phaseⅡvsⅢ+Ⅳ);PanelB:maximumdiameteroftumorsbeforeradiotherapy(<5.5cmvs>5.5cm);PanelC:volumeoftumorsafterexternalirradiation(<11.38cm3vs>11.38cm3);PanelD:reductionrateoftumors(<82.19%vs>82.19%).
表4 总生存率相关预后因素分析
Table 4. Prognostic Analysis of Overall Survival
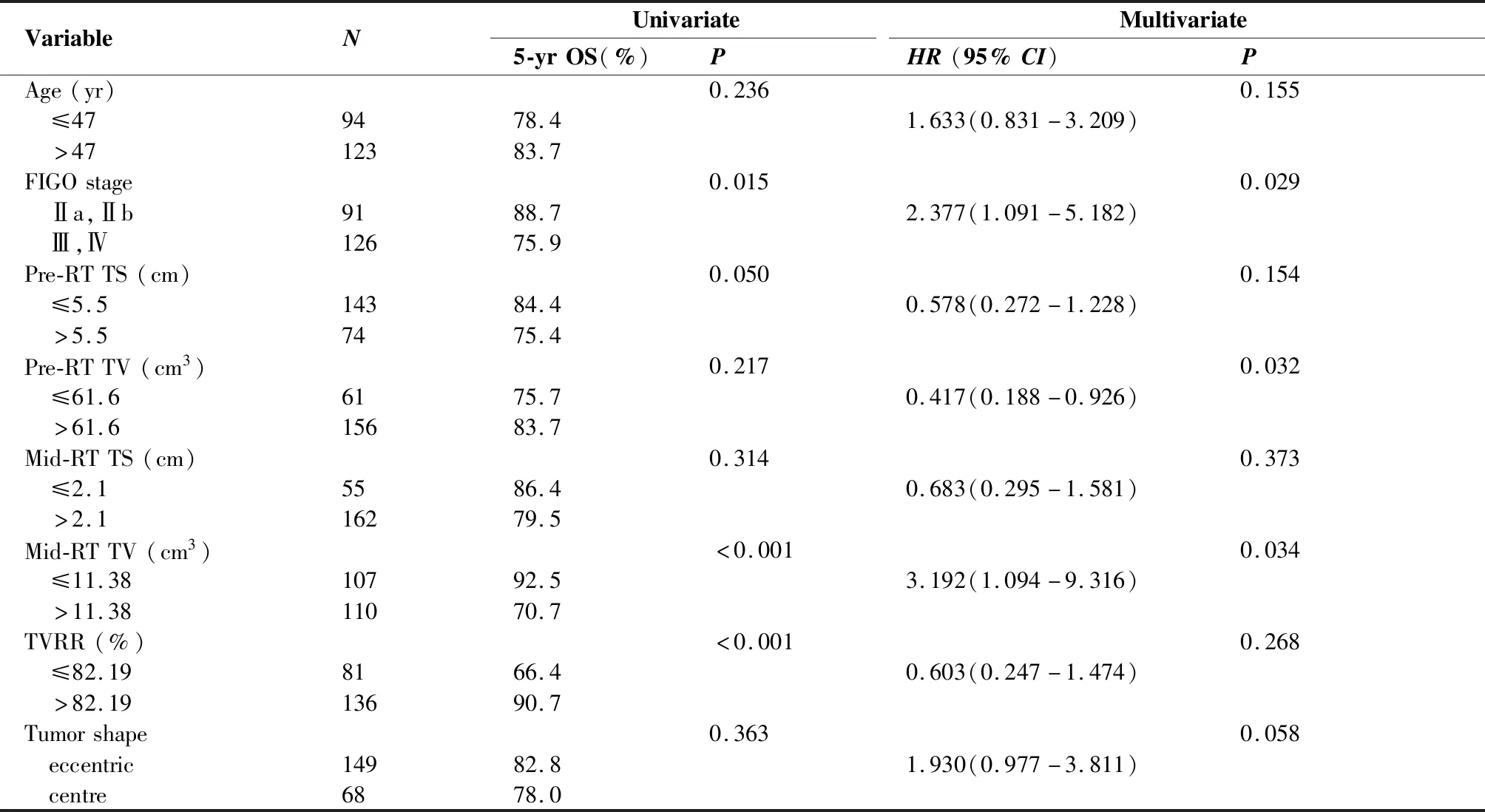
VariableNUnivariateMultivariate5-yrOS(%)PHR(95%CI)PAge(yr)0.2360.155 ≤479478.41.633(0.831-3.209) >4712383.7FIGOstage0.0150.029 Ⅱa,Ⅱb9188.72.377(1.091-5.182) Ⅲ,Ⅳ12675.9Pre-RTTS(cm)0.0500.154 ≤5.514384.40.578(0.272-1.228) >5.57475.4Pre-RTTV(cm3)0.2170.032 ≤61.66175.70.417(0.188-0.926) >61.615683.7Mid-RTTS(cm)0.3140.373 ≤2.15586.40.683(0.295-1.581) >2.116279.5Mid-RTTV(cm3)<0.0010.034 ≤11.3810792.53.192(1.094-9.316) >11.3811070.7TVRR(%)<0.0010.268 ≤82.198166.40.603(0.247-1.474) >82.1913690.7Tumorshape0.3630.058 eccentric14982.81.930(0.977-3.811) centre6878.0
OS: overall survival; HR: Hazard Ratio; CI: confidence interval; FIGO: International Federation of Gynecology and Obstetrics; RT: radiotherapy; TS: tumor size; TV: tumor volume; TVRR: tumor volume reduction rate.
表5 局部无复发生存率相关预后因素分析
Table 5. Prognostic Analysis of Local Failure-free Survival
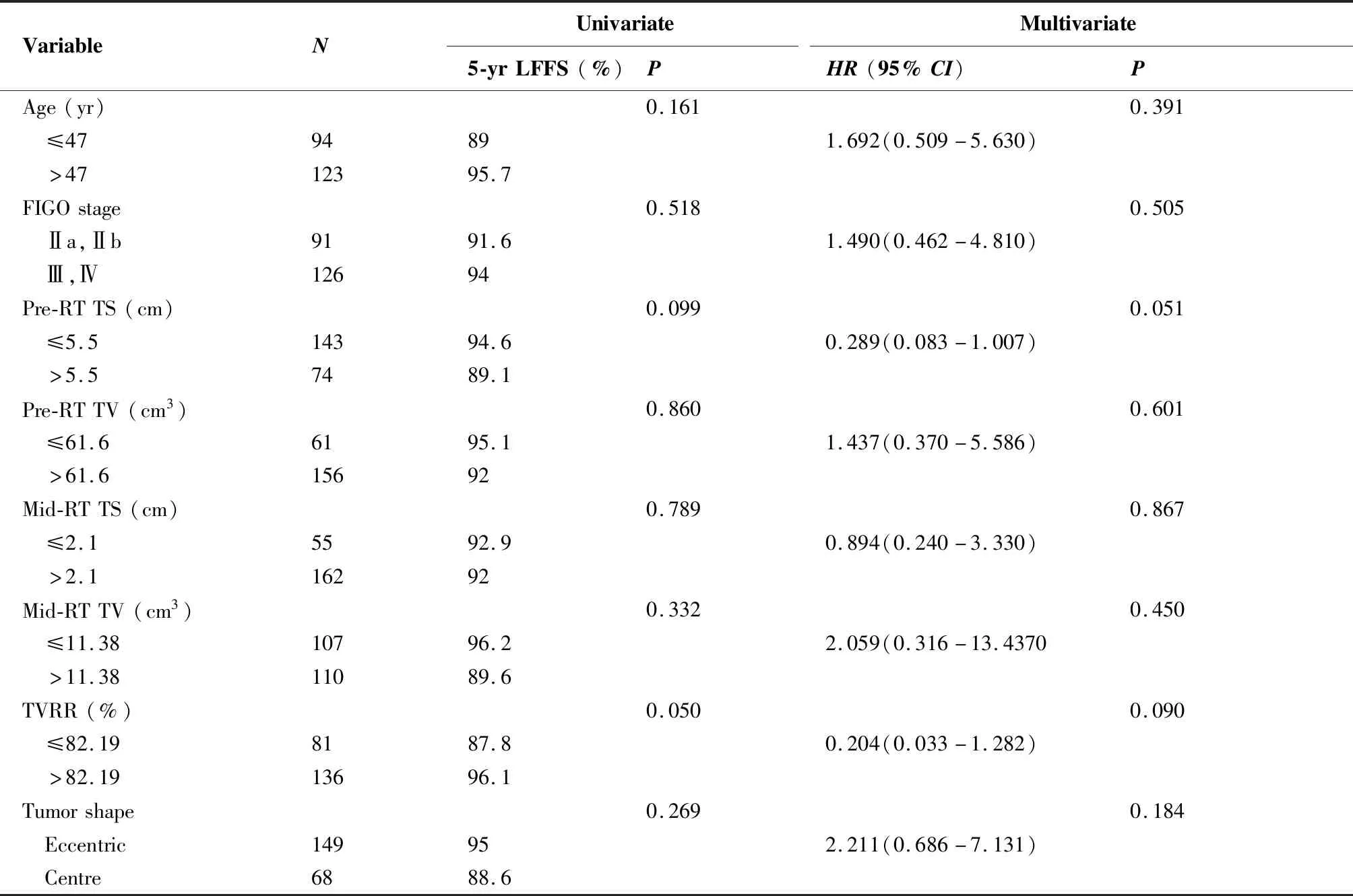
VariableNUnivariateMultivariate5-yrLFFS(%)PHR(95%CI)PAge(yr)0.1610.391 ≤4794891.692(0.509-5.630) >4712395.7FIGOstage0.5180.505 Ⅱa,Ⅱb9191.61.490(0.462-4.810) Ⅲ,Ⅳ12694Pre-RTTS(cm)0.0990.051 ≤5.514394.60.289(0.083-1.007) >5.57489.1Pre-RTTV(cm3)0.8600.601 ≤61.66195.11.437(0.370-5.586) >61.615692Mid-RTTS(cm)0.7890.867 ≤2.15592.90.894(0.240-3.330) >2.116292Mid-RTTV(cm3)0.3320.450 ≤11.3810796.22.059(0.316-13.4370 >11.3811089.6TVRR(%)0.0500.090 ≤82.198187.80.204(0.033-1.282) >82.1913696.1Tumorshape0.2690.184 Eccentric149952.211(0.686-7.131) Centre6888.6
LFFS: local failure-free survival; HR: Hazard Ratio; CI: confidence interval; FIGO: International Federation of Gynecology and Obstetrics; RT: radiotherapy; TS: tumor size; TV: tumor volume; TVRR: tumor volume reduction rate.

图2 LFFS相关预后因素:瘤体缩减率(≤82.19%组vs>82.19%组)
Figure 2. Local Failure-Free Survival-Related Prognostic Factors: Tumor Reduction Rate(<82.19%vs>82.19%)
3 讨 论
在放射治疗技术不断进步的今天,局部晚期宫颈癌患者的预后仍不够理想。已有的研究报道较多局限于将RT前的相关指标用于预测宫颈癌患者预后,如FIGO分期、免疫组化标记物、血液指标等。然而这些指标往往不涉及CCRT过程中肿瘤对治疗的反应,缺乏一定的说服力以及对后续个体化治疗的指导意义。因此,诸如TVRR等能够反映肿瘤放射敏感性的治疗中指标,越来越受到研究者们的重视。同时学者们也设想,根据这些治疗中所获得的预后指标来调整患者的后程治疗策略,以达到个体化精准治疗的目的。但截至目前,因治疗方式不同、人种差异、缺乏大样本实验等原因,国际上对TS、TV、TVRR等瘤体参数在宫颈癌患者的预后中的价值仍未达成统一的共识。
2017年,一项韩国的多中心研究首次报道在宫颈癌患者开始腔内放疗之前所测量的肿瘤参数,包括肿瘤尺寸、瘤体体积、TVRR和SCC-ag水平,对患者的预后评估有重要价值[18]。该研究中患者EBRT采用的是四野盒式照射技术。而在本研究中,我们报道了基于IMRT技术治疗的我国局部晚期宫颈癌患者EBRT前后TZ、TV和TVRR在CCRT期间的预后价值[18],评估了相关预后指标及其对OS,PFS和LFFS的影响,并使用Youden指数来确定连续肿瘤参数的可靠截断值[16]。结果显示,FIGO分期在Ⅱ期以上,放疗前瘤体体积(pre-RT TV)大于61.6cm3与外照射后瘤体体积(mid-RT TV)大于11.38 cm3是影响OS的独立不良预后因素。对于局部晚期宫颈癌患者,我们的研究证明EBRT后TVRR是影响OS和LFFS的重要预后因素。
Lee等[8]曾报道,在后装治疗前,MRI测得的宫颈癌瘤体体积大于3 cm3是影响PFS的独立不良预后因素(P<0.0001)。我们则发现EBRT后mid-RT TV>11.38 cm3(P=0.034)均为OS的独立不良预后。Nam等[15]曾指出宫颈瘤体体积在所有放疗结束1月后大于0 cm3是影响局部控制率的重要不良因素(P<0.01)。另有国内的研究者指出,以肿瘤在放疗前的长径以4 cm或6 cm为截断点时,患者的预后存在差异且具有统计学意义[19]。而本研究中,放疗前瘤体直径pre-RT TS以5.5cm作为截断点后,患者在OS上存在不同,且差异具有统计学意义。韩国研究中[18],I期及Ⅱ期患者为192例(83.1%),Ⅲ期及Ⅳ期为39例(16.9%),而本研究中FIGO分期为Ⅱa、b期的患者91例(41.9%),Ⅲa、b期114例(52.5%),Ⅳa期12例(5.6%)。我们的研究同时验证了FIGO分期大于Ⅱ期为影响OS的重要独立不良预后因素,多因素分析显示局部Ⅲ期及Ⅳ期的宫颈癌患者与更早期患者相比,具有较差的5年总生存率88.7%vs75.9%(HR2.377,95%CI:1.091~5.182;P=0.029)。对比分期比例发现,我们的研究中局部晚期宫颈癌患者的比例明显高于韩国研究。造成这种差异的原因可能是发达国家的宫颈癌预防体系更加健全[20]。目前对于宫颈癌放疗后瘤体长径与体积很难有一个明确的标准来界定预后的分层,而现有研究的结果的差异,可能的原因就包括研究人群的肿瘤分期比例不同,治疗方式的选择及入组患者MRI扫描的间隔时间不同[12]。
而对于EBRT后的TVRR,有学者指出,TVRR等在放疗治疗过程中所测量的指标,可能比其他放疗前或治疗结束后的肿瘤参数更有预后意义[12]。研究者发现[18],TVRR大于87%是影响OS的独立不良预后因素[HR=3.435(1.062~11.106)],而他们在对PFS的单因素分析中也显示TVRR对预后有着重要影响(P<0.001)。本研究统计分析显示TVRR 小于等于82.19%是影响OS与LFFS的重要不良预后因素,对于PFS而言,TVRR小于等于82.19%组与TVRR大于82.19%组的生存率差异不具有统计学意义。值得注意的是,本资料显示的研究结果与该韩国研究的结果接近(87%vs82.19%),这也从另一方面应证了TVRR是影响预后的一项重要参数,尽管本研究中入组患者的治疗方式与之有着差异。而在其他的研究中[21],有学者指出TVRR<75%是显著的不良预后因素,且在放疗过程中越低的瘤体退缩率往往预示着越差的预后。Nam等[15]发现在接受同步放化疗后宫颈癌患者中,外照射结束后的瘤体TVRR≥ 75%的患者有着更长的无病生存期(P=0.04)。更有Lee的研究团队发现[22],在接受根治性放疗的宫颈癌患者中,TVRR小于等于90%是影响PFS的显著不良预后因素。有的研究者也从另一种角度进行研究,Mayr等[12]报道了在放疗剂量达到45~50Gy时,肿瘤残余体积率大于等20%为局部控制和无病生存的重要不良预后因素。我们分析造成不同研究结果差异的可能原因与许多因素有关,包括研究人种的差异、采用的放化疗策略的不同以及对实体瘤体积测量方式的不同等。此外,相较于使用约登指数作为最佳截断点,另有研究人员使用中位数值作为连续的肿瘤参数截止点进行研究[23]。
既往研究发现多个基因,如P73、PXN、IER5等通过介导宫颈癌细胞的分裂、分化及凋亡的过程,参与了对其放疗敏感性的调控,同时研究还发现以上基因的表达水平与宫颈癌患者的预后相关[24-26]。我们发现肿瘤TVRR高的局部晚期宫颈癌患者,预后更优于TVRR低者。宫颈癌患者EBRT后的肿瘤消退情况反映了肿瘤对RT的敏感性[15]。综合既往的研究报道与本研究所得到结果,我们推测TVRR所反映的放射敏感性可能是受一系列遗传基因调控的不同细胞凋亡与再增殖途径所实现的,同时这些基因功能学研究证实和宫颈癌患者的预后关联。因此,基于影像学所评估的人体实际肿瘤体积参数的变化,可能具有指导进一步放疗敏感性相关基础研究的价值。在CCRT的过程中,更早地识别出具有复发或远处转移高风险的宫颈癌患者是十分重要的,因为这可以为早期调整治疗计划或鼓励患者参加临床试验提供更多机会,以此让高危风险的患者享有更多积极的治疗策略。然而,我们的研究也有一些局限性。首先,本研究为回顾性研究,统计分析不能完全避免宫颈癌患者的选择偏倚。其次,样本规模相对较小,缺乏进一步进行分层分析的统计学效果,从而评估这些预后因素的优先程度。第三,我们没有研究与TVRR相关的辐射敏感性的机制。因此,需要更多具有前瞻性或基础性的研究来支持目前的发现。另有学者认为,精确的高危预测模型应是由多变量预测因子组成[27],而目前我们的研究还仅着眼于肿瘤影像学参数的预后价值。未来我们希望引入多中心的前瞻性试验,以进一步验证这些预后因素在同步放化疗的宫颈癌患者中的价值,并为宫颈癌患者早期治疗计划的调整提供依据。
综上所述,我们的研究结果证实TZ、TV、TVRR等肿瘤参数与接受CCRT治疗的局部晚期宫颈癌患者的生存率相关。尤其是EBRT前后的pre-RT TV及mid-RT TV是影响OS的独立预后因素,TVRR是影响OS与LFFS的重要预后因素。未来更需要进一步的多中心和大样本研究,来验证这些肿瘤参数的变化与对生存的影响,并达成相应的共识。我们希望这些预后因素在放疗中的早期评估将有助于在适当的时间调整优化的宫颈癌患者治疗策略。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
- 肿瘤预防与治疗的其它文章
- 基于公共数据库分析脯氨酸羟化酶3在非小细胞肺癌中的表达及预后价值
- 纤维支气管镜技术在肺癌诊断中应用价值的回顾性研究
- ADC值评估早期宫颈癌淋巴管侵犯的价值*
- 中性粒细胞/淋巴细胞比值对早期原发乳腺弥漫大B细胞淋巴瘤的临床特征及预后的影响*
- 1989~2014年中国胃癌发病率与统计年鉴指标的相关性分析*
- Clinical Benefit of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors Plus Radiotherapy for Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small Cell Lung Cancer: A Retrospective Analysis on Real World Data

