中性粒细胞/淋巴细胞比值对早期原发乳腺弥漫大B细胞淋巴瘤的临床特征及预后的影响*
姚宛芝,冯薇臻,欧阳楚桐,彭晓琴,魏雯,任苑蓉,余思思,李仁琴,李力,吴萍,张智慧
646000 四川 泸州,西南医科大学附属医院 肿瘤科(姚宛芝、冯薇臻、欧阳楚桐、张智慧);610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 肿瘤内科(彭晓琴、魏雯、任苑蓉、余思思、李仁琴、李力、吴萍、张智慧)
原发乳腺淋巴瘤(primary breast lymphoma,PBL)是一种罕见的结外淋巴瘤亚型,占所有结外淋巴瘤的2%[1],约占原发乳腺恶性肿瘤的0.5%[2-3]。其中,最常见的类型为弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL),占所有病例的60%~80%[1]。原发乳腺弥漫大B细胞淋巴瘤(primary breast diffuse large B-cell lymphoma,PB-DLBCL)病因可能与性激素有关[2],但具体机制不明确。由于该病发生的部位特殊,易被漏诊及误诊为乳腺癌或其他乳腺良性疾病,目前国内关于PB-DLBCL的研究多为小样本回顾性研究,评估其预后指标多采用DLBCL的预后指标。而临床中,PB-DLBCL患者分期多为早期[3],且IPI评分低[4],这些指标对该类疾病的预后分层不能更好地分析;且IPI评分主要基于临床特征,并不能全面地反映该疾病的生物学活性。近年来,越来越多的研究发现炎症指标与恶性肿瘤的临床特征及预后密切相关[5-11]。目前,已有较多文献报道了NLR高[6, 12-14]与DLBCL的不良预后相关,但尚没有文献报道NLR与PB-DLBCL的关系。本研究主要探究NLR对PB-DLBCL患者的临床特征及预后的影响。
1 材料和方法
1.1 病例资料收集
回顾性收集2005年9月至2015年9月期间于我院就诊,且病理学确诊为PB-DLBCL的患者的完整临床资料。所有患者治疗前均通过CT、MRI、PET/CT等1项或多项影像学检查及骨髓检查评估淋巴瘤全身受侵范围,分期均采用Ann Arbor系统,其中IE期23例,ⅡE期22例。收集完整的临床资料,包括:Hans分型、年龄、性别、分期、乳酸脱氢酶水平(lactate dehydrogenase, LDH)、体力状况(ECOG评分)、肿瘤侵犯部位、中性粒细胞、淋巴细胞(为初诊时自动化全血细胞计数获得)等。本研究获得我院伦理委员会的批准。
1.2 治疗情况
45例患者均接受CHOP或CHOP类方案[15]化疗3~8周期。其中,31例(68.9%)患者接受联合利妥昔单抗(Rituximab)治疗[16];14例(31.1%)于第2周期或所有疗程化疗结束后接受甲氨蝶呤或/和阿糖胞苷预防性鞘内化疗(intrathecal chemotherapy, IT)2~4个疗程;12例化疗结束后行受累侧乳房局部放疗(radiation therapy, RT)30~50Gy。具体包括:单纯化疗7例(15.6%)、单纯化疗联合IT 1例(2.2%)、单纯化疗联合RT 6例(13.3%)、单纯联合Rituximab 12例(26.7%)、联合Rituximab+IT 13例(28.9%)、联合Rituximab+RT 6例(13.3%)。
1.3 评价
根据国际淋巴瘤疗效评价标准[17]疗效评价,分为完全缓解(complete response, CR)、部分缓解、疾病稳定、疾病进展。总生存期(overall survival, OS)及无进展生存期(progression free survival, PFS)评价预后生存情况,OS定义为从疾病确诊时间到任何原因引起的死亡或末次随访时间间隔。PFS定义为从疾病确诊时间至疾病复发或(因任何原因)死亡之间的时间。
1.4 随访
所有患者治疗结束后1年内每3个月随访1次,第2年每6个月1次,之后每年1次[18]。发现可疑症状及体征则随时复诊。复查内容包括:浅表淋巴结触诊、CT、MRI、PET/CT等。随访截止日期为2018年10月31日,45例患者全部随访,无失访。
1.5 统计学分析
应用SPSS 22.0系统软件进行数据分析,采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)获取NLR的最佳截断值。采用卡方检验进行组间比较,单因素应用Kaplan-Meier法进行生存分析,采用Log-rank检验进行比较,多因素分析采用Cox回归模型,P≤0.05为差异有统计学意义。
2 结 果
2.1 临床特征
45例PB-DLBCL患者中位发病年龄45岁(28岁~77岁);年龄>60岁的患者9例(20%);44例女性,仅1例男性。病变部位:右侧乳腺29例(64.4%),左侧乳腺16例(35.6%)。伴有B组症状的患者5例(11.1%)。Hans分型:生化中心B细胞型(germinal center B cell type, GCB)10例(22.2%),非生化中心B细胞型(non-germinal center B cell type, non-GCB)35例(77.8%)。Ann Arbor分期系统:IE期23例(51.1%),ⅡE期22例(48.9%)。
2.2 NLR cut-off值
NLR的ROC曲线如图1,通过ROC曲线获得最具差异性的NLR cut-off值3.21,敏感性是0.7,特异性0.72。AUC值0.717,95%置信区间为0.566~0.868,P=0.013。
2.3 NLR与临床特征之间的关系
低NLR组(NLR≤3.211)24例,高NLR组(NLR>3.211)21例。NLR值与Hans分型、病变部位、IPI评分有相关性(P<0.05),与性别、年龄、B症状、分期、LDH值无相关性(P>0.05)(表1)。

图1 诊断时NLR的受试者工作特征曲线(ROC)和曲线下面积(AUC)
Figure 1.Receiver Operating Characteristic Curve (ROC) and Area Under the Curve (AUC) for NLR at Diagnosis
(AUC=0.717,P=0.013;70.0%sensitivityand72.0%specificity)
表1 NLR与临床特征的关系
Table 1. Relationship between NLR and Clinical Features

ClinicalcharacteristicsNLRNLR>3.211(n)NLR≤3.211(n)PHanstypingGCB370.020non-GCB1817SexMale01Famle2123Age(y)≤6016200.103>6054BsymptomsNo20200.673Yes14StageIE6170.221IIE157LDH(U/L)≤24014170.137>24077SiteoflesionRight15140.015Left610IPIscore<219220.002≥222
NLR: neutrophil to lymphocyte ratio; GCB:germinal center B-cell type; Non-GCB: non-germinal center B-cell type; LDH: lactate dehydrogenase.
2.4 生存分析
2.4.1 全组患者PFS及OS 45例PB-DLBCL患者中位随访97个月,截止随访日期中位无进展生存期未达到(图2),中位总生存期38个月(12~78个月),3年OS为68.9%(图3);中枢神经系统(central nervous system, CNS)复发3例(6.67%)。

图2 PB-DLBCL患者的PFS
Figure 2. PFS of PB-DLBCL Patients

图3 PB-DLBCL患者的OS
Figure 3. OS of PB-DLBCL Patients
2.4.2 NLR对PFS及OS的影响 NLR>3.211组PB-DLBCL患者的3-PFS率(图4)及3-OS率(图5)明显低于NLR≤3.211组,差异有统计学意义(P<0.05)(表2)。
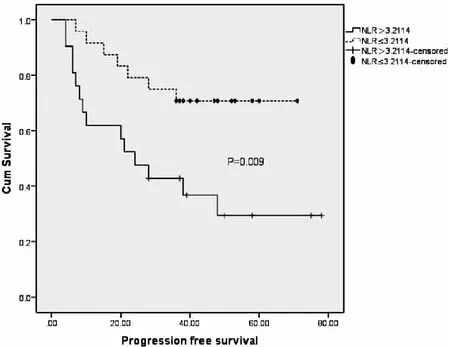
图4 通过NLR截断值分层的PFS Kaplan-Meier曲线
Figure 4. Kaplan-Meier Curves of PFS Stratified by NLR Cutoff
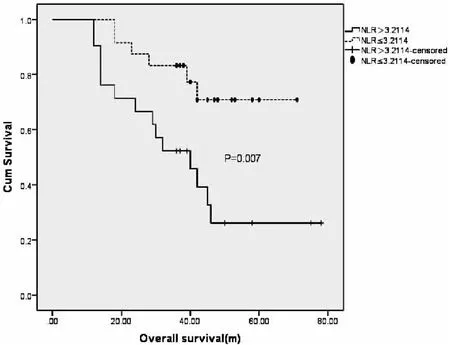
图5 通过NLR截断值分层的OS Kaplan-Meier曲线
Figure 5. Kaplan-Meier Curves of OS Stratified by NLR Cutoff
表2 NLR对PB-DLBCL患者预后的影响
Table 2. Effect of NLR on the Prognosis of Patients with PB-DLBCL
NLR: neutrophil to lymphocyte ratio; PB-DLBCL:primary breast diffuse large B-cell lymphoma;PFS:progression free survival;OS:overall survival.
2.5 预后分析
在单因素分析中,影响PB-DLBCL患者OS的预后因素,除了上述所说NLR以外,还包括:Hans分型、分期、ECOG评分、IPI评分及预防性鞘内化疗,差异有统计学意义(表3)。在多因素分析中,ECOG评分、IPI评分、NLR与预防性鞘内化疗是影响PB-DLBCL预后的独立因素(表4)。
表3 影响OS的单因素分析
Table 3. Univariate Analysis of OS

CharacteristicN3-OS(%)χ2PCharacteristicN3-OS(%)χ2PHanstyping0.011Gender〛0.387 GCB101006.43 Male11000.749 Non-GCB3560 Famale4468.2
(Table 3 continues on next page)
(continued from previous page)
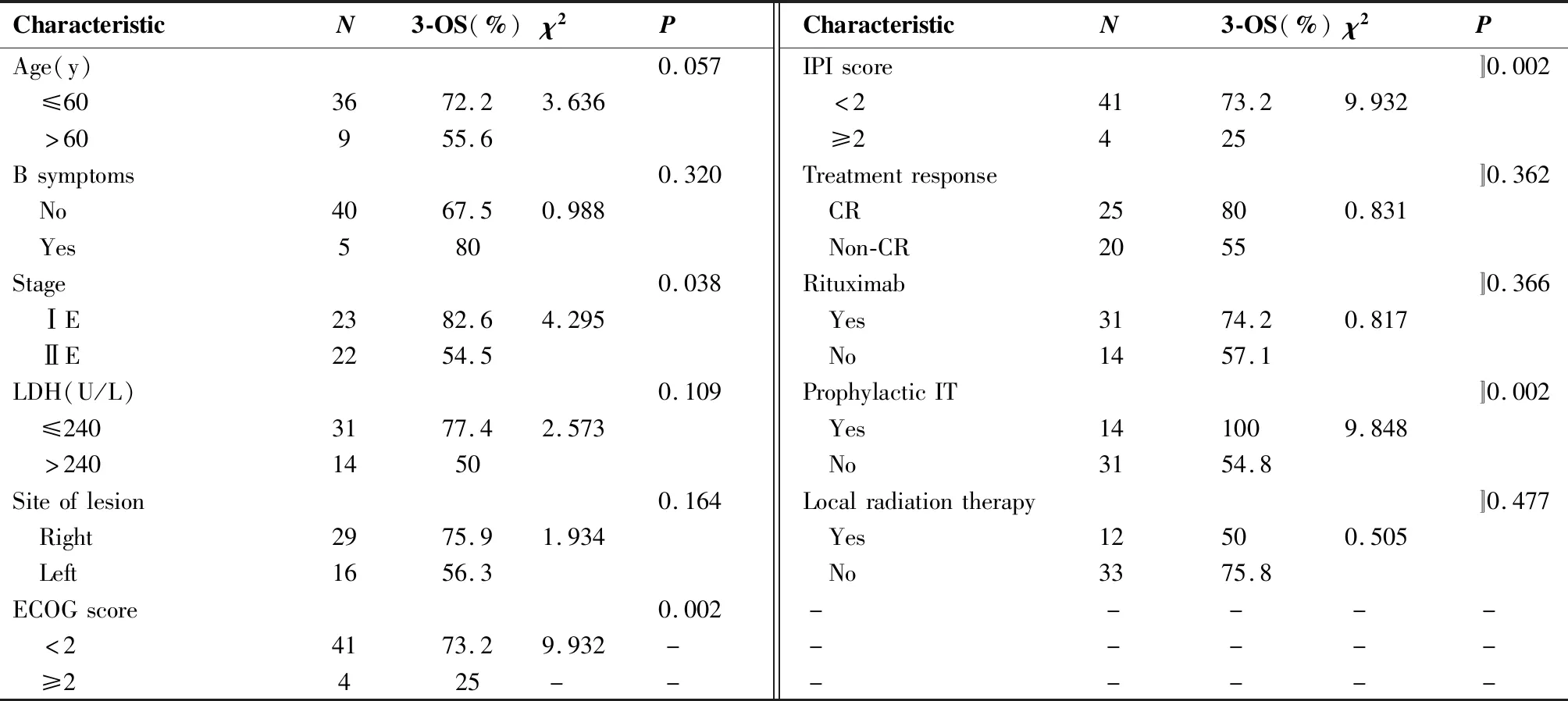
CharacteristicN3-OS(%)χ2PCharacteristicN3-OS(%)χ2PAge(y)0.057IPIscore〛0.002 ≤603672.23.636 <24173.29.932 >60955.6 ≥2425Bsymptoms0.320Treatmentresponse〛0.362 No4067.50.988 CR25800.831 Yes580 Non-CR2055Stage0.038Rituximab〛0.366 ⅠE2382.64.295 Yes3174.20.817 ⅡE2254.5 No1457.1LDH(U/L)0.109ProphylacticIT〛0.002 ≤2403177.42.573 Yes141009.848 >2401450 No3154.8Siteoflesion0.164Localradiationtherapy〛0.477 Right2975.91.934 Yes12500.505 Left1656.3 No3375.8ECOGscore0.002----- <24173.29.932------ ≥2425-------
OS:overall survival;GCB:germinal center B-cell type;LDH:lactate dehydrogenase;ECOG:Eastern Cooperative Oncology Group;IPI:International prognostic index;CR:complete response;IT:intrathecal chemotherapy.
表4 影响OS的多因素分析
Table 4. Multivariate Analysis of OS

VariableβSEWaldχ2POR95.0%CIforORLowerUpperNLR1.4370.6634.6990.0304.2101.14815.442ECOG-1.9710.9084.7080.0300.1390.0230.826IPI-1.9710.9084.7080.0300.1390.0230.826Hanstyping-12.739257.3750.0020.961<0.001<0.001<0.001Stage0.5290.6540.6540.4191.6970.4716.113Age0.6770.6521.0810.2991.9690.5497.060LDH0.4620.5730.6500.4201.5870.5164.877ProphylacticIT2.5031.0905.2740.02212.2221.443103.517
OS:overall survival;NLR: neutrophil to lymphocyte ratio; ECOG:Eastern Cooperative Oncology Group;IPI:International prognostic index;LDH:lactate dehydrogenase; IT:intrathecal chemotherapy.
3 讨 论
PB-DLBCL是一种少见的原发性乳腺肿瘤,仅占乳腺恶性肿瘤的0.5%[2-3]。1972年,Wiseman 等[19]提出关于PBL的诊断标准,但并没完全阐述淋巴瘤的生物学行为及预后的差异。之后,Yhim等[20]发现按结外受累器官数数目分类可以反映生存差异,又对PBL的诊断标准进一步完善。该病多见于中老年女性[21],男性罕见;临床表现无特异性,常以乳腺包块为首发症状,好发于右侧乳腺[21-22]、外上象限[23]。本组资料中,PB-DLBCL多见于中老年女性,右侧乳腺发病较多见,与文献报道相一致。按Ann Arbor临床分期标准,ⅠE期占70%~75%[1,24],ⅡE期约占30%[25],ⅣE期双侧乳腺受累少见(目前关于双侧乳腺同时受累分期尚有争议,因其较单侧乳腺受累侵袭性更强,预后更差,考虑分期为ⅣE 期[2,26])。虽然绝大部分患者分期早[27],但该病属于侵袭性淋巴瘤,恶性程度高,故预后差于结内DLBCL[27-28]。有文献报道[26],PB-DLBCL患者的5年OS为77.3%,且易出现对侧乳腺、CNS以及其他结外器官复发[29],尤其是CNS[30],其复发率高达11.5%[31]。本组资料中,PB-DLBCL患者3年OS为68.9%,CNS复发率为6.67%,低于文献报道,可能与本组资料病例数较少且随访年限短相关。
由于PB-DLBCL发病率低,目前与之相关的预后因素报道较少。2013年,林桐榆等[27]提出影响PBL的不良预后因素,包括:IPI中低评分、中高病理分级、肿瘤直径>5cm、其他结外器官受累、血清可溶性IL-2>1 000kU/L等[27,32]。随后,国外Aviv 等[2]就提出了关于PB-DLBCL不良预后的临床指标,包括:Ann-Arbor分期>IE期,体能状态不佳,LDH升高,肿瘤大小大于4~5cm,并可用这些特征行风险分组。但由于该病发病时分期早[27],病灶局限,患者机体体能状态评分较低,有学者提出将累及双侧乳腺及分期调整的IPI评分>2分作为评价疾病预后指标[30]。另外,有研究发现,Hans分型[33-34]也是影响该类患者预后的指标之一。病理分型中以non-GCB多见[33-34],部分学者认为non-GCB型与PB-DLBCL不良预后相关[34]。但也有部分学者[31]发现,non-GCB型与患者OS无关,而与较差的PFS有关。在本组资料中,分期、Hans分型、ECOG评分、IPI评分与PB-DLBCL的预后相关,而多因素分析显示只有ECOG评分、IPI评分是临床参数中影响PB-DLBCL预后的独立因素,这可能与本组资料病例少相关。
除上述的指标外,在多项临床研究中也发现高NLR与肿瘤预后不良相关[5,9,35-37],也有文献报道治疗过程动态监测NLR,升高也提示预后不良[38]。有研究发现,在肿瘤微环境中,肿瘤细胞会分泌多种细胞因子及趋化因子,这些细胞因子吸引更多中性粒细胞等炎症细胞聚集到肿瘤细胞附近[38],受到刺激的中性粒细胞能分泌细胞因子、趋化因子等,为肿瘤细胞的生长、浸润及转移创造有利条件[35-36,39]。这可能与中性粒细胞上N2表型[40]表达所致趋化因子受体CXCR4、VEGF和明胶酶B/MMP 9的高表达有关[41]。而淋巴细胞是人体免疫系统的重要组成部分,机体有赖于它对肿瘤细胞进行监视及清除[42]。在相关临床研究发现外周血中淋巴细胞减少是DLBCL复发的危险因素[43],这可能与肿瘤细胞从肿瘤浸润淋巴细胞(TILs)的免疫逃逸有关[44]。由此可推断高NLR与肿瘤预后不良密切相关。近期一项关于DLBCL的Meta分析报告发现,各个样本所得NLR值不同(Cut-off值在2.11~5.54间),但均与年龄、Ann Arbor分期、B组症状、骨髓受累、LDH水平升高等因素有关[37]。说明NLR值虽然不固定,但与疾病的临床参数却有关联性。本组资料NLR值为3.211,与Hans分型、病变部位、IPI评分有相关性(P≤0.05)。
目前关于原发乳腺淋巴瘤的最佳治疗方案尚无共识,但手术治疗不作为PBL的推荐。多研究发现乳房切除术并不能降低该类疾病进展及复发的风险,甚至会导致疾病不良的肿瘤特异性生存率[27,44]。另外,回顾性研究亦发现腋窝淋巴结清扫术并无长期获益[27]。除此之外,治疗方案中是否联用利妥昔单抗[4]、是否加用RT[4,45]以及是否预防性鞘内化疗[26]也与患者预后相关。但大部分研究都是小样本研究,尚无明确定论。在本组资料的治疗方案相关生存分析中,预防性IT是影响PB-DLBCL患者预后的独立因素(P<0.05),而接受利妥昔单抗靶向治疗及局部RT的患者生存并无获益(P>0.05)。
总之,NLR可能成为预测PB-DLBCL预后的重要指标,目前国内尚无相关报道。由于本研究是一项回顾性研究,且研究的病例数少且随访年限短,所以研究结果还存在一定的缺陷及偏差,还需要大样本及多中心的前瞻性数据来进一步探讨。
作者声明:本文第一作者对于研究和撰写的论文出现的不端行为承担相应责任;
利益冲突:本文全部作者均认同文章无相关利益冲突;
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统学术不端检测;
同行评议:经同行专家双盲外审,达到刊发要求。
- 肿瘤预防与治疗的其它文章
- ADC值评估早期宫颈癌淋巴管侵犯的价值*
- 肿瘤体积及瘤体缩减率在同步放化疗的宫颈癌患者预后中的价值*
- 1989~2014年中国胃癌发病率与统计年鉴指标的相关性分析*
- 基于公共数据库分析脯氨酸羟化酶3在非小细胞肺癌中的表达及预后价值
- 50例经口腔前庭入路腔镜甲状腺手术临床应用体会*
- Clinical Benefit of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors Plus Radiotherapy for Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small Cell Lung Cancer: A Retrospective Analysis on Real World Data

