基于Nrf-2/OH-1/NF-κB通路探讨葡萄籽原花青素对大鼠酒精性肝损伤的保护作用*
余维微 曾耀明 郑伟伟 陈余圣
(浙江省温州市中医院,浙江 温州 325000)
目前,肝性疾病呈逐年上升趋势,严重危害人类健康。长期大量饮酒易引发酒精性肝炎。酒精性肝病严重危害公共卫生,人们越来越重视对肝脏的保护。葡萄籽原花青素是从葡萄籽中提取的生物类黄酮物质,溶解性好且易于吸收。研究发现,葡萄籽原花青素具有较强抗氧化性,能够缓解肝功能障碍,提高机体免疫等功能[1-3]。已有研究报道葡萄籽原花青素能减轻CCl4和酒精引起的小鼠肝损伤[4],但有关葡萄籽原花青素改善酒精性肝损伤的作用机制研究还较少。本研究通过建立酒精性肝损伤大鼠模型,研究葡萄籽原花青素对酒精性大鼠肝损伤的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠72只,清洁级,体质量160~230 g,购自南京君科生物工程有限公司,合格证号:SCXK(沪)2016-0016。本研究经动物伦理委员会批准。
1.2 试药与仪器 葡萄籽原花青素购自西安天丰生物科技有限公司。丙二醛(MDA)、超氧化物歧化酶(SOD)、还原谷胱甘肽(GSH)、谷胱甘肽过氧化物酶(GSH-Pr)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)和白细胞介素-6(IL-6)试剂盒均购自南京建成生物工程研究所。核因子E2相关因子(Nrf2)、血红素加氧酶(OH-1)、催化亚基(GCLC)抗体均购自Cell Signaling Technology (Danvers,USA) 公司, 稀释度1∶100。 核转录因子-κB p65(NF-κB p65)和 Iκ-Bα 抗体购自Santa Cruz公司,稀释度1∶100。RIPA裂解液、蛋白酶抑制剂(PMSF)、BCA蛋白测定试剂盒、电泳上样缓冲液、PVDF膜、ECL显色液等Western blotting相关试剂均购自上海碧云天生物技术有限公司。AU5800全自动生化分析仪购自美国贝克曼公司。
1.3 分组及给药 大鼠适应性饲养1周后,随机分为空白对照组、模型组、阳性对照组及葡萄籽原花青素低、中、高剂量组。除空白对照组外其他各组大鼠按剂量10 mL/kg灌胃红星二锅头(56%乙醇),连续灌胃10周,空白对照组灌胃等量0.9%氯化钠注射液。大鼠造模的同时给药治疗,阳性对照组按200 mg/(kg·d)剂量灌胃联苯双酯;葡萄籽原花青素低、中、高剂量组按100、200、400 mg/(kg·d)剂量灌胃葡萄籽原花青素;空白对照组和模型组灌胃等量0.9%氯化钠注射液。给药剂量参考文献[5]和预实验确定。各组均常规饮水和喂食。
1.4 标本采集与检测 1)末次给药后禁食不禁水12 h后,眼眶取血,离心(3 000 r/min,15 min)。 取上清液,全自动生化分析仪检测定谷丙转氨酶(ALT)和谷草转氨酶(GOT)含量。2)大鼠处死后迅速解剖取出肝脏,10%中性甲醛固定,制备石蜡包块,切片,HE染色,显微镜下观察肝脏病理改变。3)取大鼠肝脏组织,用预冷0.9%氯化钠注射液制成10%肝组织匀浆,采用ELISA法分别根据试剂盒说明检测肝组织中MDA、GSH、SOD、GSH-Pr以及 TNF-α、IL-1β 和 NF-κB 水平。 4)取大鼠肝脏组织,加入裂解液在冰上充分裂解30 min,离心(4 ℃,12 000×g,15 min)。 取上清液,BCA 法测定蛋白浓度。取适量蛋白样品加上样缓冲液,100℃煮沸5 min。进行SDS-PAGE,电泳后凝胶蛋白电转移至PVDF膜,5%脱脂奶粉室温封闭2 h。TBST清洗后,加入一抗,4℃过夜。TBST清洗后加入二抗,室温下放置2 h。TBST清洗后ECL显色,于凝胶成像系统曝光显影。扫描拍照,用Image pro plus 7.0软件分析蛋白杂交条带灰度值,以β-actin为内参,以各蛋白与内参灰度值的比值表示其在肝脏组织中的相对表达量。
1.5 统计学处理 应用SPSS21.0统计软件。计量资料以(±s)表示,采用t检验;计数资料用n表示,采用χ2检验。P<0.05为差异具有统计学意义。
2 结 果
2.1 各组大鼠肝脏组织病理学观察 见图1。空白对照组大鼠肝细胞形态正常,无炎性细胞浸润,以中央静脉为中心周围肝细胞索呈放射状排列。模型组大鼠肝脏出现肝细胞坏死,炎性细胞浸润,肝细胞索消失。与模型组相比,葡萄籽原花青素各剂量组和阳性对照组大鼠肝脏组织坏死不同程度减轻,炎性细胞浸润减少。

图1 各组大鼠肝脏组织病理学观察(HE染色,200倍)
2.2 各组大鼠血清ALT和GOT水平比较 见表1。与空白对照组相比,模型组ALT和GOT水平显著升高(P<0.05)。与模型组相比,葡萄籽原花青素低、中、高剂量组和阳性对照组ALT和GOT水平显著降低(P<0.05)。
表1 各组大鼠血清ALT和GOT水平比较(U/L,±s)
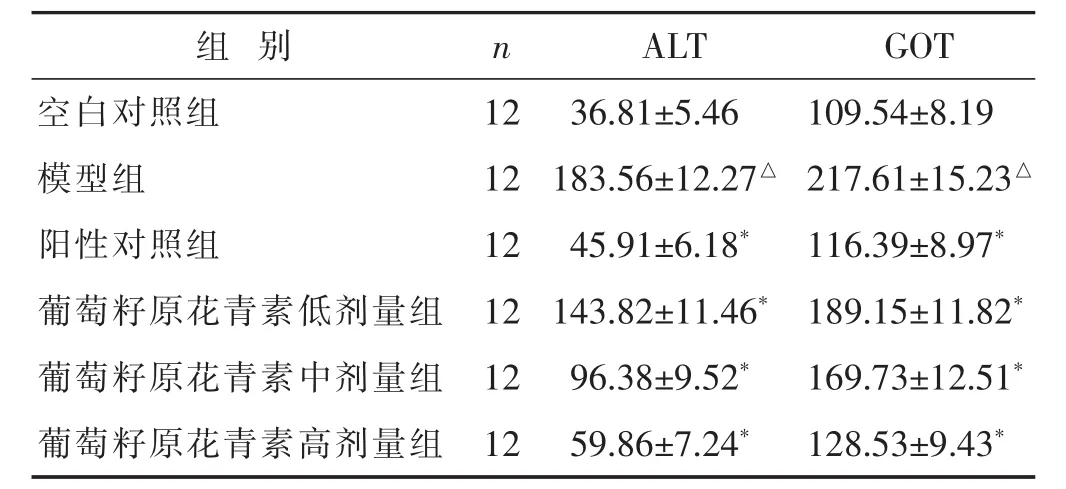
表1 各组大鼠血清ALT和GOT水平比较(U/L,±s)
与模型组比较,*P<0.05;与空白对照组比较,△P<0.05。下同
组 别 n ALT GOT空白对照组 12 36.81±5.46 109.54±8.19模型组 12 183.56±12.27△ 217.61±15.23△阳性对照组 12 45.91±6.18* 116.39±8.97*葡萄籽原花青素低剂量组 12 143.82±11.46* 189.15±11.82*葡萄籽原花青素中剂量组 12 96.38±9.52* 169.73±12.51*葡萄籽原花青素高剂量组 12 59.86±7.24* 128.53±9.43*
2.3 各组大鼠肝组织中 MDA、GSH含量与 SOD、GSH-Pr活力比较 见表2。与空白对照组相比,模型组MDA含量显著升高 (P<0.05),GSH含量与SOD、GSH-Pr活力显著降低(P<0.05)。与模型组比较,葡萄籽原花青素低剂量组SOD活力显著升高(P<0.05),葡萄籽原花青素中、高剂量组和阳性对照组MDA含量显著降低(P<0.05),GSH 含量与、GSH-Pr活力显著升高(P<0.05)。
表2 各组大鼠肝组织中MDA、GSH含量与SOD、GSH-Pr活力比较(±s)
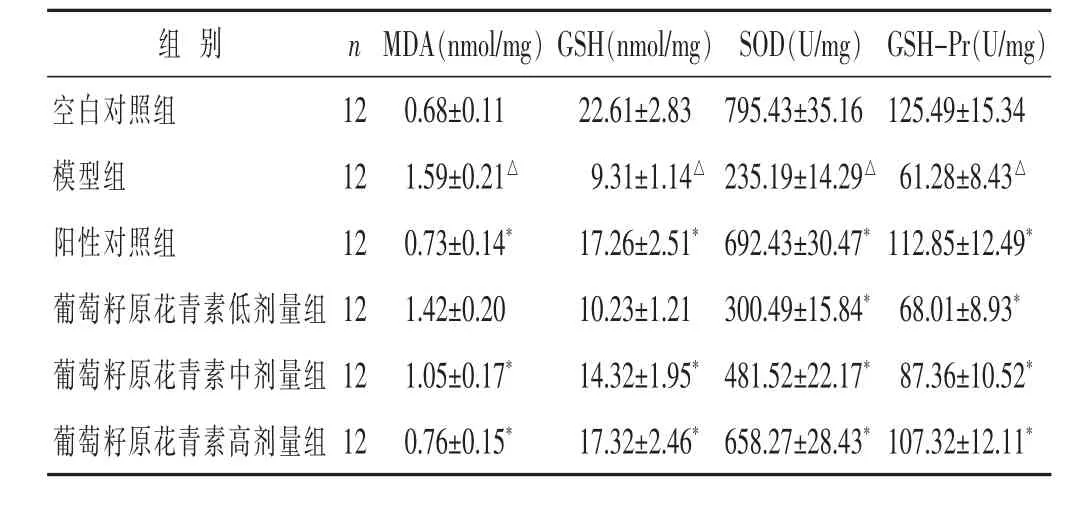
表2 各组大鼠肝组织中MDA、GSH含量与SOD、GSH-Pr活力比较(±s)
组 别 n空白对照组 12模型组 12阳性对照组 12葡萄籽原花青素低剂量组 12葡萄籽原花青素中剂量组 12葡萄籽原花青素高剂量组 12 MDA(nmol/mg)GSH(nmol/mg) SOD(U/mg) GSH-Pr(U/mg)0.68±0.11 22.61±2.83 795.43±35.16 125.49±15.34 1.59±0.21△ 9.31±1.14△ 235.19±14.29△ 61.28±8.43△0.73±0.14* 17.26±2.51*692.43±30.47*112.85±12.49*1.42±0.20 10.23±1.21 300.49±15.84* 68.01±8.93*1.05±0.17* 14.32±1.95*481.52±22.17* 87.36±10.52*0.76±0.15* 17.32±2.46*658.27±28.43*107.32±12.11*
2.4 各组大鼠肝组织中TNF-α、IL-1β和IL-6水平比较 见表3。与空白对照组比较,模型组TNF-α、IL-1β和IL-6水平显著升高(P<0.05)。与模型组比较,葡萄籽原花青素中、高剂量组和阳性对照组TNF-α、IL-1β和IL-6水平显著降低(P<0.05);葡萄籽原花青素低剂量组 TNF-α、IL-1β 水平显著降低(P<0.05)。
表3 各组大鼠肝组织中TNF-α、IL-1β和NF-κB水平比较(pg/mg,±s)
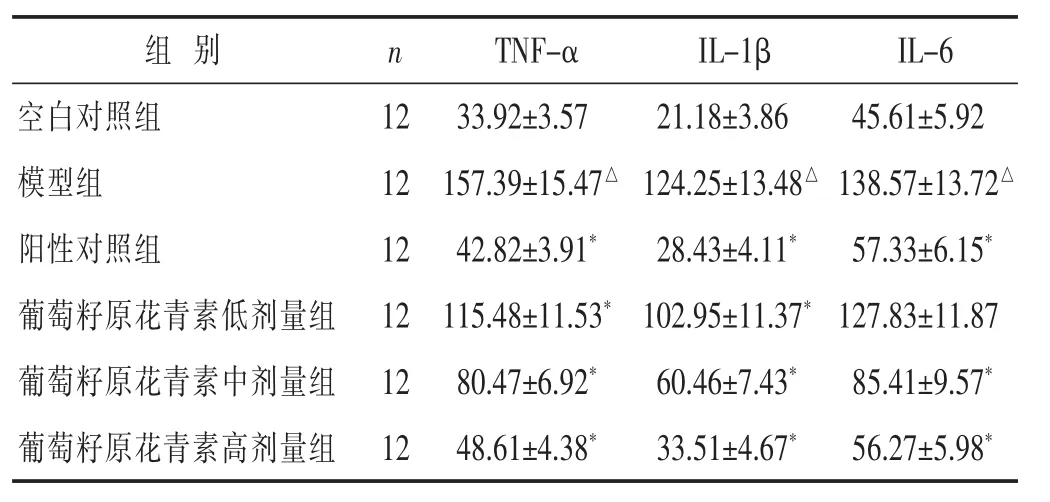
表3 各组大鼠肝组织中TNF-α、IL-1β和NF-κB水平比较(pg/mg,±s)
组 别 n空白对照组 12模型组 12阳性对照组 12葡萄籽原花青素低剂量组 12葡萄籽原花青素中剂量组 12葡萄籽原花青素高剂量组 12 TNF-α IL-1β IL-6 33.92±3.57 21.18±3.86 45.61±5.92 157.39±15.47△ 124.25±13.48△ 138.57±13.72△42.82±3.91* 28.43±4.11* 57.33±6.15*115.48±11.53*102.95±11.37*127.83±11.87 80.47±6.92* 60.46±7.43* 85.41±9.57*48.61±4.38* 33.51±4.67* 56.27±5.98*
2.5 各组大鼠Nrf2/OH-1通路和NF-κB通路相关蛋白表达的比较 见图2、表4。与空白对照组比较,模型组 Nrf2和 OH-1、GCLC蛋白表达显著减少,NF-κB p65和 pIκ-Bα 显增加(P<0.05)。 与模型组比较,葡萄籽原花青素中、高剂量组和阳性对照组Nrf2、OH-1和GCLC蛋白表达显著增加,磷酸化NF-κB p65和Iκ-Bα显著减少(P<0.05),葡萄籽原花青素低剂量组磷酸化Nrf-2蛋白显著增加(P<0.05)。
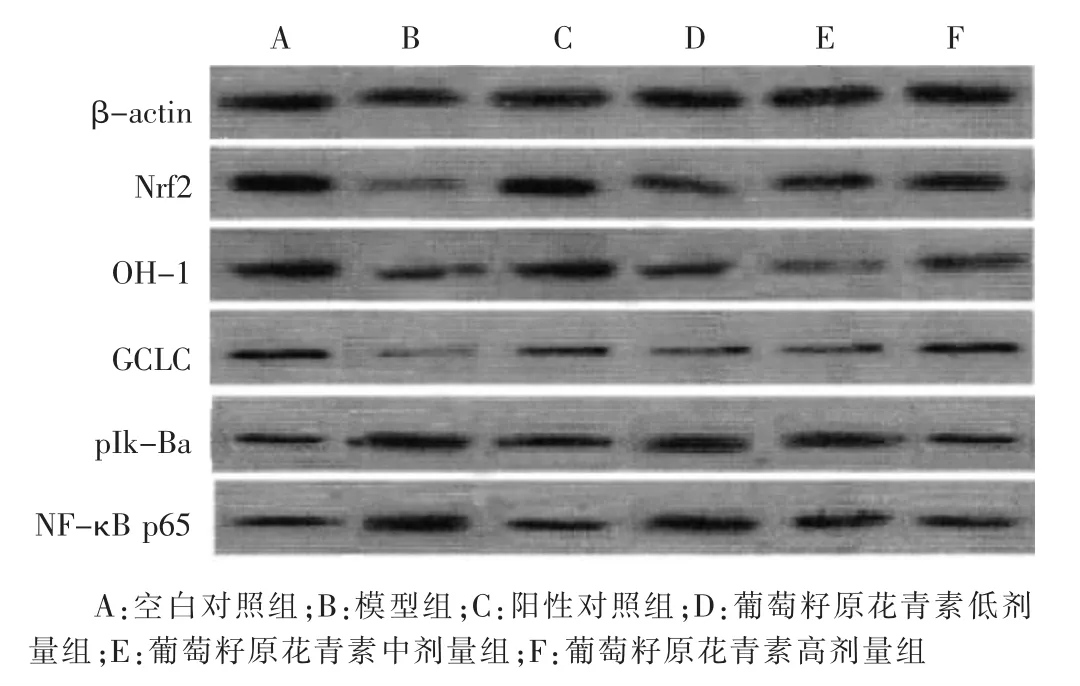
图2 Nrf2/OH-1通路和NF-κB通路相关蛋白表达情况
表4 各组大鼠Nrf2/OH-1通路和NF-κB通路相关蛋白表达灰度值比较(±s)

表4 各组大鼠Nrf2/OH-1通路和NF-κB通路相关蛋白表达灰度值比较(±s)
组 别 n空白对照组 12模型组 12阳性对照组 12葡萄籽原花青素低剂量组 12葡萄籽原花青素中剂量组 12葡萄籽原花青素高剂量组 12 Nrf-2 OH-1 GCLC 1.26±0.11 0.98±0.08 0.31±0.05 0.44±0.04△ 0.35±0.03△ 0.23±0.02△1.09±0.10*0.93±0.09*0.28±0.03*0.54±0.04*0.36±0.04 0.21±0.03 0.87±0.06*0.45±0.04*0.26±0.02*0.98±0.10*0.92±0.08*0.31±0.06*NF-κB p65 pIκ-Bα 0.34±0.05 0.35±0.07 0.95±0.07△ 0.94±0.08△0.43±0.04*0.44±0.05*0.91±0.06 0.89±0.07 0.82±0.08*0.79±0.09*0.67±0.06*0.64±0.05*
3 讨 论
酒精性肝病在我国的发病率呈增长趋势,可通过保肝护肝食品或者保健品来滋养防范。葡萄籽原花青素是从葡萄籽中提炼出来的具有抗氧化等活性的物质,而葡萄籽是生产葡萄汁和葡萄酒的废弃部分,因此,对于开发保肝护肝药物具有良好的发展前景。
机体在大量摄入乙醇后,经乙醇脱氢酶催化脱氢被氧化,三羧酸循环发生障碍以及脂肪酸氧化减弱从而影响脂肪代谢,乙醇还能激活氧分子产生氧自由基引起肝细胞膜脂质过氧化及体内还原型谷胱甘肽耗竭。ALT和GOT是反映肝功能的重要生化指标,肝脏组织受到损伤时,组织和血清中ALT和GOT水平会升高[6]。本实验连续两周给大鼠灌胃红星二锅头后,模型组大鼠肝细胞坏死,炎性细胞浸润,肝细胞索消失,ALT和GOT含量升高,说明大鼠灌胃乙醇后肝组织损伤,肝功能降低,酒精性肝损伤大鼠模型建立成功。MDA是氧自由基与生物膜不饱和脂肪酸发生脂质过氧化反应的稳定代谢产物,其含量变化间接反映氧自由基含量的变化,在一定程度上反映细胞损伤程度[7]。SOD和GSH均是体内重要的自由基清除剂,GSH-Pr是重要的抗氧化酶,可介导GSH清除H2O2和脂质过氧化物[8]。本研究结果显示,葡萄籽原花青素作用后,与模型组相比,不同浓度的葡萄籽原花青素可降低大鼠肝脏组织MDA含量,提高GSH水平与SOD、GSH-Pr活力,说明葡萄籽原花青素能改善大鼠酒精性肝损伤,表现出肝保护作用,原因可能是葡萄籽原花青素具有较强抗氧化活性和清除自由基的作用。
Nrf2是一种核转录因子,在调节氧化还原平衡过程中发挥重要作用,自由基或亲核物质刺激时发生磷酸化,Nrf2和细胞骨架相关蛋白发生解离,Nrf2进入细胞核启动Nrf2下游靶基因血红素氧合酶1(OH-1)、GCLC等抗氧化酶的表达而发挥抗氧化功能[9-10]。研究表明,大量酒精作用能抑制Nrf2的正常活化表达,导致酒精诱导的氧化应激加重[11]。本研究结果显示,葡萄籽原花青素能提高酒精性肝损伤大鼠Nrf2和OH-1蛋白表达,其可能通过上调Nrf2/OH-1信号通路,激活了下游抗氧化酶的表达,从而减轻了酒精对大鼠肝脏造成的损伤。酒精引起的氧化损伤还可以继发性激活肝脏炎症反应,导致释放大量细胞因子和炎症介质[12]。NF-κB是一种多功能核转录因子,当细胞被激活后,NF-κB p65 与抑制因子 Iκ-Bα 快速磷酸化为 pIκ-Bα,复合物被水解,胞浆内的NF-κB p65移位进入细胞核,发挥基因调控作用,促进下游TNF-α、IL-1β和IL-6等大量炎性细胞因子分泌,在炎症反应的细胞因子网络调节中发挥重要作用[13-15]。本研究结果显示,葡萄籽原花青素高剂量组NF-κB p65和pIκ-Bα较模型组显著减少,说明葡萄籽原花青素可抑制Iκ-Bα磷酸化,也可能通过NF-κB通路保护肝组织损伤。其下游炎性细胞因子TNF-α、IL-1β和IL-6表达水平变化与NF-κB p65和pIκ-Bα蛋白变化一致,进一步说明葡萄籽原花青素可能通过抑制NF-κB信号通路的激活从而保护肝组织损伤。
综上所述,葡萄籽原花青素可能激活Nrf2/OH-1信号通路,促进下游抗氧化酶的表达,同时抑制了酒精性肝损伤大鼠NF-κB信号通路的激活,从而减轻了酒精引起的肝损伤大鼠的损伤。

