瘦素受体基因敲除SD大鼠的表型及病理观察
蒋丹丹,曹兰凤,许朝霞,李硕,董晓辉,姚芳*,张连珊,*
(1. 河北医科大学基础医学院病理教研室,石家庄 050017;2. 河北医科大学新药安全评价研究中心,石家庄 050017)
随着饮食结构和生活习惯的改变,肥胖人群越来越多,研究显示到2014年世界有6亿人肥胖,肥胖率达13%[1]。肥胖不仅是一种非感染性流行病,而且是心脑血管疾病、癌症、糖尿病等慢性病的重要诱因[2-4]。现如今,肥胖成为基础和临床的研究热点,仍有很多未知的领域需要研究探讨,理想的动物模型是疾病机制研究和药物研发的基础。目前常用的肥胖动物模型主要是高脂饮食诱导[5]、自发性遗传突变[6]和基因敲除小鼠[7]。2015年,中国医学科学院动物研究所通过CRISPR/Cas9技术成功建立瘦素受体全基因敲除(Lepr-/-)大鼠[8],本研究对此型大鼠的血脂血糖,胰岛素功能及相关脏器的组织病理学进行动态观察,进一步论证Lepr-/-大鼠作为代谢性疾病分子机制研究和新药研发模型动物的可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物
亲代Lepr+/-大鼠,其瘦素受体(Leptinreceptor,Lepr)基因敲除杂合子(Sprague-Dawley背景)由中国医学科学院医学实验动物研究所张连峰教授赠予【SCXK(京)2013-0002】,利用CRISPR/Cas9技术建立Lepr基因敲除(Lepr-/-)大鼠。动物饲养于河北医科大学GLP实验动物中心SPF环境【SYXK(冀)2018-005】,饲养条件:光照黑暗12 h循环,温度20~25℃,湿度40%~70%,标准饲料喂养,自由饮水。所有操作均符合动物伦理学要求(伦理审批号:LACUC-Hebmu-PD-201718)。
1.1.2 主要试剂和仪器
DNA提取试剂盒(EE101-02, TransGen Biotech,中国);PCR MasterMix试剂盒(PC8001, Aidlab,中国);PCR引物(Invitrogen公司,美国);葡萄糖(Sigma公司,美国);胰岛素(诺和灵,诺和诺德公司,丹麦);游离脂肪酸检测试剂盒(NEFA酶法,南京建成公司,中国);油红O试剂(CO7961,北京Coolaber公司,中国);血糖仪(ACCU-CHEK,Performa,德国);全自动血生化测定仪(CHEMIX-180,Sysmex公司,日本),光学显微镜(Olympus BX63,日本)。
1.2 方法
1.2.1Lepr-/-大鼠的繁殖、鉴定及分组
采用杂合子×杂合子交配方式进行繁殖培育(纯合子动物不孕不育)。子代大鼠出生8天后剪鼠尾提取DNA,PCR扩增进行基因型鉴定,野生型(Wild Type,WT)大鼠扩增622 bp片段,纯合子(Lepr-/-)大鼠扩增368 bp片段,两个片段引物序列如下:
Primer S:5’ CTTGTGTCCAGAGCCTTCCTATAAC
Primer AS:5’ ATTCCCCATGTTGTCTAGTAGTGATC
扩增条件:95℃ 5 min;(95℃ 30 s,65℃ 30 s,72℃ 45 s)×30;72℃ 10 min;hold 4℃。
离乳后大鼠根据基因鉴定结果分为模型组(Lepr-/-)和对照组(野生型)。两组动物均喂标准饲料,4周龄开始进入实验。
1.2.2 监测体重、摄食量和测定血糖
第4周开始监测大鼠的摄食量/周和体重/周;每两周采鼠尾静脉血测随机血糖(RBG)和空腹血糖(FBG)。
1.2.3 葡萄糖耐量试验(GTT)和胰岛素耐量试验(ITT)
在10周龄、14周龄和18周龄分别进行GTT和ITT试验。
(1)GTT:大鼠禁食(不禁水)14 h,采鼠尾血测0 min血糖,按2 g/kg体重腹腔注射40%葡萄糖,于注射后15、30、60、90、120 min时间点采鼠尾静脉血测定血糖。
(2)ITT:大鼠禁食(不禁水)4 h,采鼠尾血测0 min血糖,按0.75 U/kg体重腹腔注射胰岛素(浓度0.375 U/mL),于注射后15、30、60、90、120 min时间点采鼠尾静脉血测定血糖。
1.2.4 测定血糖、血脂和血非酯化脂肪酸
10、14和18周龄大鼠禁食后取血,分离血清,于-20℃保存,统一测定。全自动血生化测定仪检测:血糖(GLU)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、总胆固醇(TCHO)、三酰甘油(TG)等指标;采用南京建成游离脂肪酸检测试剂盒检测血清非酯化脂肪酸(NEFA)浓度,根据说明书进行操作。
1.2.5 病理组织学观察
14周龄和18周龄模型组大鼠各10只,对照组大鼠各8只(雌雄各半),禁食后3%戊巴比妥钠麻醉(1.5 mL/kg体重),腹主动脉取血后,取心脏、脑、肝、肾称重,计算脏脑系数(脏器重量/脑重)。心脏、肝、肾、胰腺、骨骼肌、内脏脂肪、棕色脂肪等组织,常规福尔马林固定、石蜡包埋、HE染色,光学显微镜下观察。
肾小球直径测量:每张肾脏HE切片于高倍镜下选取20~25个带血管极或(和)尿极的肾小球,每组共取100个肾小球,采用Image-Pro-Plus 5.0软件计算肾小球的最大直径。
1.2.6 油红O染色。
4%多聚甲醛固定心脏、肝、肾、骨骼肌24 h,蔗糖梯度脱水,OCT包埋,冰冻切片(厚度6 μm),油红O染色。光学显微镜下观察、照相。
1.3 统计学方法
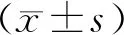
2 结果
2.1 Lepr-/-大鼠基因型鉴定结果
基因型结果分析:扩增出622 bp条带为WT大鼠;扩增出368 bp条带为Lepr-/-大鼠;同时扩增出622 bp和368 bp两个条带为Lepr+/-大鼠,图1所示。
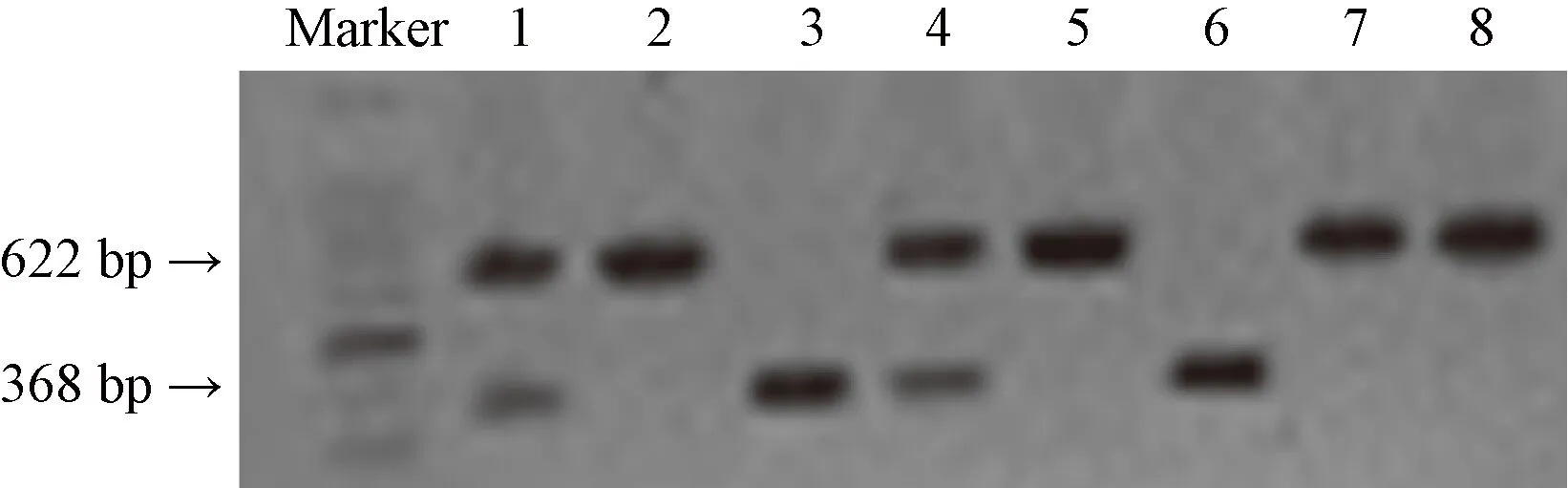
注:Lepr-/-大鼠:3,6号;野生型大鼠:2,5,7,8号;杂合子大鼠:1,4号。图1 子代大鼠基因型结果Note. Lepr-/- rats: 3, 6. Wild type rats: 2, 5, 7, 8. Heterozygous rats: 1, 4.Figure 1 Genotype of the offspring rats
2.2 Lepr-/-大鼠摄食量和体重明显增加
雌雄性Lepr-/-大鼠4周开始出现摄食量增多和肥胖,持续到18周(图2)。18周时,雄性Lepr-/-大鼠平均体重达(807.8 ± 100.0)g,是WT大鼠的1.5倍(P=0.003);雌性Lepr-/-大鼠的平均体重达(645.5 ± 100.7)g,是WT大鼠的2.3倍(P< 0.001)(图3A,C);雄性Lepr-/-大鼠日平均摄食量达(48.9 ± 3.2)g,是WT大鼠的1.8倍(P< 0.001),雌性Lepr-/-大鼠日平均摄食量达(33.4 ± 6.8)g,是WT大鼠的2.2倍(P< 0.001)(图3B,D)。
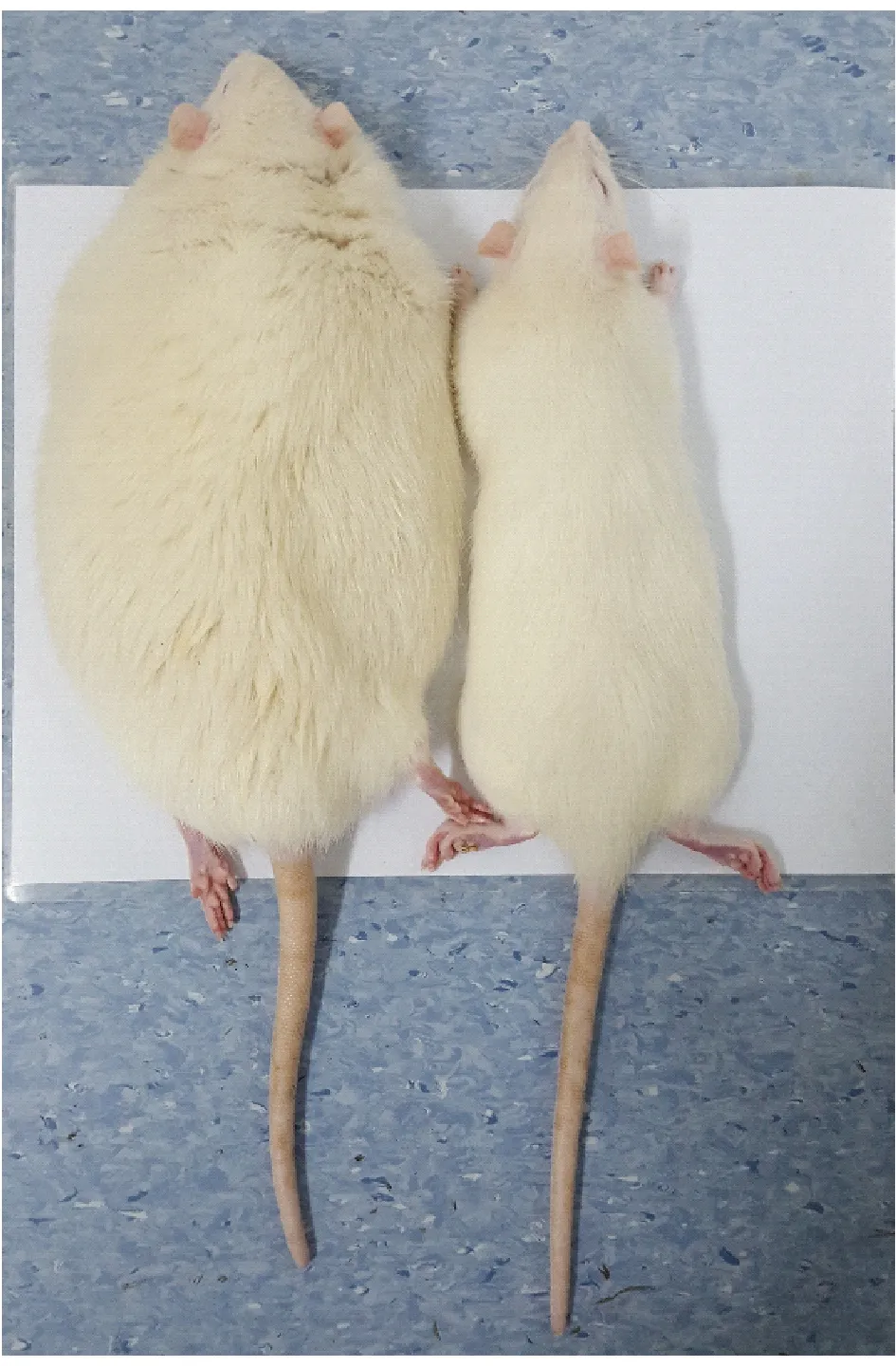
图2 14周Lepr-/-大鼠(左)与野生大鼠(右)对比图Figure 2 14-week Lepr-/- rat (left) and wild type rat (right)
2.3 Lepr-/-大鼠随机血糖升高和葡萄糖耐量受损
雌雄性Lepr-/-大鼠于10周出现随机血糖波动性升高,但个体间差异较大,持续到18周(图4A,C);雄性Lepr-/-大鼠空腹血糖与野生大鼠无显著性差别,雌性Lepr-/-大鼠家腹血糖只在18周较野生型有意义增高(图4B、D)。Lepr-/-大鼠于14周出现葡萄糖耐量受损:14周雄性Lepr-/-大鼠血糖峰值可达到20.0 mmol/L,葡萄糖刺激120 min后,血糖仍维持在较高水平(12.6 mmol/L);18周受损加重:血糖峰值达29.4 mmol/L,刺激120 min后,血糖水平仍为21.2 mmol/L(图5A)。雌性Lepr-/-大鼠14周血糖峰值达到23.0 mmol/L,刺激120 min后,血糖水平为16.5 mmol/L,比雄性糖耐量受损更明显,18周受损程度和14周基本相同(图5B)。
2.4 Lepr-/-大鼠表现胰岛素抵抗
雌雄性Lepr-/-大鼠于10周出现胰岛素抵抗,腹腔注射胰岛素后血糖水平下降幅度小,且至刺激120 min后,血糖回升到较高水平;14周时胰岛素抵抗加重(图6)。
2.5 Lepr-/-大鼠血糖升高、血脂紊乱、血非酯化脂肪酸升高
两种基因型的大鼠血生化指标无性别差异,本研究将雌雄动物血生化数据合并。结果显示:10周血糖升高,14周和18周血糖有意义升高。10周的Lepr-/-大鼠血清总胆固醇、三酰甘油、非酯化脂肪酸、高密度脂蛋白和低密度脂蛋白增高显著,分别是野生型大鼠的1.5、8.7、2.7、1.5和1.8倍,血脂紊乱和血非酯化脂肪酸升高持续到18周(表1)。
2.6 Lepr-/-大鼠脏器重量增加
和同周龄野生大鼠比较,雄性14周Lepr-/-大鼠的心脏、肝脏和肾脏的净重和脏脑系数有统计学意义的增高,并随周龄的增加,心肝肾的脏器系数进一步增加(表2)。雌性Lepr-/-大鼠脏器系数增大,同雄性一致(表3)。
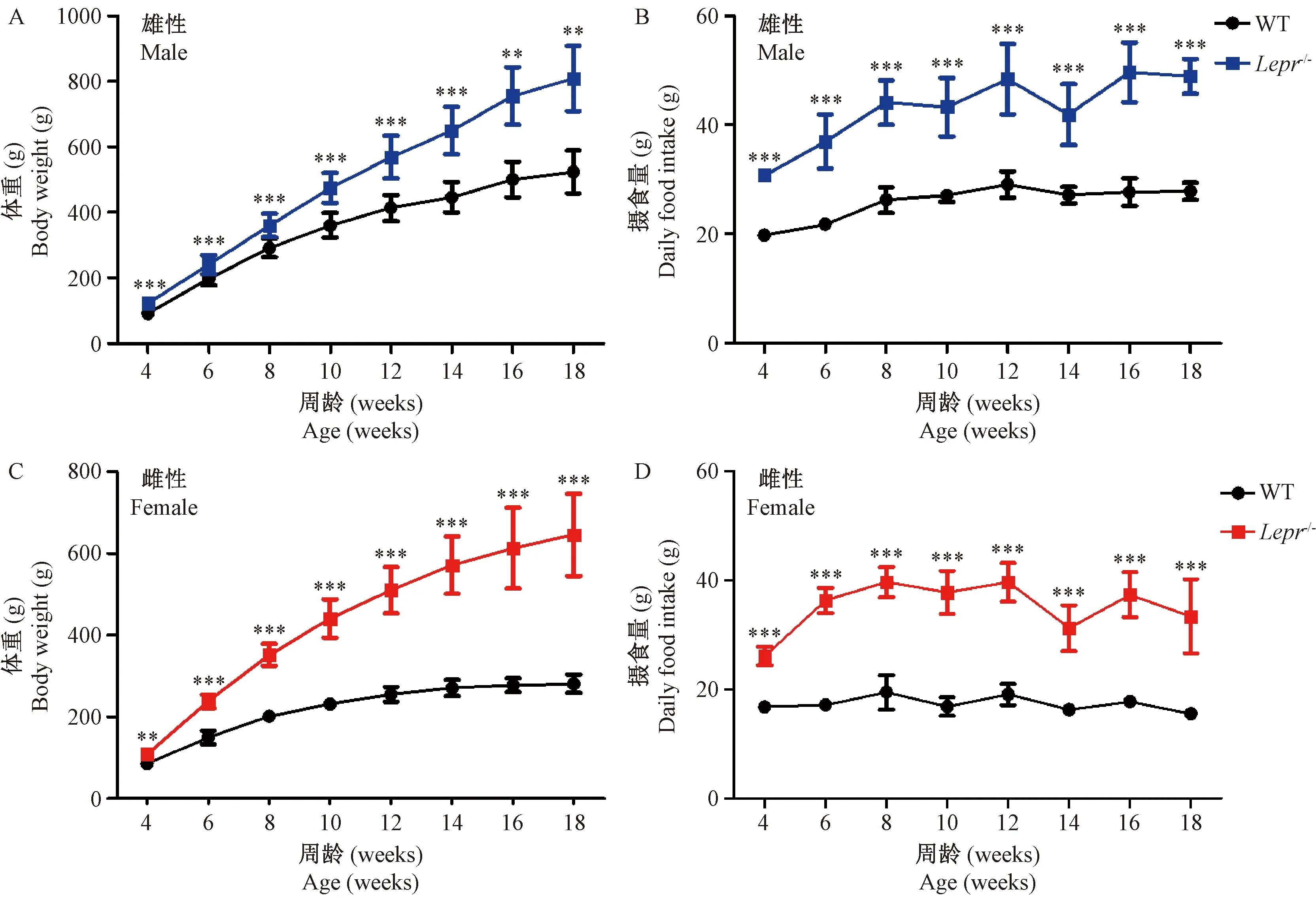
注:(A、C)体重曲线;(B、D)摄食量曲线。Lepr-/-大鼠(雄性n=14,雌性n=13);野生大鼠(雄性n=15,雌性n=13)。与野生型大鼠比较,**P< 0.01,***P< 0.001。图3 Lepr-/- 大鼠和野生大鼠的体重和摄食量Note. (A, C) Curves of body weight. (B, D) Curves of daily food intake. Lepr-/- rats (male n=14, female n=13). WT rats (male n=15, female n=13). Compared with the wild type rats,**P< 0.01,***P< 0.001.Figure 3 Body weight and daily food intake of the Lepr-/- rats and wild type rats
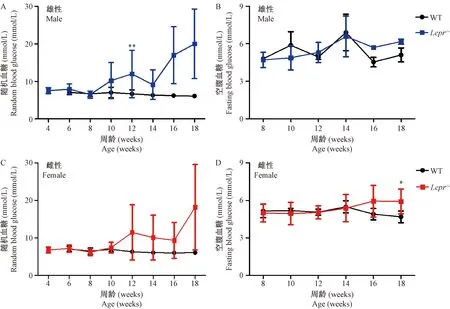
注:(A、C)随机血糖;(B、D)空腹血糖。Lepr-/-大鼠(雌雄各10只);野生大鼠(雄性n=8,雌性n=10)。与野生型大鼠比较,*P< 0.05,**P< 0.01,***P< 0.001。图4 Lepr-/- 大鼠和野生大鼠的随机血糖和空腹血糖Note. (A, C) Curves of random blood glucose. (B, D) Curves of fasting blood glucose. Lepr-/- rats (male n=10, female n=10). WT rats (male n=8, female n=10). Compared with wild type rats,*P< 0.05,**P< 0.01,***P< 0.001.Figure 4 Random blood glucose and fasting blood glucose of the male and female Lepr-/- rats and wild type rats
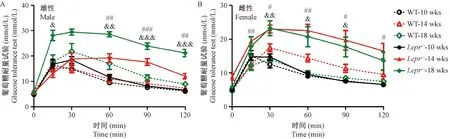
注:10、14、18周龄大鼠腹腔给予葡萄糖后血糖值曲线。(A)雄性:Lepr-/-大鼠(10周n=9,14周n=8,18周n=5);WT大鼠 (10周n=6,14周n=9,18周n=6)。(B)雌性:Lepr-/-大鼠(10周n=8,14周n=8,18周n=5);WT大鼠(10周n=7,14周n=9,18周n=4)。与14、18周龄野生型大鼠比较,#,&P< 0.05,##,&&P< 0.01,###,&&&P< 0.001。图5 葡萄糖耐量试验Note. Blood glucose levels were measured after D-glucose administration at 10,14 and 18 weeks. (A) male, Lepr-/- rats(10 weeks n=9, 14 weeks n=8, 18 weeks n=5). WT rats (10 weeks n=6, 14 weeks n=9, 18 weeks n=6). (B) female, Lepr-/-rats(10 weeks n=8, 14 weeks n=8, 18 weeks n=5). WT rats(10 weeks n=7, 14 weeks n=9, 18 weeks n=4). Compared with the wild type rats at 14 and 18 weeks respectively,#,&P< 0.05;##,&&P< 0.01;###,&&&P< 0.001.Figure 5 Glucose tolerance test in the male and female rats
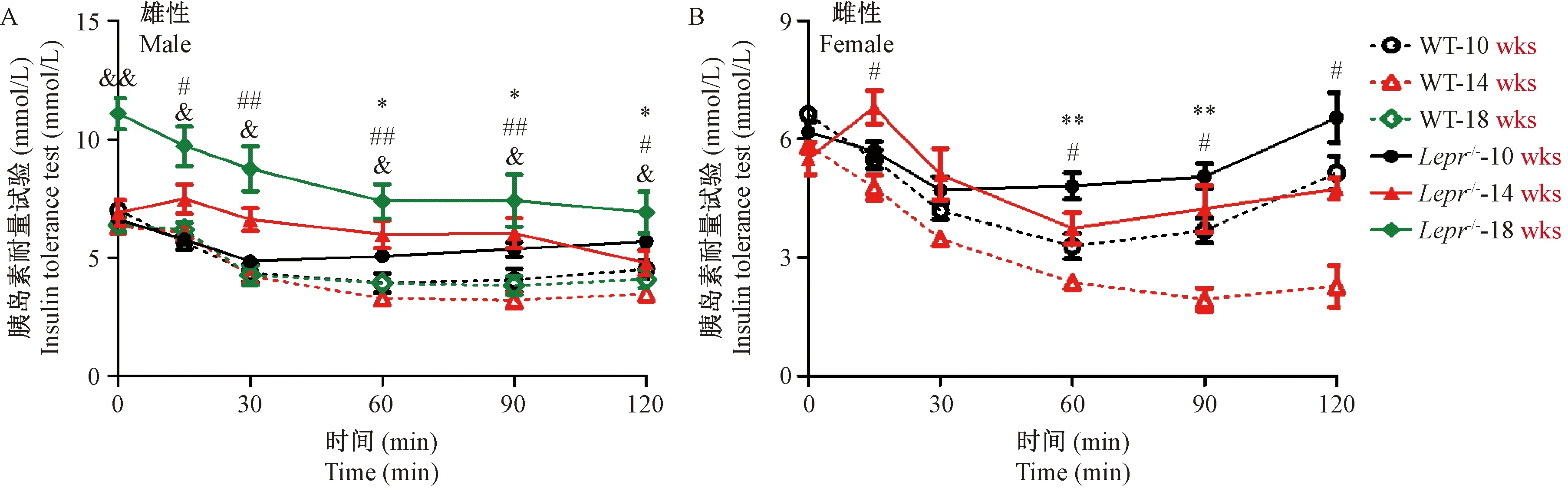
注:10、14、18周龄Lepr-/-和野生大鼠腹腔给予胰岛素后血糖数值曲线(雌性只检测了10周和14周)。(A)雄性:Lepr-/-大鼠(10周n=9,14周n=5,18周n=5);WT大鼠 (10周n=9,14周n=5,18周n=5);(B)雌性: Lepr-/-大鼠(10周n=11,14周n=4);WT大鼠(10周n=11,14周n=4)。与10、14、18周龄野生型大鼠比较,*,#,&P< 0.05,**,##,&&P< 0.01。图6 胰岛素耐量试验Note. Blood glucose levels were determined after insulin administration at 10, 14 and 18 weeks. (A) male, Lepr-/- rats (10 weeks n=9, 14 weeks n=5, 18 weeks n=5). WT rats (10 weeks n=9, 14 weeks n=5, 18 weeks n=5); (B) female, Lepr-/-rats (10 weeks n =11, 14 weeks n =4). WT rats(10 weeks n =11, 14 weeks n =4). Comparison with wild type rats at 10, 14 and 18 weeks respectively,*,#,&P< 0.05;**,##,&&P< 0.01.Figure 6 Insulin tolerance test in the male and female rats
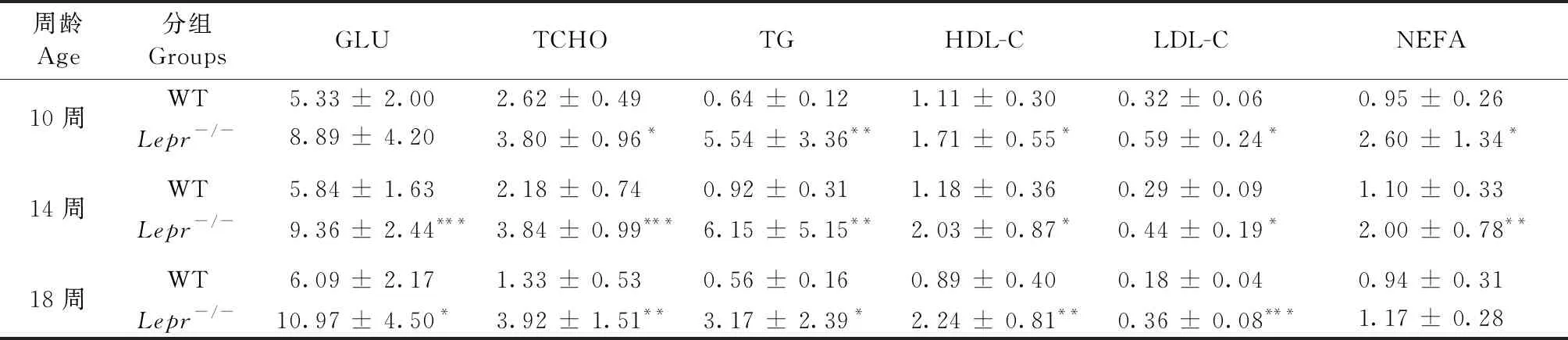
周龄Age分组GroupsGLUTCHOTGHDL-CLDL-CNEFA10周WT5.33 ± 2.002.62 ± 0.490.64 ± 0.121.11 ± 0.300.32 ± 0.060.95 ± 0.26Lepr-/-8.89 ± 4.203.80 ± 0.96*5.54 ± 3.36**1.71 ± 0.55*0.59 ± 0.24 *2.60 ± 1.34*14周WT5.84 ± 1.632.18 ± 0.740.92 ± 0.311.18 ± 0.360.29 ± 0.091.10 ± 0.33Lepr-/-9.36 ± 2.44***3.84 ± 0.99***6.15 ± 5.15**2.03 ± 0.87 *0.44 ± 0.19*2.00 ± 0.78**18周WT6.09 ± 2.171.33 ± 0.530.56 ± 0.160.89 ± 0.400.18 ± 0.040.94 ± 0.31Lepr-/-10.97 ± 4.50 *3.92 ± 1.51**3.17 ± 2.39*2.24 ± 0.81**0.36 ± 0.08***1.17 ± 0.28
注:与野生型大鼠比较,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the wild type rats,*P< 0.05,**P< 0.01,***P< 0.001.
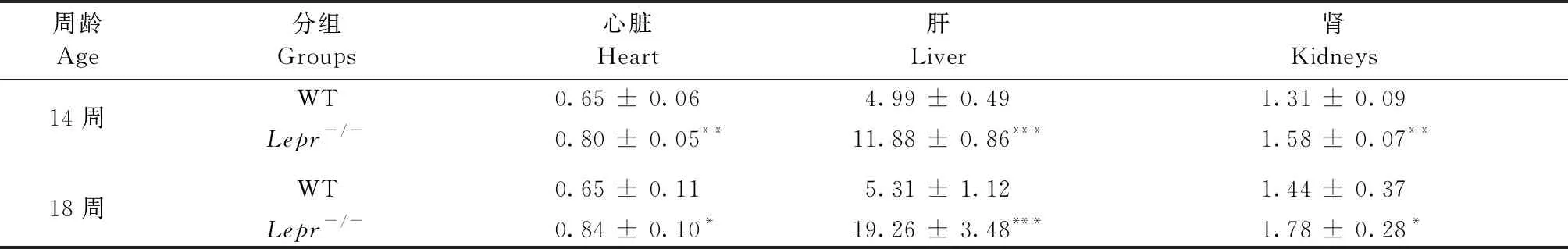
表2 雄性大鼠的脏器系数(脏/脑比)Table 2 Organ coefficient (organ/brain ratio) of the male rats
注:与野生型大鼠比较,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the wild type rats,*P< 0.05,**P< 0.01,***P< 0.001.
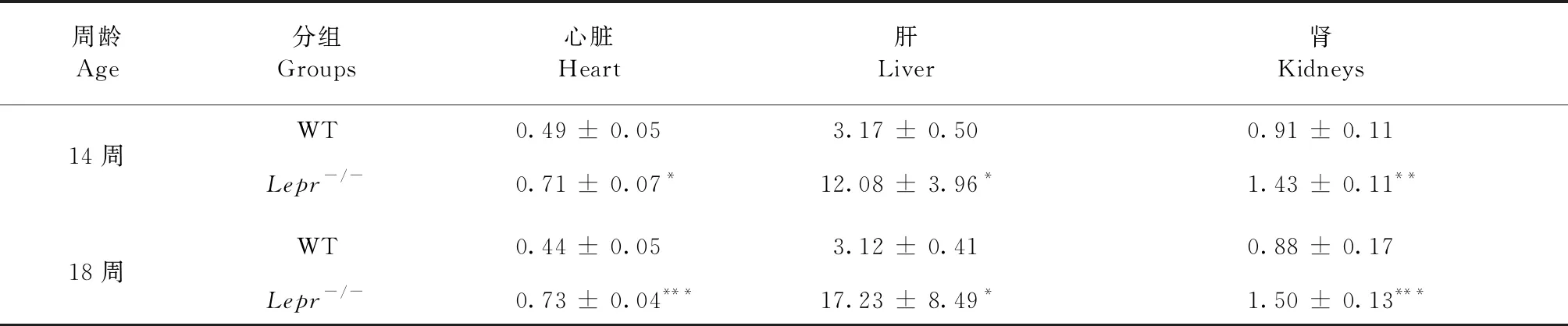
表3 雌性大鼠的脏器系数(脏/脑比)Table 3 Organ coefficient (organ/brain ratio) of the female rats
注:与野生型大鼠比较,*P< 0.05,**P< 0.01,***P< 0.001。
Note. Compared with the wild type rats,*P< 0.05,**P< 0.01,***P< 0.001.
2.7 Lepr-/-大鼠胰岛增生、心肌细胞肥大、脂肪肝、肥胖相关性肾病和骨骼肌纤维内脂质沉积增多
14周Lepr-/-大鼠胰腺小叶间结缔组织可见脂肪浸润,胰岛面积增大,胰岛内毛细血管扩张(图7 A,D);内脏脂肪(图7B,E)和棕色脂肪细胞直径增大(图7C,F);肝细胞弥漫性脂肪变性(图7G,J);肾小球细胞数目增多,毛细血管扩张,肾小管上皮细胞可见核下空泡(图7H,K),Lepr-/-大鼠肾小球直径(151.5 ± 19.2 μm)明显大于野生对照组(130.43 ± 12.2 μm)(P<0.05);心肌细胞肥大(图7I,L)。油红O染色结果:与野生大鼠肝细胞的细小脂滴比较,Lepr-/-大鼠肝细胞内充满大的脂滴;野生大鼠心脏,肾脏和骨骼肌实质细胞未见脂滴沉积,Lepr-/-大鼠心肌细胞内未见明显脂滴;部分肾近曲小管上皮细胞胞质内可见脂滴沉积,部分骨骼肌纤维可见细小脂滴(图8)。18周的各组织病理所见及各组织内脂质沉积与14周的基本相同。
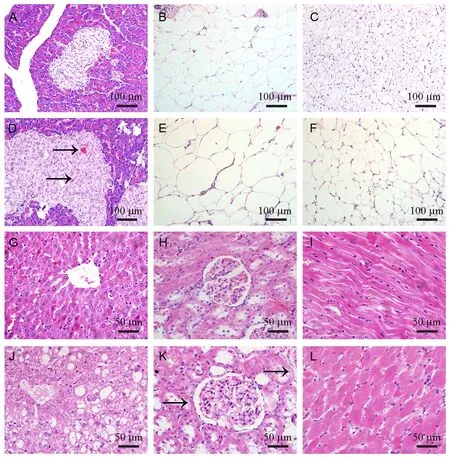
注:A,B,C:野生大鼠的胰腺,内脏脂肪,棕色脂肪(×20);D,E,F:Lepr-/大鼠-的胰腺(→指示扩张的毛细血管),内脏脂肪,棕色脂肪(×20);G,H,I:野生大鼠的肝,肾,心脏(×40);J,K,L:Lepr-/-大鼠的肝,肾(→指示核下空泡),心脏(×40)。图7 14周龄Lepr-/-大鼠和野生大鼠HE染色Note. (A, B, C) Pancreas, visceral adipose tissue, and brown adipose tissue of wild type rats. (D, E, F) Pancreas (Arrow indicates dilated capillaries), visceral adipose tissue, brown adipose tissue of Lepr-/- rats. (G, H, I) Liver, kidney, heart of wild type rats. (J, K, L) Liver, kidney (Arrow indicates vacuole inferior to nucleus), and heart of Lepr-/- rats.Figure 7 Pathological changes in the organs of Lepr-/-rats and wild type rats at 14 weeks of age(HE staining)
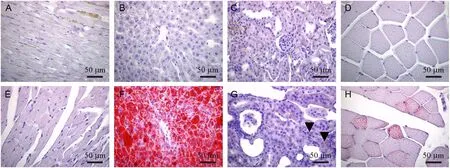
注:A,B,C,D:野生大鼠的心脏,肝,肾,骨骼肌;E,F,G,H:Lepr-/-大鼠的心脏,肝,肾(▼指示脂滴),骨骼肌。图8 14周龄 Lepr-/-大鼠和野生大鼠油红O染色Note. (A, B, C, D) Heart, liver, kidneys, and skeletal muscle of wild type rats. (E, F, G, H) Heart, liver, kidneys (▼indicates lipid droplet), and skeletal muscle of Lepr-/- rats.Figure 8 Lipid deposition in the organ tissues of the Lepr-/-rats and wild type rats at 14 weeks of age(Oil red O staining)
3 讨论
随着肥胖人群的增多,不仅心脑血管疾病、癌症、非酒精性脂肪性肝炎(NASH)和糖尿病的发病率明显上升,各种减肥药物的研发未来也会有巨大市场前景,因此,稳定的动物模型无论对肥胖的机制研究还是药物靶点的研发都非常重要。瘦素(leptin)是肥胖基因的产物,主要由白色脂肪分泌的蛋白质类激素,通过和瘦素受体(leptin receptor,Lper)结合,参与糖、脂肪和能量的调节,维持摄食和机体能量的平衡[9-10]。无论leptin缺失还是Lepr缺失,均会表现出肥胖伴不同程度糖尿病的表现。
CRISPR/Cas9系统属于第三代应用人工核酸内切酶制备基因定点突变及基因敲除动物的技术,张连峰教授团队利用该技术制备了SD背景的Lepr敲除基因大鼠(Lepr-/-),表型稳定可以传代[8],且Lepr+/-大鼠的繁殖能力与SD大鼠基本相同。Lepr-/-肥胖大鼠模型属国际首创。目前,db/db小鼠品系是应用比较广泛的肥胖症和糖尿病动物模型,但糖尿病的严重程度受基因背景的影响,BKS背景的有不可控制的高血糖,仅能存活10个月;B6背景的仅为一过性高血糖[6]。Zucker大鼠是Merck M(13 M品系)大鼠和Sherman大鼠的杂交品系,遗传背景复杂,虽然有肥胖和高胰岛素血症,但随机血糖和空腹血糖均正常[11]。本研究对普通饲料喂养的Lepr-/-大鼠进行动态观察发现:1)10周龄出现葡萄糖耐量受损、胰岛素抵抗和血脂异常,空腹血糖升高尚未达到糖尿病水平;2)14周龄大鼠的主要脏器发生病理改变:如胰岛明显增大、脂肪肝、肥胖性肾病、内脏和皮下脂肪沉积明显增多和棕色脂肪白脂化等。另外以SD大鼠为遗传背景的动物模型在生理、代谢、神经系统等方面不仅比小鼠有更好的表现[12-13],在实际应用中还可以借鉴丰富的生理学数据。Lepr-/-大鼠作为代谢综合征、肥胖性肾病[14]等疾病模型;也可进行二次刺激,如喂以蛋氨酸-胆碱酯酶缺乏(MCD)的饲料,构建非酒精性脂肪性肝炎(NASH)模型[15],或干预构建II型糖尿病模型等。综上所述,Lepr基因敲除大鼠是肥胖和代谢综合征等代谢性疾病的病因研究和药理研究的理想且可靠的模型动物。

