犬髋关节发育不良数量性状位点及致病基因研究进展
肖启程,彭广能,刘海峰,周紫峣,马晓平,钟志军
(四川农业大学动物医学院,动物疫病与人类健康四川省重点实验室,成都 611130)
犬髋关节发育不良(canine hip dysplasia,CHD)于1935年首次由Schnelle提出,是一种受多基因、多因素影响的遗传性骨病。该病可发生于任何品种、不同体型的犬,多发于6月龄至2岁间的中、大型犬,尤以德国牧羊犬和拉布拉多犬的发病率最高[1]。目前关于该病的发病机制不明,是目前研究该病的热点。数量性状位点(quantitative trait locus,QTL)已广泛应用于猪、羊、牛等动物的遗传育种研究,主要研究繁殖性状、生产性状、肉质性状以及品种间的遗传关系等。2002年Bliss等[2]首次将QTL用于犬CHD的研究,并指出CHD的分离指数,背外侧半脱位评分以及股骨头与骨骺的骨化等具有遗传性,且不同品种间的一些表型与QTL相关。因此,研究相同品种发生CHD后相关QTL的功能,有助于对犬CHD发病机制的了解。
1 犬髋关节发育不良相关QTL区域的功能
QTL指控制某一表型特征的相应基因在染色体中形成集合,通过QTL定位于染色体的遗传标记旁形成连锁关系,再根据回归分析或最大似然法分析连锁关系中的差异性进而推论出与遗传标记连锁相关的QTL的准确位置。QTL的准确性必须通过观察遗传标记与QTL之间的联系来确定[3]。针对某种性状,QTL具有多种表型[3]。随着QTL的发展,愈来愈多的领域应用QTL进行遗传相关性研究。研究发现,将某一品种具有特定基因型的犬与其他品种的具有某些特定表型的犬进行交配,可以利用QTL从遗传性状中推导出子代犬的表型特征[4]。
迄今为止,影响CHD的临床表现相关染色体主要与髋关节Norberg角、背外侧半脱位评分及分离指数相关,主要包括Norberg角增大相关的染色体(CFA1、10、16、25、29),Norberg角减小相关的染色体(CFA29),背外侧半脱位评分增高相关的染色体(CFA20、22、35),背外侧半脱位评分降低相关的染色体(CFA29)和分离指数降低相关的染色体(CFA11)。其中,CFA29与髋关节Norberg角、背外侧半脱位评分均相关。QTL的准确定位确定了与CHD发生相关的染色体位置,缩小研究CHD相关染色体位置的研究范围(见表1)。Yvonne等[5]通过全基因组分析,发现发生CHD的德国牧羊犬中有九个重要的QTL,主要位于1、3、4、8、9、16、19、26和33号染色体。而Todhunter 等[3]也采用全基因组分析和对Norberg角、背外侧半脱位评分及分离指数进行回归作图分析,发现 4、9、10、11、16、20、22、25、29、30、35、37十二种染色体中QTL的位置。这两个结论互相补充,扩展了CHD相关染色体的范围。背外侧半脱位评分相关的QTL位于16、20、22、29、35号染色体;Norberg角相关的QTL位4、10、16、25、29染色体;分离指数相关的QTL位于2号染色体,差异成分相关的QTL位于9、16、25、29、30、37号染色体。其中差异成分是指在每一例CHD中,对Norberg角、分离指数和背外侧半脱位评分进行分析而筛查出的与CHD不相关的两个变量。表现型不同的CHD,相关染色体易发生重组的位置为16、25、29和30号染色体,且不同品种犬中都发现了一些隐藏的QTL位点,比如CFA9中的14.1-28Mb位点,表明CHD中这些隐藏位点与犬的品种无关[5]。另有研究表明,在排除犬血统影响的情况下,左侧髋关节和右侧髋关节中的QTL都位于1号染色体CFA1中,同时左侧髋关节比右侧髋关节松弛程度大[6],提示临床中左侧髋关节发育不良更常见。Frary等[7]发现单个QTL可调控CHD的多种表型,表明CHD的发生特征与QTL的调控并非一一对应,若要研究CHD的特征,必须找到相对应的QTL位点。Wood 等[8]通过调查CHD的流行病学研究其遗传特性,发现拉布拉多犬出现CHD与基因遗传以及性别有关,且雄性犬CHD发病率高于雌性犬。同时,子代的CHD评分可通过亲代CHD的评分建立回归模型进行相应预测。
Yvonne等[5]通过全基因组筛查并结合Chase等[6]对QTL研究的结果推测,CHD相关QTL检出越多,越有可能提示CHD出现多种不同的临床症状。目前关于CHD中相关QTL研究仍较少,一些与 CHD症状密切相关的重要QTL尚未被发现,今后对CHD遗传机制的研究需要对更多的QTL进行研究,筛查出能确切诊断CHD的重要QTL。
2 犬髋关节发育不良的主要遗传因素以及相关候选致病基因研究
研究报道,关节松弛发生在多数退行性髋关节疾病中,且不同品种犬髋关节发育不良的关节松弛程度也不同[9]。 犬的品种和关节松弛程度是CHD形成的重要诱因,但并非决定因素[10]。
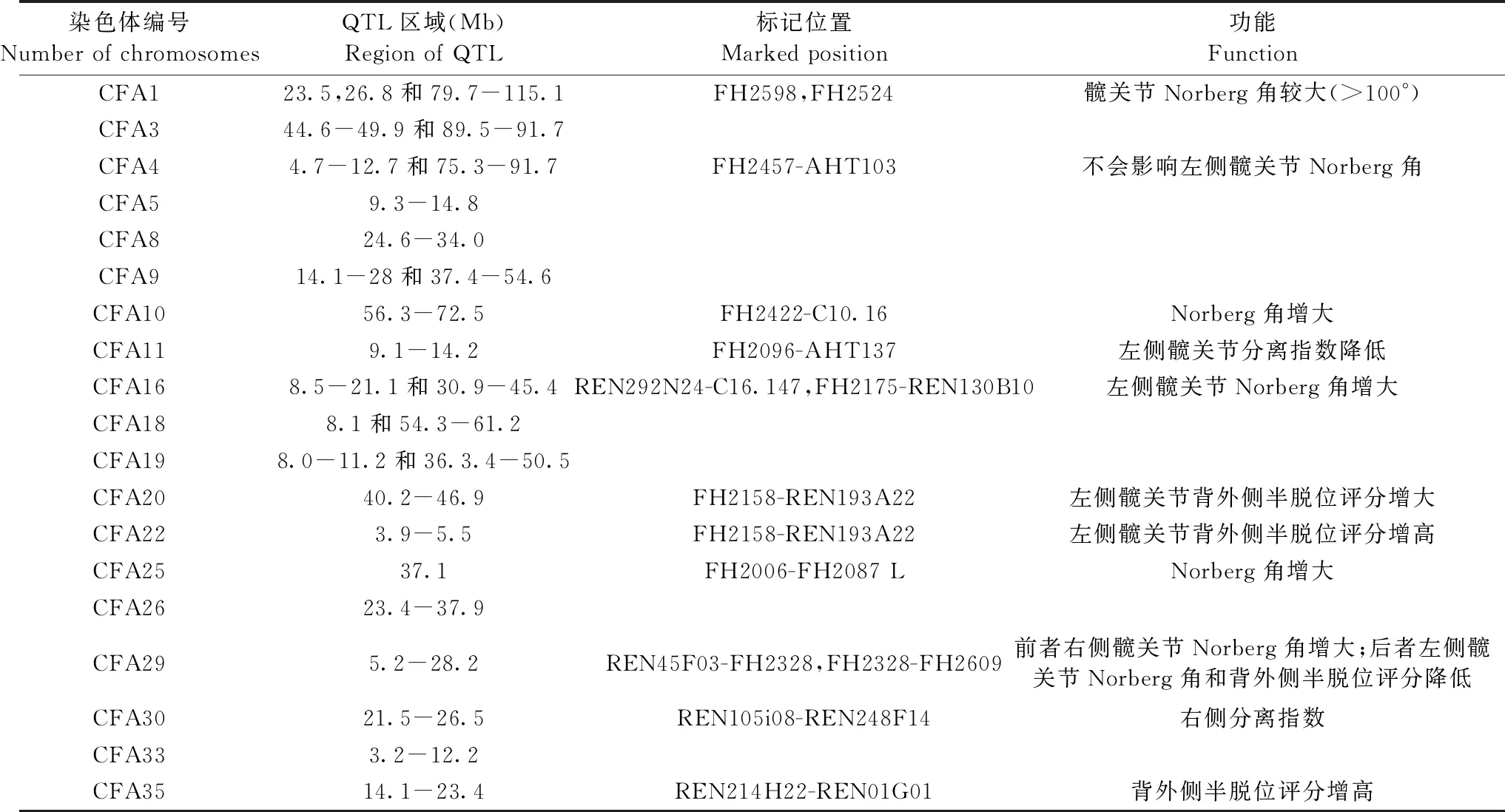
表1 犬髋关节发育不良相关染色体的位置与功能Table 1 Position and function of some chromosomes in canine hip dysplasia
目前多数遗传方面的研究通过分析年龄等因素建立模型对CHD进行等级评定,其中线性模型是一种根据CHD临床症状进行评估的模型,根据评估后的模型,研究人员可对CHD的临床症状进行初步评级;阈值模型可以解释一些髋关节不对称及其他的特殊情况,但目前尚无通过阈值模型研究CHD的相关报道。由于线性模型的评价结果被认为是阈值模型的大致估计,因而阈值模型是CHD遗传评估的有效方法[11],今后的研究中阈值模型或将成为CHD研究的热点。遗传变异的频率表明了进行基因改造的可能性[12]。亲代犬能将髋关节发育不良相关致病基因遗传给下一代,从而使正常犬携带致病基因。Soo等[13]将CHD的发病机制与临床症状加以联系,做出总结,并指出通过选择性的育种评估管理能有效减少CHD的发生。研究表明在繁育过程钟,根据育种评估选择比临床症状更为准确,其中犬只数量规模大小以及发病程度差异是选育时控制子代发生CHD的重要因素[14-15]。不同的育种规模将影响育种控制CHD的手段,若对犬只数量评估过小,则无法达到控制效果;若评估过大则耗时耗力且耗费财力。发病程度的不同会导致亲代将致病基因遗传给子代的机率存在差异。CHD临床症状的遗传能力具有可变性,其范围通常在0.1-0.6之间。亲代的临床症状,预测的计算方法,选育时的选择标准以及样本数量等因素都能影响遗传能力的大小,任何一种因素不同都将导致CHD的遗传能力不同[16]。因此在遗传育种中为了降低子代CHD的发生,需进行多方面因素的综合控制才能达到选育目的。
除此之外,FBN2、SLC26A2等一些基因的表达也与CHD的发生相关(见表2)。Friedenberg等[17]发现CFA11染色体中由碱基对缺失造成的FBN2基因突变易引起CHD的形成。SLC26A2基因能能编码硫酸盐转运载体,同时可使软骨基质中蛋白多糖硫酸化进而诱发人的骨发育不良。目前为止,人的SLC26A2基因中有30多个突变[18]。研究表明,骨发育不良、软骨发育不全和多发性骨骺发育不全等疾病中的SLC26A2基因都发生了突变。但Lee等[18]通过基因比对发现,德国牧羊犬发生CHD后SLC26A2与正常犬中SLC26A2的表达量无差异。由于该结果样本量较少,未能直接证明SLC26A2基因的表达与CHD发生无关,且该基因的表达不能排除品种差异对CHD的影响。
Clements等[19]研究表明,拉布拉多犬发生髋关节发育不良后,IL12β的表达量增多。Lavrijsen等[20]对拉布拉多犬的血液进行全基因组分析,结果显示8号染色体与犬的CHD发生有显著相关性,1、5、15、20、25和32号染色体与CHD的出现存在一定相关性。赵明媛等[21]的研究中指出,犬25号染色体中的COL6A3基因的突变会引发CHD,且该基因在正常犬和CHD患犬中表达量差异显著,表明COL6A3可能是犬CHD发生的标志物。尽管目前对犬髋关节发育不良的候选基因进行了部分研究,但今后需要更大的病例量、更多的犬种以及更加严格的实验设计才能得到CHD发生较为精确的基因调控机制。

表2 部分犬髋关节发育不良的相关致病候选基因Table 2 Candidate genes associated with the pathogenesis of canine hip dysplasia.
3 展望
犬髋关节发育不良是一种犬常见、发生率较高的疾病,其具体发病机制仍未查明。针对早期CHD的发生尚无灵敏的检测手段和有效的治疗药物,无论是对宠物主人还是对繁育机构而言都存在着巨大的隐患。Sanchez 等[28]首次研制出用于拉布拉多犬CHD发生的遗传诊断试剂盒,但其诊断率还需进行大样本量的评估。而QTL作为CHD发生时的一种较为前沿的研究方法,已经发现了部分相关染色体的功能和相关致病候选基因。但由于很多对QTL的研究都在同一品种以及部分犬中进行,所以目前基于QTL的研究所得出的结论仍缺乏科学的判断依据。目前,本课题组正在开展大样本量的犬髋关节发育不良时部分候选致病基因在CHD中的表达变化,期望能筛选出CHD发生的早期检测标志物,为该病的诊断奠定基础。

