白毛黑眼兔与日本大耳白兔胰岛素抵抗动脉粥样硬化模型的比较
刘军平,潘永明,陈民利,朱科燕,蔡月琴,吕涛,黄俊杰
(浙江中医药大学动物实验研究中心,杭州 310053)
随着人们生活水平的提高以及膳食结构的改变,代谢性综合征和心脑血管疾病的发生率明显增加。目前认为胰岛素抵抗(insulin resistance,IR)是代谢综合征和心脑血管疾病共同病理基础,且IR可引发一系列代谢紊乱和心血管疾病,从而加重动脉粥样硬化(atherosclerosis,AS)病变程度[1]。在实验动物中,IR可通过含有高糖和高脂肪的饮食诱导建立[2]。尽管饮食诱导可致大鼠IR,但由于大鼠低密度脂蛋白(low-density lipoprotein,LDL)受体缺陷[3],脂蛋白代谢与人类大不相同,并对饮食诱导的高胆固醇血症和AS具有抗性。与人类不同,大鼠和小鼠都缺乏胆固醇酯转运蛋白,这是一种重要的调节因子。脂蛋白代谢及其主要脂蛋白是高密度脂蛋白(high-density lipoprotein,HDL),而不是LDL。因此,难以使用这些动物模型来阐明IR与AS之间的关系。相反,兔作为草食动物,对膳食脂肪和胆固醇非常敏感,可迅速发展为高脂血症和AS。此外,与人类一样,但与大小鼠不同,兔血浆中含有丰富的胆固醇酯转运蛋白,且其脂蛋白原富含LDL。因此,兔可能是研究肥胖、IR和代谢综合征有价值的模型。
近来认为,微粒体甘油三酯转运蛋白(microsomal triglyceride transfer protein,MTTP)可加速甘油三酯、胆固醇与磷脂酰胆碱从供体小单层囊泡中转移至受体小单层囊泡[4],同时对脂蛋白的正常组装与分泌起重要的作用[5]。核因子E2(nuclear factor-like 2, Nrf2)介导的抗氧化反应是一种主要的细胞防御机制,Nrf2缺失或激活障碍,可加重氧化应激源的细胞毒性,导致细胞功能障碍、凋亡甚至死亡[6]。Nrf2氧化应激与人类发生动脉粥样硬化、神经退行性疾病和老化过程有关[7]。超氧化物歧化酶1(superoxide dismutase 1,SOD1) 广泛存在于自然界一切生物体内,通过催化超氧阴离子自由基发生歧化反应,减轻或消除氧自由基对机体的氧化或过氧化损害[8]。通过对肝中MTTP、Nrf2与SOD1基因表达的变化,可了解高脂饲喂对体内脂代谢的影响。
白毛黑眼(white hair black eye rabbit,WHBE)兔是本中心于1998年从日本大耳白(Japanese white rabbit,JW)兔生产群中发现并自主培育,已形成封闭群。本研究采用高脂饮食诱导WHBE兔IR-AS模型,并与JW兔比较,分析这两种品系兔IR-AS模型的表型差异以及肝组织中MTTP、Nrf2和SOD1基因表达的变化,探讨WHBE兔IR-AS疾病可能的易感机制,为WHBE兔在肥胖、代谢综合征和心脑血管疾病中的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
普通级JW与WHBE兔各12只,体重为1.8~2.0 kg,3~4月龄,雌雄各半,购自新昌县大市聚镇欣健兔场【SCXK (浙)2015-0004】,饲养于本中心兔实验室【SYXK(浙)2013-0184】,室温20~22℃,相对湿度40%~70%,12 h/12 h明暗交替。所有操作均遵守浙江中医药大学实验动物管理与伦理委员会要求(伦理批准号:ZSLL-2016-114)。
1.1.2 主要试剂及仪器
全自动生化分析仪(日立),徕卡病理切片仪(徕卡公司),全自动病理扫描切片仪(滨松公司)、连续光谱酶标仪(Thermo Fisher公司),荧光定量PCR仪(ABI),微量核酸测定仪(Thermo);总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血糖试剂盒(上海申能德赛诊断技术有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)和胰岛素试剂盒(南京建成生物工程研究所)。
1.2 方法
1.2.1 IR-AS模型的建立
适应性饲养2周后,各品系兔随机分成2组,即JW兔正常对照组(JW rabbit normal control group,JWNC)和高脂高糖饮食组(JW rabbit high fat/high sugar diet group,JWHF);WHBE兔正常对照组(WHBE rabbit normal control group,WBNC)和高脂高糖饮食组(WHBE rabbit high fat/high sugar diet group,WBHF),每组6只。NC组饲喂普通饲料;HF组饲喂高脂高糖饲料(饲料配方:0.25%胆固醇、10%起酥油、30%蔗糖、59.75%基础饲料),每日两次,连续造模12周。
1.2.2 糖脂代谢指标测定
造模12周后禁食16 h,取耳中动脉抗凝血4 mL,分离血浆,测定TC、TG、LDL-C、HDL-C水平,计算LDL-C/HDL-C比值;测定空腹血糖(FPG)和空腹胰岛素(FINS)水平,计算胰岛素抵抗指数(HOMA-IR),即FPG×FINS/22.5。
1.2.3 静脉葡萄糖耐量试验(intravenous glucose tolerance test,IVGTT)
兔禁食16 h后,耳缘静脉注射葡萄糖溶液(0.6 g/kg),分别于注射前(0 min)、注射后5、15、30、60、90、120 min,取血测定血糖和胰岛素,计算血糖和胰岛素曲线下面积。
1.2.4 SOD活性和MDA含量的测定
肝组织经匀浆后制成5%匀浆液,离心取上清液,按试剂盒说明书分别测定血浆和肝中SOD活性和MDA含量。
1.2.5 病理组织学观察
(1)脂肪病理观察
取腹部脂肪组织, 4%甲醛固定,脱水透明,浸蜡包埋,切片,行HE染色,用Image pro plus 6.0软件测量10×视野下脂肪细胞的大小,计算平均直径,并分析脂肪细胞大小分布。
(2)血管HE染色和CD68表达
取下主动脉弓,选取远端5 mm处血管环, 4%甲醛固定,脱水后石蜡包埋切片,HE染色以及CD68免疫组化染色,用Image pro plus 6.0 软件测量血管内斑块占据整个血管面积的百分率和CD68阳性表达率。
(3)主动脉脂质分析
取主动脉弓至腹主动脉末端血管, 4%甲醛固定,水洗后纵向剖开血管,固定于硅胶板上,经70%乙醇6 min处理后,苏丹IV染色6 min,70%乙醇溶液脱色,数码拍照,Image J 软件分析脂质沉积。
1.2.6 肝中MTTP、Nrf2与SOD1基因的表达
取肝组织提取总RNA和逆转录合成cDNA。然后进行RT-PCR扩增,引物由上海生工生物工程有限公司设计并合成(表1),在PCR仪上检测目的基因的Ct值,用2-ΔΔCt法计算MTTP、Nrf2与SOD1的相对表达量。

表1 引物序列Table 1 Sequences of the used primers
1.3 统计学分析
2 结果
2.1 各组体重和血脂、血糖、胰岛素及HOMA-IR的变化
与NC组比,造模12周后HF组血浆TC、TG、LDL-C、HDL-C水平以及LDL-C/HDL-C比值均显著升高(P< 0.01),FINS和HOMA-IR指数显著增加(P< 0.01),同时,WBHF组体重增加显著(P< 0.01);另外,WBHF组TG、LDL-C和HOMA-IR指数均显著高于JWHF组(P< 0.01),但WBNC组TC、HDL-C、LDL-C水平则显著低于JWNC组(P< 0.05,P< 0.01),见图1。
2.2 糖耐量试验结果
与NC组比,造模12周后HF组糖耐量与胰岛素释放曲线及曲线下面积均显著升高(P< 0.05,P< 0.01),同时WBHF组相较于JWHF组的糖耐量曲线下面积显著增加(P< 0.01)(图2)。
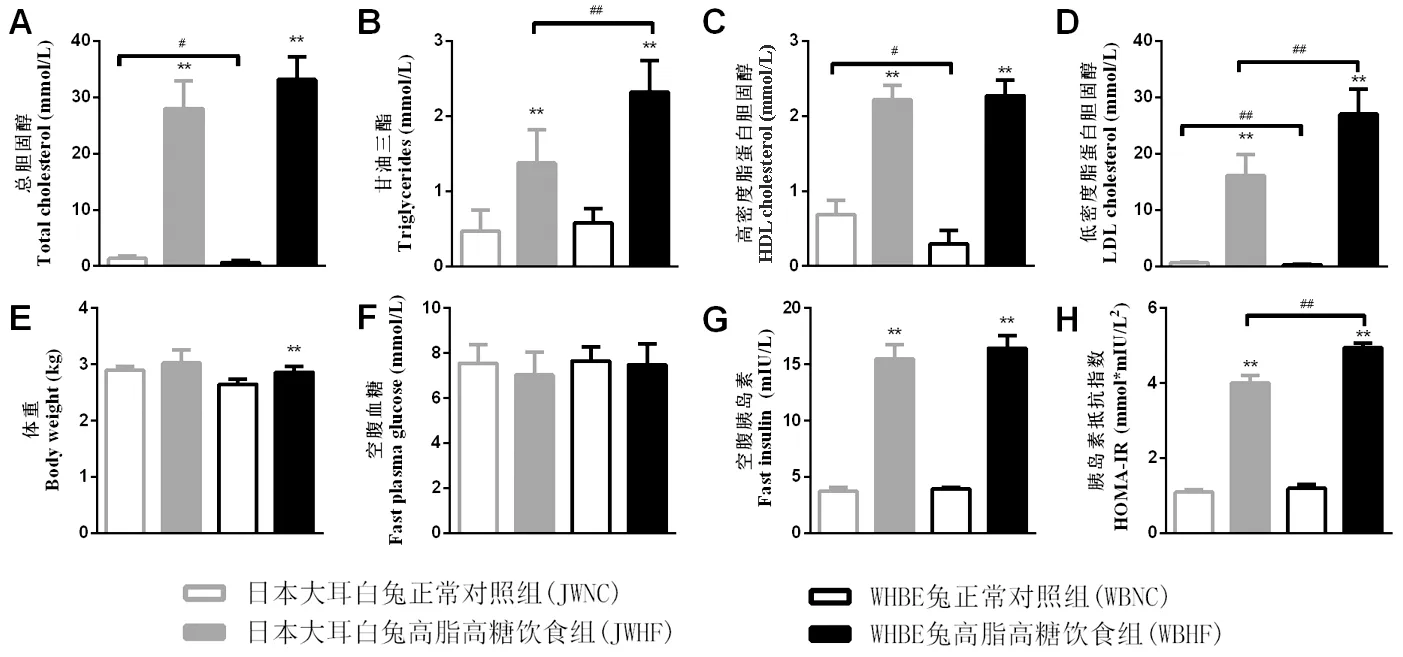
注:与NC组比,*P< 0.05,**P < 0.01。两品系兔间比较,#P< 0.05,##P < 0.01。图1 各组体重、血脂、FBG、FINS及HOMA-IR的变化Note. Compared with the NC group,*P< 0.05,**P < 0.01. Compared between the two rabbit strains,#P< 0.05,##P < 0.01.Figure 1 Changes of body weight, blood lipid, FBG, FINS and HOMA-IR in each group
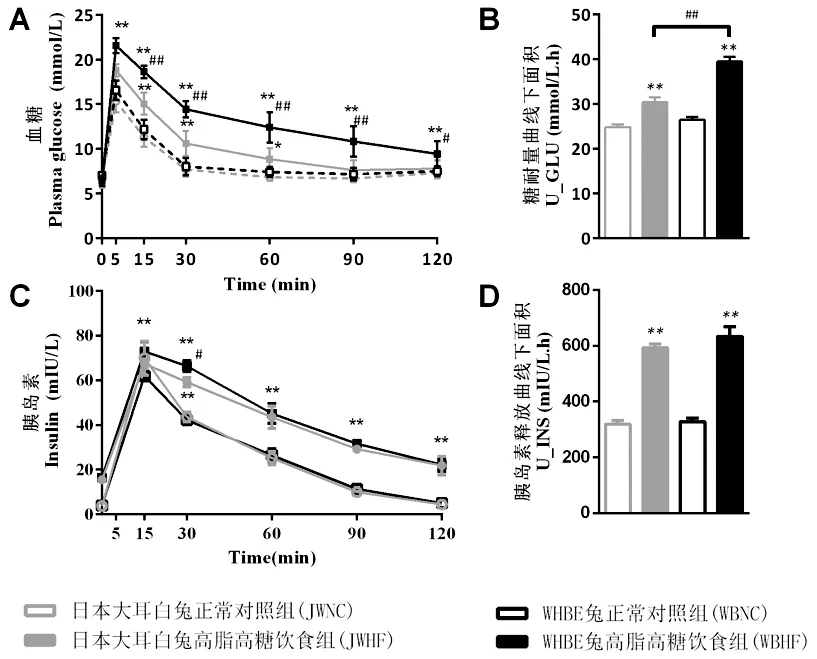
注 与NC组比,*P< 0.05,**P < 0.01;HF组之间相比,#P< 0.05,##P < 0.01。(下图同)图2 糖耐量试验结果Note. Compared with the NC group,*P< 0.05,**P < 0.01. Compared between the HF groups,#P< 0.05,##P < 0.01.(The same in the following figures)Figure 2 Results of intravenous glucose tolerance test
2.3 血浆及肝中SOD活性与MDA含量的变化
与NC组比,WBHF组血浆与肝SOD活性均显著下降(P< 0.05),JWHF组血浆SOD活性显著降低(P< 0.05);HF组MDA含量则显著升高(P< 0.01);另外,WBHF组血浆和肝MDA含量显著高于JWHF组(P< 0.05)(图3)。
2.4 脂肪细胞分布情况
与NC组相比,HF组脂肪细胞肥大(P< 0.01),并且细胞大小分布向大的方向偏移(P< 0.05,P< 0.01), 同时,WBHF组的脂肪细胞平均直径显著高于JWHF组(P< 0.01)(图4)。
2.5 各组主动脉病理组织学评估
苏丹IV染色显示,与NC组比,HF组红色脂质沉积和AS斑块明显(P< 0.01);同时WBHF组的脂质沉积和斑块显著高于JWHF组(P< 0.01)(图5A和图5C)。HE染色显示,NC组主动脉内膜结构完整且薄;HF组主动脉内膜增生明显,斑块明显向管腔内凸出,可见大量的泡沫细胞,中内膜结构模糊(图5B)。与NC组比,HF组内膜斑块面积/管腔面积和CD68阳性表达均显著增加(P< 0.01),且WBHF组显著高于JWHF组(P< 0.05,P< 0.01)(图5D和图5E)。
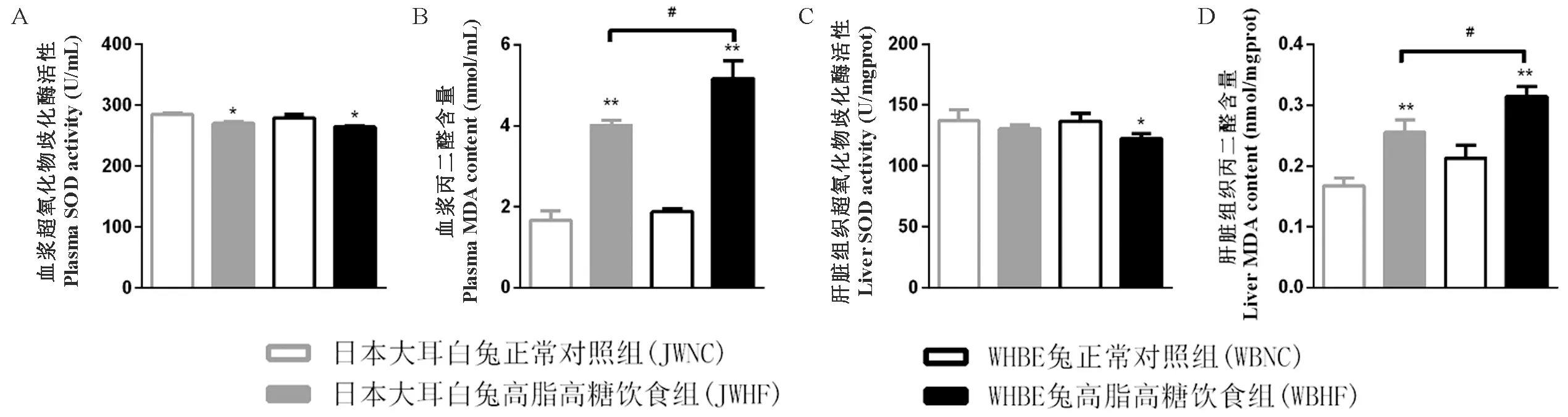
图3 各组血浆和肝组织中SOD活性和MDA含量的变化.Figure 3 Changes of SOD activities and MDA contents in the rabbit plasma and liver of each group
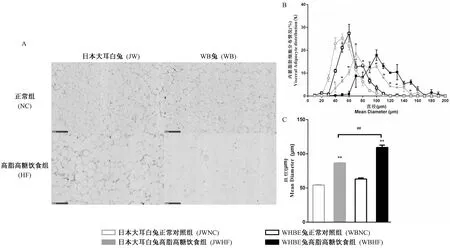
注:A为脂肪细胞染色代表图,B为脂肪细胞分布,C为脂肪细胞直径;图4 各组脂肪细胞分布情况Note. A. Representative histopathological image of visceral adipocytes. B Distribution of visceral adipocytes. C, Mean diameter of visceral adipocytes. n=6.Figure 4 The visceral adipocyte distribution in each group
2.6 各组肝SOD1, Nrf2和MTTP mRNA表达的变化
与NC组比,JWHF组肝Nrf2和MTTP基因表达显著上调(P< 0.01);但WBHF组肝SOD1基因表达下调显著(P< 0.01),同时Nrf2和MTTP基因表达上调显著(P< 0.01);另外,WBHF组肝SOD1 基因表达显著低于JWHF组(P< 0.05),见图6。
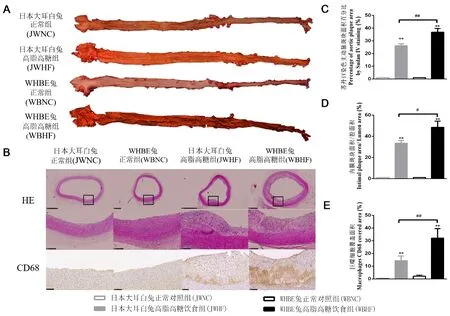
注:A为主动脉苏丹IV染色代表图,B为血管HE和CD68免疫组化代表图 (×1.25)及其黑色方框内为HE血管局部放大图(×10),C为主动脉斑块面积百分比,D为内膜斑块面积/管腔面积比,E为CD68阳性面积占比。图5 各组主动脉病理组织学评估Note. A. Representative image of aortae in each group. Sudan IV staining. B. Representative histopathological images of aorta rings. H&E staining and immunohistochemical staining with CD68 against macrophages (Mφ) (×1.25) and the enlarged view in the black square frame (× 10). C. Percentage of aortic plaque area by Sudan IV staining. D. Intimal plaque area/lumen area ratios. E. Ratio of CD68-positive cells area.Figure 5 Histopathological evaluation of aortic changes in each group
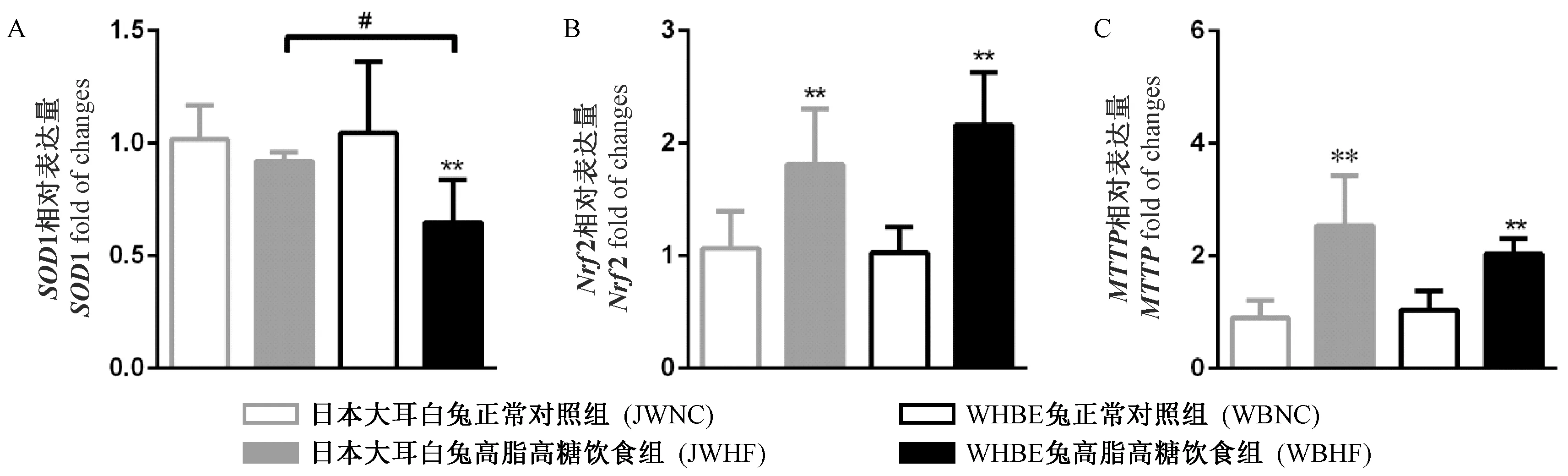
图6 各组肝SOD1, Nrf2和MTTP mRNA的变化Figure 6 Expression of SOD1, Nrf2, and MTTP mRNA in the liver tissues
3 讨论
众所周知,IR、AS的发生是遗传和环境互作的结果,脂代谢紊乱和炎症是加剧AS的起始[9]。本研究采用高脂高糖饮食诱导建立了WHBE兔IR-AS模型,并与JW兔比较,结果证实了高脂高糖饮食后这两种品系兔均有明显的血脂紊乱。虽然模型组空腹血糖未见升高,但FINS和HOMA-IR指数均明显升高,表明有外周IR。苏丹IV染色证实了高脂高糖饮食对兔AS的易感性,表现出明显的血管脂质沉积和AS。此外,与JW兔比,WHBE兔IR-AS的病变程度明显加重,主要体现在血脂(TC、LDL-C和TG)、HOMA-IR指数、糖耐量、氧化应激等方面的差异,这些差异可能综合导致了WHBE兔AS病变的严重性,同时也反映了兔模型能再现IR与AS密切相关。
WHBE兔是从JW兔生产群中发现[10],并育种保留,经过20年的培育后发现TC水平与JW兔存在差异,如WHBE兔TC及其成分明显低于JW兔,且相同环境高糖高脂饮食对WHBE兔的脂代谢敏感程度显著高于JW兔,提示除遗传因素外,环境因素对WHBE兔脂代谢影响显著。糖耐量结果也发现WHBE兔的糖耐量曲线下面积和HOMA-IR指数均高于JW兔。另外,由于游离脂肪酸(FFA)被大量摄取到肝中引起的脂质水平的增加[11],以及MTTP的过度表达可能会使肝合成并分泌极低密度脂蛋白(VLDL)增加[12],并积聚在血浆中。本研究发现正常WHBE兔存在低水平LDL-C,提示WHBE兔VLDL的分解代谢延迟,VLDL积累进一步增强,这可能是其高脂高糖饮食后血脂增加幅度高于JW兔的原因之一,还有待于研究。但应该指出的是,RT-PCR分析进一步支持了这一观点,即在高脂高糖喂养后兔MTTP基因表达明显升高,表明循环中FFA的增加也会诱发脂肪肝和脂肪堆积,并降低对胰岛素的反应,引起IR[13]。可见,脂代谢紊乱是引发IR、糖尿病、心脑血管疾病的起始因素之一,而WHBE兔对脂代谢反应的易感,使其后续IR-AS病变严重于JW兔。
氧化应激加剧脂代谢紊乱和炎症反应[14]。SOD活性和MDA含量反映了机体氧化应激程度,前者反映清除氧自由基的能力,后者反映脂质过氧化反应程度[15]。本研究发现高脂高糖饮食后这两品系兔SOD活性降低和MDA含量升高;且WHBE兔氧化应激程度显著高于JW兔,这与WHBE兔SOD1基因表达明显降低,相反JW兔SOD1基因表达下降不明显相一致,有力说明了WHBE兔对脂代谢紊乱的易感性,使其更易受氧化应激反应攻击,加重细胞组织的氧化损伤。可见,环境因素对WHBE兔的影响更为明显,这与前期发现WHBE兔肠道应激反应易感较为一致[16]。此外,研究发现Nrf2表达增加伴随着肝中SOD1的低表达,提示高脂高糖饮食可能通过增加FFA流入门静脉系统和肝脏氧化应激来诱导肝脏IR和随后的脂肪变性[17-18]。
IR和炎症互为作用,加剧疾病的发生发展。高脂高糖饮食后兔脂肪细胞肥大,且WHBE兔模型组的脂肪细胞直径显著高于JW兔;苏丹IV染色也显示WHBE兔主动脉脂质沉积明显多于JW兔,该结果与血管斑块面积占比结果较为一致。另外,WHBE兔斑块内CD68阳性表达也显著高于JW兔。临床发现AS病变的内膜CD68阳性巨噬细胞与AS病变发展引起管壁狭窄有密切的相关性[19],巨噬细胞的大量浸润以及脂质坏死核心的增大均与AS的稳定程度有关,这也符合WHBE兔AS斑块大小明显高于JW兔较为一致。可见,炎症参与了高脂高糖饮食兔IR-AS的过程。
综上所述,高脂高糖饮食诱导兔的脂代谢紊乱和炎症,导致IR-AS的发生,但WHBE兔的病变程度明显高于JW兔,这可能与这两品系兔在脂质代谢和氧化应激反应存在差异有关。这些发现为深入探讨WHBE兔的脂质代谢与IR-AS的易感分子机制提供依据,并为其遗传特性研究奠定基础。

