周脂素在糖尿病肾病大鼠肾组织中的表达
卫兵艳,樊林花,刘茂林,轩瑞晶,刘田福
(山西医科大学实验动物中心,实验动物与人类疾病动物模型山西省重点实验室,太原 030001)
糖尿病(diabetes mellitus,DM)是以血糖升高为主要特征的代谢综合征,长期持续的高血糖会引发多种并发症,当高血糖累及肾微血管时,出现糖尿病肾病(diabetic nephropathy,DN),DN是导致DM患者出现慢性肾功能衰竭(chronic renal failure, CRF)的最主要原因,也是导致DM患者死亡的首要原因之一[1]。 据报道,DM患者每年约有10%死于CRF[2]。DN在早期治疗效果较好,一旦错过最佳治疗时间,将会由大量尿蛋白而发展至尿毒症(uremia)、CRF以至危及患者的生命。故早期诊断DN、明确其发病机制对于预防和治疗DN有很重要的临床意义。
层粘连蛋白(laminin,LN)是一种非胶原糖蛋白,表达区域集中在肾小球系膜基质区。有研究发现DM患者还未出现肾病表现时,尿LN就有升高,出现肾病时有明显升高[3]。因此,检测尿LN有助于DN的诊断。周脂素(perilipin,Plin)也称脂滴相关蛋白,与胰岛素抵抗及脂代谢异常有密切的关系,其在DM大鼠的肝脏中表达增高[4],而目前就Plin在DN中研究尚未见报道。本实验通过制作DN大鼠模型,观察尿LN对早期DN的诊断价值,同时重点研究Plin在DN模型中的表达情况,为进一步明确DN发病机制寻找新思路。
1 材料与方法
1.1 材料
1.1.1 实验动物
清洁级雄性SD大鼠14只,8~10周龄,体重(200 ± 20)g,购自山西医科大学实验动物中心【SCXK(晋)2015-0001】,饲养于山西医科大学实验动物中心SPF级环境中【SYXK(晋)2015-0001】。实验操作过程中符合实验动物伦理学要求(伦理审批号:IACUC2018-002)。
1.1.2 试剂及仪器
高糖高脂饲料(北京科澳力饲料有限公司,D12450B),链脲佐菌素(streptozotocin, STZ, Sigma,S0130),考马斯亮蓝染料(Bio-Rad,1610786),尿LN ELISA 试剂盒(Nanjing Senbeijia Biotechnology Co. Ltd.,G01012078),EastepTMSuper Total RNA Extraction Kit(Promega,LS1040),GoScript Reverse Transcription Mix Oligo(dT)(Promega,A2790),GoTaq Gpcr Master Mix(Promega,A6002),Plin抗体(Abcam,ab66514),Plin及β-actin引物由大连TaKaRa 公司合成。
荧光定量PCR仪(QuantStudio 6 Flex,ABI,美国),酶标仪(Epoch,BioTek,美国),血糖仪及试纸(ACCU-CHEK,Roche,美国),显微镜(BX51,Olympus,日本),化学发光成像仪(G-Box,Chemi XX9, Syngene,英国),麻醉机(I-21025 Comerio,Ugo Basile S.R.L,意大利)。
1.2 方法
1.2.1 制作DN大鼠模型
配置1%的STZ溶液:称取1 g的STZ溶于100 mL新配制的0.2% 构椽酸盐缓冲液中,充分溶解后待用。
14只雄性SD大鼠进行随机分组,对照组6只,喂饲普通维持饲料,模型组8只,喂饲高糖高脂饲料,在SPF环境持续饲养28 d,于第28天晚上7点开始空食,12 h后模型组腹腔注射1% STZ(30 mg/kg),对照组腹腔注射等剂量构椽酸盐缓冲液。2 d后刺尾使用血糖试纸检测血糖,血糖值≥ 16.7 mmol/L,且出现多饮、多食、多尿症状的即DM大鼠模型制作成功。继续维持饲养42 d,并监测24 h尿蛋白(每周1次),当24 h尿蛋白≥30 mg/kg,即DN大鼠模型制作成功。
1.2.2 尿液相关指标的检测
从第5周开始,每周固定留取一次24 h尿标本,记录每次尿量,然后取5 mL,离心后,取上清测量尿蛋白。空白管加50 μL蒸馏水、标准管加50 μL标准蛋白、样品管加50 μL的上清,每孔再各加3 mL 考马斯亮蓝 (Coomassie brilliant blue, CBB),静置5~10 min,595 nm测吸光度值。根据公式计算:尿蛋白浓度=(样品管吸光度值/标准管吸光度值)×标准蛋白浓度。
尿LN测定:设空白孔、标准孔、样品孔;标准品按倍比稀释后各加50 μL,取50 μL尿液上清加入样品孔;封板膜封板后,37℃,30 min;揭掉封板膜,弃去液体,甩干,每孔加350 μL洗涤液,静置30 s后弃去,重复5次,拍干;每孔加酶标试剂50 μL,37℃,30 min;弃液,加350 μL洗涤液,静置30 s后弃去,重复5次,拍干;加显色剂A 50 μL,再加显色剂B 50 μL,轻轻震荡混匀,37℃避光,10 min;加终止液50 μL(此时蓝色立转黄色);15 min以内酶标仪上空白孔调零,450 nm波长测OD值;根据标准曲线计算样品浓度。
1.2.3 肾组织的处理
每只鼠称重后,2.5%异氟烷面罩吸入麻醉,仰面固定,剪开腹部,摘下左右两肾。所有大鼠均选左侧肾进行称量,记录重量,之后放入装有4%中性甲醛离心管中进行固定,48 h后进行石蜡包埋,切片,HE染色。右肾投入液氮灌中冻存,用于后续的RNA和蛋白提取。
1.2.4 Real-time PCR检测肾组织Plin mRNA水平的表达
依照EastepTMSuper Total RNA Extraction Kit说明,取冻存肾皮质约20 mg,提取RNA,酶标仪上检测RNA的浓度计纯度后,按照GoScript Reverse Transcription Mix Oligo (dT)说明进行反转录。最后按照GoTaq Gpcr Master Mix的说明进行qPCR,每个样本重复3次。所用Plin引物为:Forward primer:5,-CGAGTCACAACCCCACGAT-3,Reverse primer:5,-TCAGCCCAGAGAGGAA-3,。反应体系:Forward / Reverse primer 0.4 μL、RNA 2 μL、Mix 10 μL、CXR 0.2 μL、ddH2O 7 μL,总体积 20 μL。反应条件:95℃10 min,95℃15 s,60℃ 1 min,95℃15 s,60℃15 s,95℃15 s。
1.2.5 Western blot 检测肾组织中Plin蛋白的表达
提取肾组织总蛋白,BCA 法定量,加入loading buffer后煮蛋白变性,进行SDS-PAGE电泳,之后进行湿法转膜将蛋白条带转移至PVDF膜上,然后洗膜,封闭,一抗孵育过夜(4℃,80 r/min),二抗孵育1 h(80 r/min),PBST洗3次膜之后进行显影。DAB显色剂显影,ImageJ软件对WB条带定量分析。
1.3 统计学分析
2 结果
2.1 两组大鼠体重、肾重、肾重/体重的结果
将每只大鼠的肾重量和体重进行比值发现:模型组的肾重/体重明显高于对照组的大鼠,差异有显著性(P< 0.05)。另外,对比对照组,模型组的大鼠体重明显降低,差异有显著性(P< 0.05),结果见表1。
2.2 两组大鼠的尿量、24 h尿蛋白以及尿层粘连蛋白的变化情况
通过对比发现:相比对照组,在第5周时,模型组的尿量和尿LN已经明显升高,差异有显著性(P< 0.05),24 h尿蛋白在6周时开始出现明显增高,差异有显著性(P<0.05)。并且,尿中的这三项指标随时间推移都呈上升趋势,结果见表2,图1。
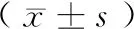
表1 两组大鼠体重、肾重及肾重/体重的结果Table 1 Body weight, kidney weight and kidney-to-body weight ratios of the two rat
注:和对照组比较,*P< 0.05。
Note. Compared with the control group,*P< 0.05.
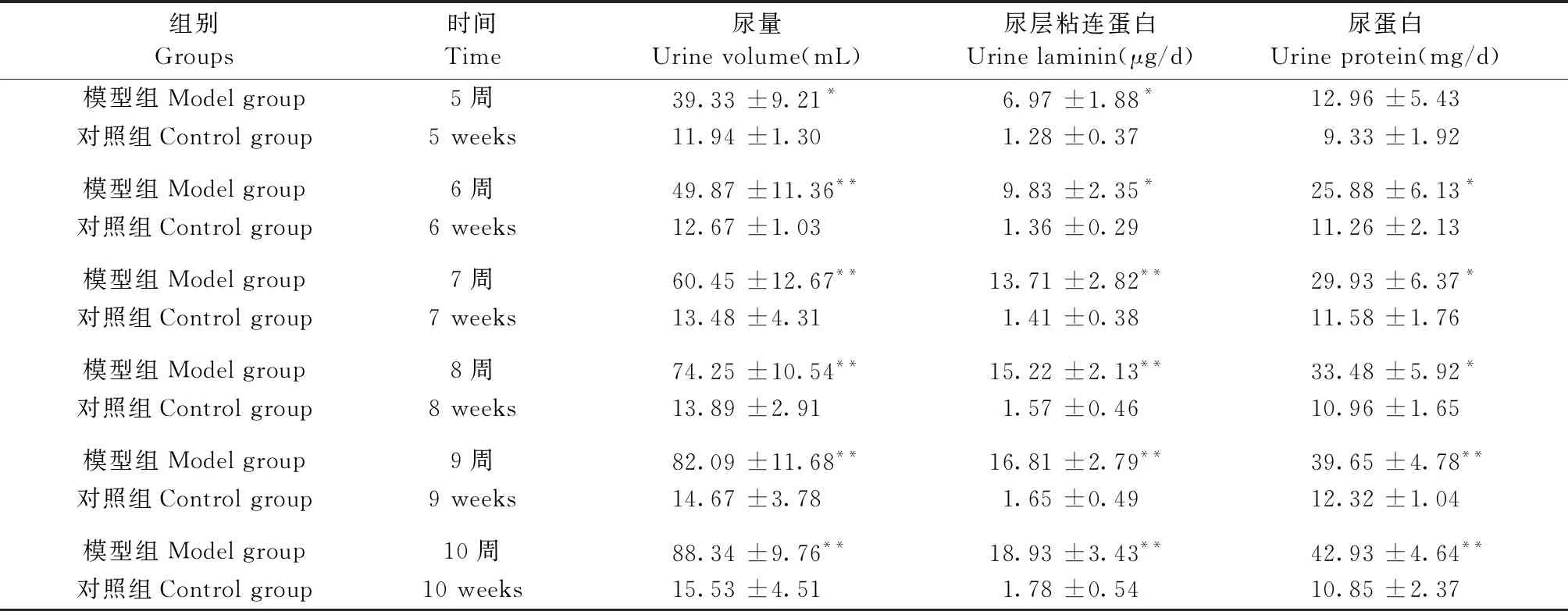
表2 两组大鼠尿量、层粘连蛋白、尿蛋白的变化情况Table 2 Changes of urine volume, laminin and protein content in the two rat groups
注:和对照组比较,*P< 0.05,**P< 0.01。
Note. Compared with the control group,*P< 0.05,**P< 0.01。
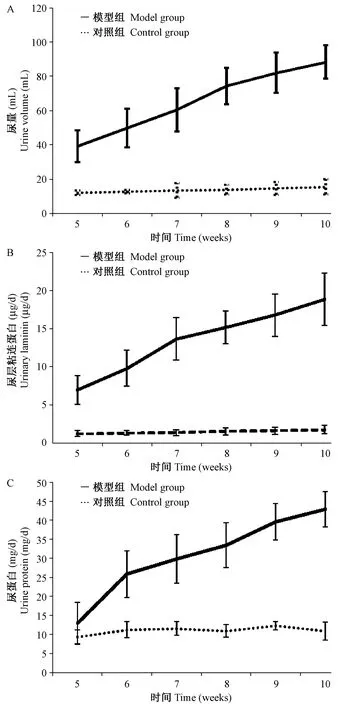
图1 两组大鼠的尿量、尿层粘连蛋白以及24 h尿蛋白的变化Figure 1 Changes in urine volume,laminin and 24-hour urinary protein levels in the two rat groups
2.3 肾病理改变
HE染色结果显示:模型组大鼠肾出现典型的病理改变,肾小球肥大,系膜增生,有微小血管瘤形成。肾小管管腔变形,管腔内散在有脱落的上皮细胞,间质内有纤维组织增生,还可见单核、淋巴等炎症细胞浸润,见图2。
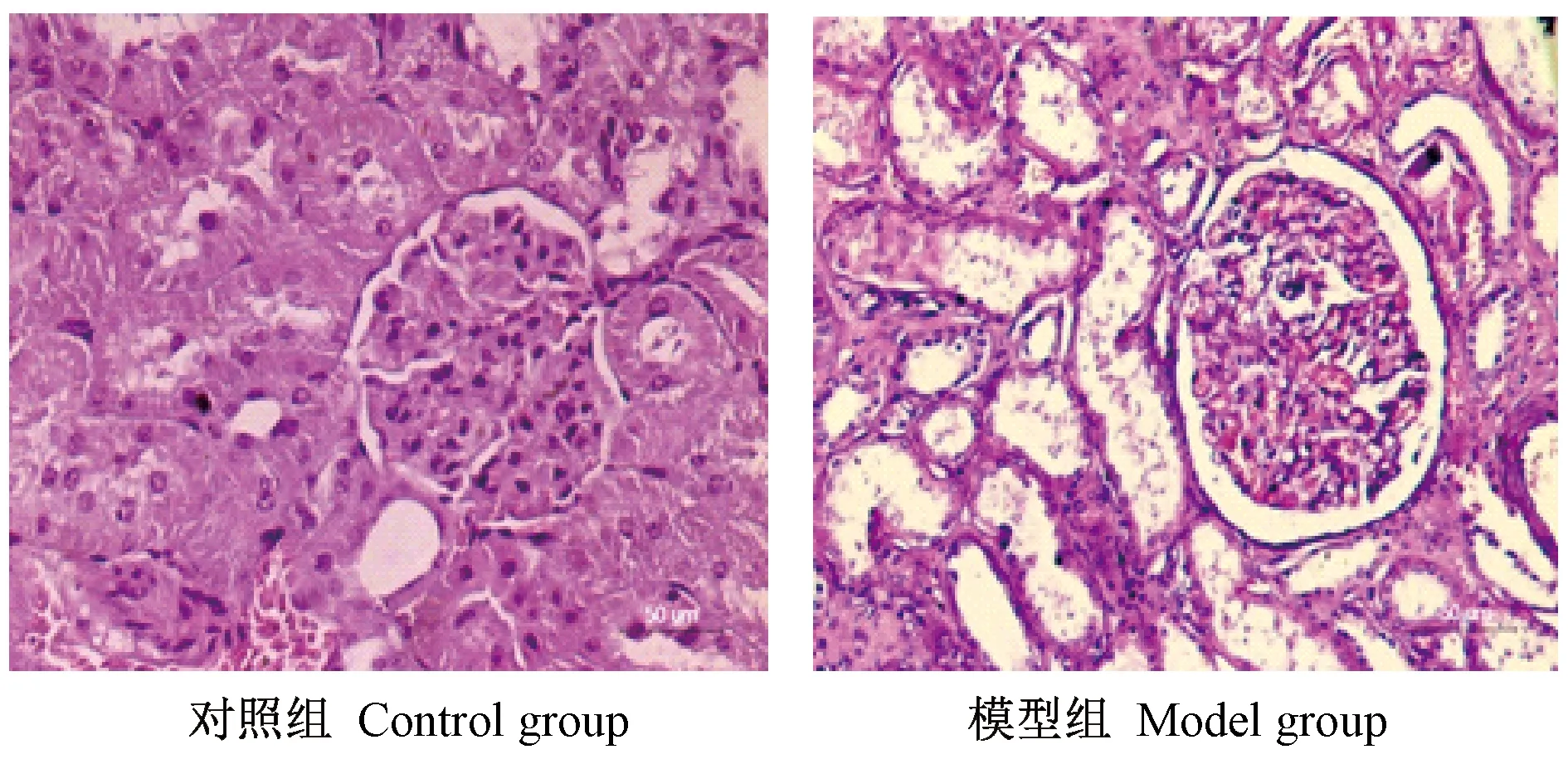
图2 大鼠肾组织的病理改变(×200) Figure 2 Pathological changes of kidney tissues (H&E staining, ×200)
2.4 肾组织Plin mRNA的检测结果
模型组肾组织Plin的mRNA表达明显升高,是对照组的(3.26 ± 0.37)倍,差异有显著性(P< 0.05),见图 3。
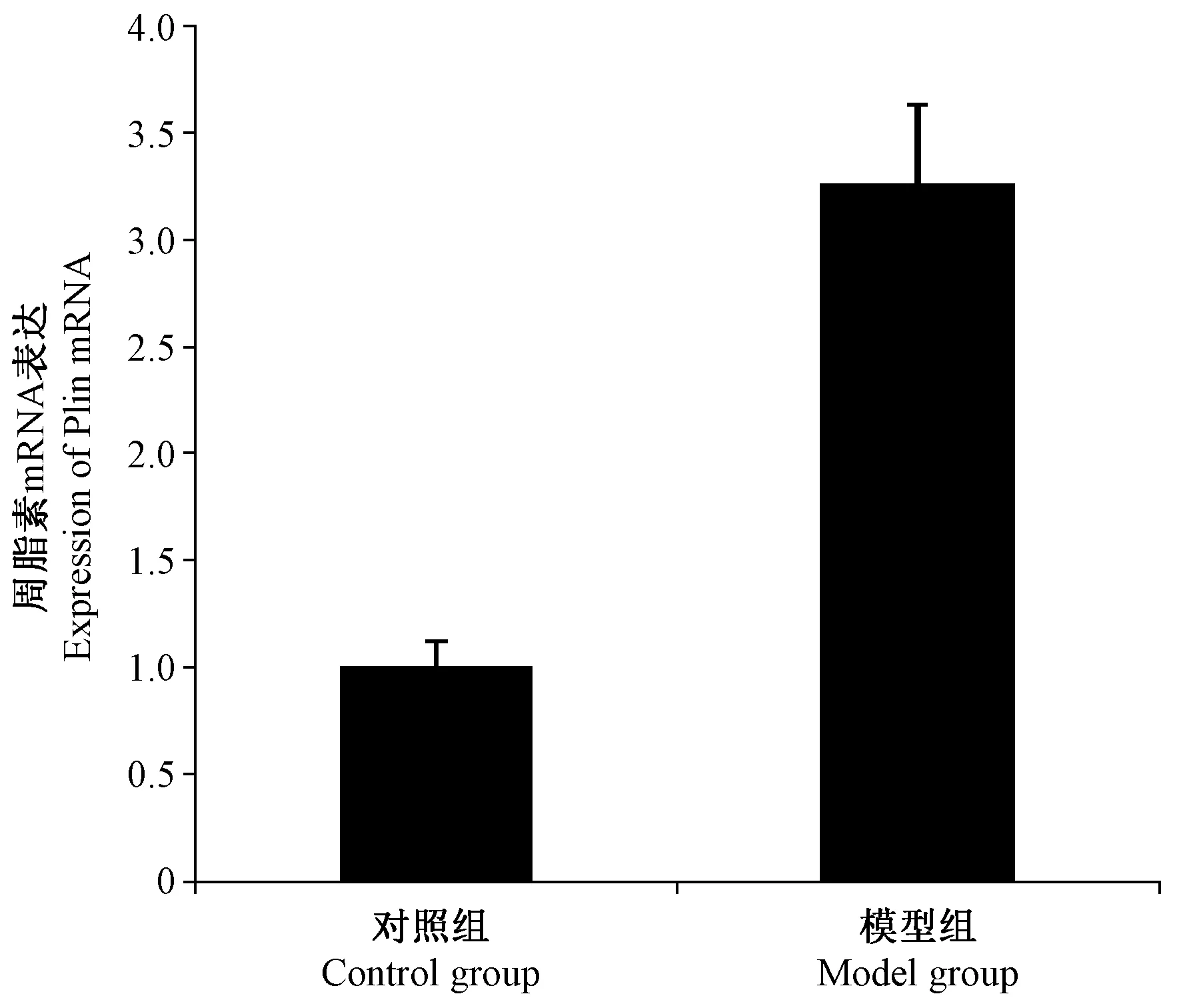
图3 大鼠肾Plin的qPCR检测结果Figure 3 Expression of Plin mRNA in the rat kidneys detected by qPCR
2.5 两组大鼠肾组织Plin蛋白Western blot检测结果
模型组Plin蛋白表达明显升高,是对照组的(2.98 ± 0.59)倍,差异有显著性(P<0.05),见图 4。
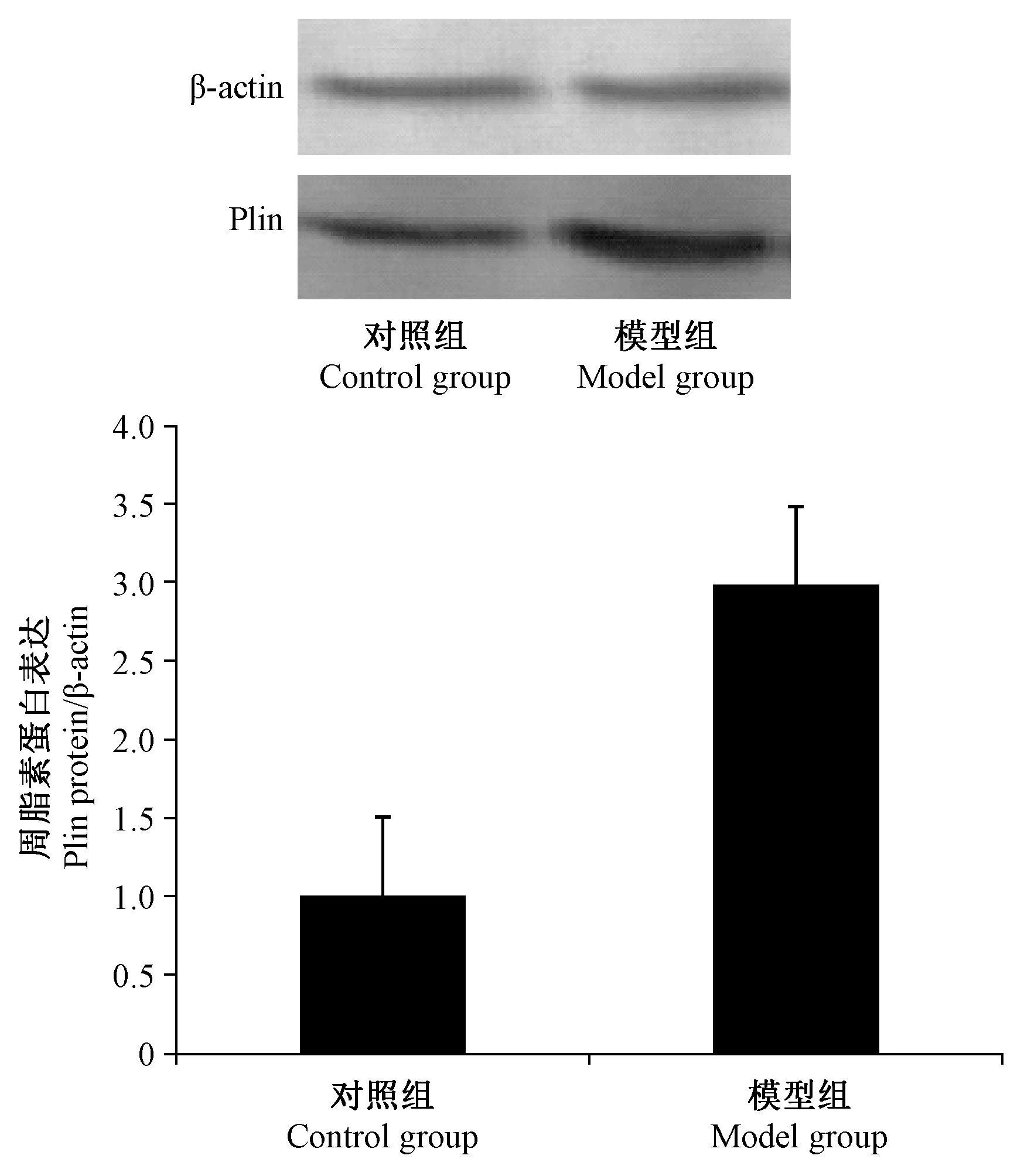
图4 两组大鼠肾组织Plin蛋白表达情况Figure 4 Expression of Plin protein in the rat kidneys
3 讨论
糖尿病肾病作为引起终末期肾病(end-stage renal disease,ESRD)主要病因[5],对人类生命健康构成了很大的威胁。其主要病理改变特点是微血管内皮细胞损伤导致基膜增厚,血管阻塞引起组织缺氧,继而肾小球硬化、肾间质纤维化,最终导致CRF。其发病机制也较复杂,涉及肾小球血流动力学改变、生化代谢紊乱、氧化应激、细胞因子与遗传易感性等多种因素,但其确切的发病机制尚未能完全阐明[6]。
对于DN大鼠模型的制作,目前最常使用单侧肾动脉结扎+高糖高脂饲料喂养 +小剂量STZ腹腔注射的三联法[7],该方法造模时间短,但有创伤性,手术本身对大鼠的发病过程存在影响。本研究通过高糖、高脂饲料诱导大鼠的胰岛素出现抵抗,再给予小剂量SZT破坏胰岛细胞,这样就可以达到仅出现胰岛素分泌障碍,而不是不分泌胰岛素的目的,很好的模拟了II型DM的发病过程[8]。在此基础上持续高脂饲料喂养使其病变继续发展,直至出现肾损害,达到DN病变。很好的模拟了DN的发生发展过程,但造模周期较长。造模结果显示DN组大鼠的肾重/体重比明显增高,24 h尿蛋白增高,HE染色出现典型的病理改变等,证明模型制作成功。
尿层粘连蛋白是ECM的主要成分,在肾小球间质纤维化中表达增高[3],实验结果显示模型组大鼠的尿LN增高比尿蛋白出现早,且随时间的推移不断升高。LN的分子量为900×103,属于大分子物质,DN早期肾小球滤过率增加,LN排除增加,且DM持续的高血糖刺激肾血管上皮细胞合成LN增多[9],DN早期LN增高的原因在于肾排除及合成LN增多。因此,尿LN能较早的反应DN肾ECM的变化,对DN的早期诊断有很好的警示作用。
Plin包被在细胞脂滴表面,对脂肪调节具有双重作用,主要通过双向调节脂滴内中性脂肪的水解来实现细胞内脂质的平衡:当细胞需要能量供应时,促进中性脂肪水解,能量充足时,则抑制脂肪水解,防止因过量脂肪酸堆积而引起脂毒性损伤[10]。另外,雌激素也能通过抑制Plin来减少肝细胞内的脂质沉积[11]。糖脂代谢异常往往相伴发生,故越来越多的学者开始研究Plin在糖代谢方面的作用,在糖代谢异常大鼠模型的肝脏组织中Plin表达增高,其可能促进了糖代谢异常合并非酒精性脂肪肝的发生[12]。在小鼠糖耐量模型中,Plin能够降低心脏的氧化应激反应进而使微血管内皮细胞的凋亡率降低[13]。这些研究结果提示Plin可能在DM 的并发症DN中也发挥着一定的作用,故本实验通过对DN模型大鼠肾组织Plin表达水平进行检测发现,Plin的mRNA及蛋白表达均有明显的增加,说明DN的发生和Plin的高表达有关,详细机制还需要做进一步的研究。

