MicroRNA-330靶向EGR-2基因抑制胃癌细胞生长和迁移*
赵蓉蓉, 付兆媛
(甘肃中医药大学附属医院 1检验科, 2肿瘤科, 甘肃 兰州 730000)
胃癌是最常见的消化系统恶性肿瘤之一,在过去的几十年里其发病率迅速上升[1]。在欧美、日本等发达国家由于医疗条件先进,胃癌患者5年生存率普遍高于我国[2]。我国大部分胃癌患者确诊时已是晚期,且该病易发生侵袭、转移,手术难以根除,只能采用传统保守化疗方式。而现有化疗药物绝大多数易产生耐药性,导致临床上治疗效果不佳以及预后不良[3]。胃癌仍然是导致我国居民死亡原因的重大疾病之一[4]。探索新型胃癌生物标志物和潜在治疗靶点是我国科技工作者的迫切任务。
最近研究显示,微小RNA(microRNA,miRNA,miR)在胃癌的发病和进展中扮演着重要角色[5-7],这为我们研究这种重大疾病的治疗靶点提供了潜在的方向。研究表明miRNAs的异常表达在胃癌的发病与恶性生物学表型,比如胃癌细胞的增殖[8]、侵袭[9]和迁移[10]等行为中发挥着至关重要的作用。miR-330广泛表达于各类型肿瘤中,且已有研究表明其表达水平与肿瘤的临床特征和预后相关[11-13]。但miR-330在不同肿瘤中作用并不一致,如miR-330在结直肠癌[11]、肺癌[12]和乳腺癌[13]组织中表达下调,并且可以抑制肿瘤进展;而另有研究发现miR-330在小细胞肺癌中表达上调,促进肿瘤恶性生物学行为[14]。尽管miR-330研究较多,且在不同肿瘤组织表达和作用不一致,但miR-330在胃癌研究中较少,因此,在本研究中我们探索miR-330在胃癌疾病发展中的生物学效应和意义,期待为理解胃癌的发病机理与治疗学提供新的实验依据。
材 料 和 方 法
1 材料与试剂
人胃癌细胞系BGC-823、SGC-7901和AGS及人胃黏膜上皮细胞GES-1均购自上海中国科学院细胞库。胎牛血清(fatal bovine serum,FBS)购自浙江天杭生物科技股份有限公司;DMEM培养基购自Gibco; Lipofectamine 3000购自Invitrogen; 8 μm孔径Transwell 24孔板购自Corning; CCK-8细胞试剂盒购自武汉艾美捷科技有限公司;抗GAPDH抗体和抗早期生长反应蛋白2(early growth response protein 2,EGR-2)抗体购自Santa Cruz;miR-330抑制剂(miR-330 inhibitor,miR-330-i)、miRNA抑制剂阴性对照(negative control miRNA inhibitor,NC-i)、miR-330模拟物(miR-330 mimic,miR-330-m)和miRNA模拟物阴性对照(negative control miRNA mimic,NC-m)购自上海吉玛制药技术有限公司。
2 样本收集
收集2015年6月~2017年6月甘肃中医药大学附属医院肿瘤科48例行胃镜检查摄取的胃癌组织及配对癌旁组织(距肿瘤边缘2.5 cm处胃黏膜组织)。所有患者均首次检验确定为胃癌,且患者确诊之前未进行过放化疗,并收集患者病理资料。
3 实验方法
3.1 细胞培养 胃癌细胞BGC-823、SGC-7901和AGS及人正常胃黏膜上皮细胞GES-1接种于含有10% FBS的DMEM培养基中,置于5% CO2、37 °C细胞培养箱内培养,每2 d 换1次液,每周按照1 ∶3传代。
3.2 miR-330 inhibitor/mimic的转染 取对数生长期BGC-823和SGC-7901细胞消化后,按照5×108/L的密度分别接种于6孔板中,待细胞70%融合,按照说明书步骤进行转染。取miR-330-i、NC-i、miR-330-m和NC-m分别在无血清培养基中结合Lipofectamine3000,然后分别转入无血清培养基的BGC-823、SGC-7901细胞中并孵育6 h,更换10% FBS的DMEM培养基继续培养48 h。
3.3 EGR-2-siRNA的转染 取已转染miR-330-m的BGC-823和SGC-7901细胞,按照说明书操作步骤,进一步转染NC-siRNA和EGR-2-siRNA,构建miR-330-m+NC-siRNA和miR-330-m+EGR-2-siRNA的BGC-823和SGC-7901细胞。
3.4 CCK-8法检测细胞活力 取已/未转染的BGC-823和SGC-7901细胞用无血清培养基同步化12 h后,按照每孔5×103细胞的密度接种于96孔板,分别培养24、48和72 h后,按照CCK-8试剂盒说明书操作步骤,弃培养基,每孔加入100 μL无血清DMEM培养基,然后每孔加入10 μL CCK-8试剂,37 °C反应1 h,酶标仪测定各孔在490 nm处的吸光度(A)值。
3.5 平板集落形成实验 取已/未转染的BGC-823和SGC-7901细胞无血清培养基同步化12 h后,按照每孔100细胞的密度接种于24孔板中,置37 ℃、5% CO2细胞培养箱中培养21 d,去除旧培养基,PBS轻柔洗2遍,甲醇固定30 min,用0.1%结晶紫进行染色,观察细胞集落数并拍照。
3.6 Transwell 细胞迁移分析 已/未转染的BGC-823和SGC-7901细胞无血清培养基同步化12 h后,按照每孔5×103细胞的密度接种于Transwell小室上槽腔中(24孔板,Transwell 的孔径为8 μm),密度为每孔5×104细胞(100 μL),并在下槽腔内加入600 μL含20% FBS培养基,置37 ℃、5% CO2细胞培养箱中继续培养24 h。取小室,小心擦除小室上槽腔上表面未迁移的细胞后,PBS漂洗2遍,置于90%乙醇中固定10 min,加0.1%结晶紫染色5 min,PBS漂洗3遍,Olympus IX73倒置显微镜下观察并拍照,并随机选5个视野进行细胞计数。
3.7 RT-qPCR检测 按照TRIzol说明书操作进行提取组织和细胞中总RNA。提取的总RNA以适宜体积DEPC水溶解,RNA 浓度用Qubit 2.0萤光计进行定量。以1 μg总RNA进行逆转录反应(总体系为10 μL),逆转录完成后按照SuperReal PreMix试剂盒说明书进行实时定量PCR(反应体系为20 μL),并用RT-qPCR的方法检测基因的表达。 miR-330的正向引物序列为5’-GTGGAGGCAACATCATTGCTG-3’,反向引物序列为5’-GCCACTGGTACATTGGTCACA-3’; U6的正向引物序列为5’-CTCGCTTCGGCAGCACA-3’,反向引物序列为5’-AACGCTTCACGAATTTGCGT-3’;EGR-2的正向引物序列为5’-CGGTGACCATCTTCCCCAAT-3’, 反向引物序列为5’-GAGCGAAGCTACTCGGATACG-3’;GAPDH的正向引物序列为5’-CACCCACTCCTCCACCTTTG-3’,反向引物序列为 5’-CCACCACCCTGTTGCTGTAG-3’。qPCR循环反应条件为94 ℃ 15 s、55 ℃ 30 s、74 ℃ 10 s,共35个循环。miR-330以U6为内参照,EGR-2以GAPDH为内参照,采用2-ΔΔCt法分析相对表达量。
3.8 Western blot实验 已/未转染的BGC-823和SGC-7901细胞经过相应的处理后,加入蛋白裂解液萃取细胞总蛋白。蛋白经常规SDS-PAGE、湿法电转、封闭后,室温孵育抗EGR-2抗体(1 2 000稀释)和抗GAPDH抗体(1 8 000稀释)1.5 h,洗膜后,室温孵育辣根过氧化物酶偶联的 II 抗(1 5 000稀释)1 h,洗膜后,化学发光法暗室显影,ImageJ 1.48u软件扫描灰度值。
3.9 双萤光素酶报告基因 使用miRanda靶基因预测数据库结合基因序列及功能,预测miR-330与EGR-2存在靶向结合序列。构建野生型EGR-2 WT-3’UTR-萤光素酶表达载体和突变型EGR-2 Mut-3’UTR-萤光素酶表达载体,并将其和miR-330 inhibitor/mimic转入细胞,孵育48 h。按照说明书进行操作,使用萤光素酶报告基因检测仪测定萤光素酶相对活性。
4 统计学处理
使用GraphPad Prism 6 软件进行分析。定量资料表示为均数±标准差(mean±SD)。两组资料和多组资料的比较分别采用双侧t检验和单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 miR-330在胃癌组织和胃癌细胞中的表达
RT-qPCR结果显示,与癌旁组织相比,miR-330在胃癌组织表达明显降低(P<0.05),见图1A;与人正常胃黏膜上皮细胞GES-1相比,miR-330在胃癌细胞中呈低表达(P<0.05),其中在低分化的BGC-823细胞中表达最低(P<0.05),中分化的SGC7901细胞表达次之(P<0.05),高分化的AGS细胞表达再次之(P<0.05),见图1B。进一步分析发现miR-330在胃癌组织中的表达水平与年龄和性别无相关性;而与肿瘤大小、淋巴结转移、病理分级和T分期呈负相关(P<0.05),见表1。这些结果提示miR-330低表达可能与胃癌的发生发展相关。
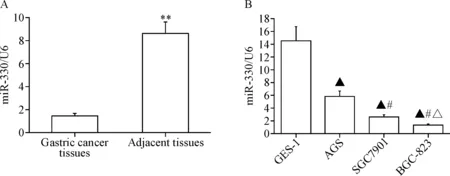
Figure 1. The expression of miR-330 in the gastric cancer tissues and gastric cancer cells. A: the expression level of miR-330 in the gastric cancer and adjacent tissues (n=48); B: the expression of miR-330 in GES-1 cells and different gastric cancer cell lines (n=3). Mean±SD.**P<0.01vsgrastric cancer tissues;▲P<0.05vsGES-1 cells;#P<0.05vsAGS cells;△P<0.05vsSGC7901 cells.
图1 miR-330在胃癌组织和胃癌细胞中的表达
2 miR-330表达对胃癌细胞生长的影响
检测miR-330-i和miR-330-m在胃癌细胞SGC7901和BGC-823转染效率,结果见图2A。采用CCK-8法检测miR-330表达对胃癌细胞活力的影响,结果显示,转染miR-330 inhibitor后,细胞活力显著升高(P<0.05);转染miR-330 mimic后,细胞活力显著降低(P<0.05),见图2B,提示miR-330高表达可以抑制胃癌细胞的生长。进一步采用平板集落形成实验评估miR-330在胃癌细胞生长的长期效应,结果显示,转染miR-330 inhibitor后,细胞集落数升高(P<0.05);转染miR-330 mimic后,细胞集落数降低(P<0.05),见图2C。

表1 miR-330表达与胃癌临床病理特征的关系
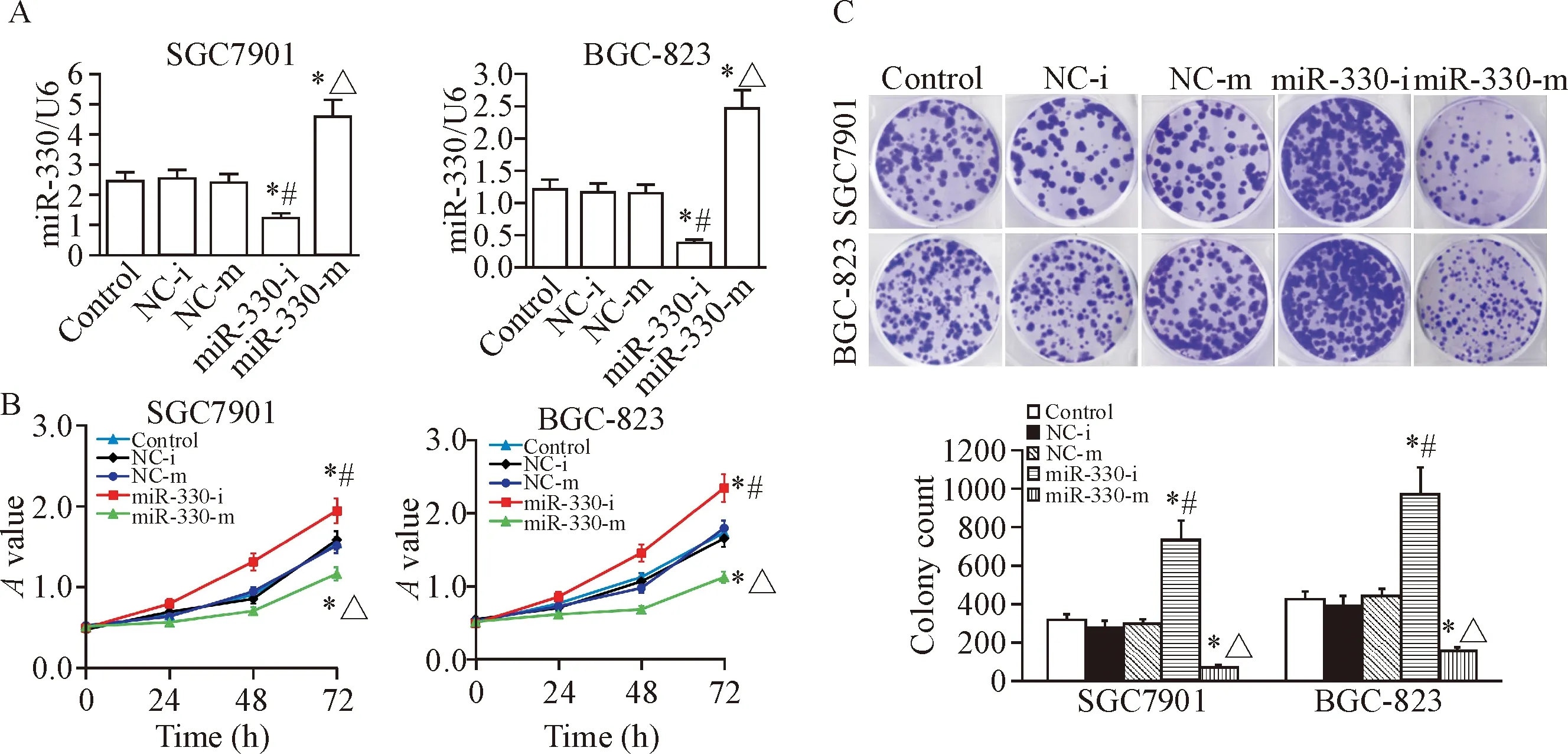
Figure 2. The effect of miR-330 on the growth of gastric cancer cells. A: the transfection efficiency of miR-330 inhibitor (miR-330-i) and miR-330 mimic (miR-330-m) in the SGC7901 cells; B: the viability of gastric cancer SGC7901 cells and BGC-823 cells after transfected with miR-330 inhibitor or miR-330 mimic deternimed by CCK-8 assay; C: the colony formation of gastric cancer SGC7901 cells and BGC-823 cells after transfected with miR-330 inhibitor or miR-330 mimic deternimed by plate colony formation assay. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC-i group;△P<0.05vsNC-m group.
图2 miR-330对胃癌细胞生长的影响
3 miR-330表达对胃癌细胞迁移的影响
采用Transwell法检测miR-330表达对胃癌细胞迁移能力的影响,结果显示,转染miR-330 inhibitor后,细胞迁移数量显著升高(P<0.05);转染miR-330 mimic后,细胞迁移数量显著降低(P<0.05),见图3。这提示miR-330高表达可以抑制胃癌细胞的迁移能力。
4 EGR-2是miR-330的直接作用靶点
miRanda预测数据库显示miR-330与EGR-2的3’-UTR存在结合序列,图4A。双萤光素酶报告基因验证EGR-2是miR-330的靶基因,见图4B。同时,检测到EGR-2的mRNA和蛋白在胃癌组织(图4C、D)和胃癌细胞(图4E、F)中低表达(P<0.05)。

Figure 3. The numbers of migratory gastric cancer cells after transfected with miR-330 inhibitor (miR-330-i) or miR-330 mimic (miR-330-m) deternimed by Transwell assay (×200). Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC-i group;△P<0.05vsNC-m group.
图3 Thanswell实验检测miR-330对胃癌细胞迁移能力的影响
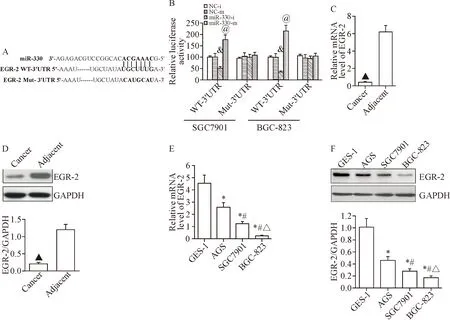
Figure 4.EGR-2gene was the direct target of miR-330. A: the 3’ UTR of EGR-2 mRNA had a putative binding site of miR-330; B: the relative luciferase activity of reporter plasmids carrying wild-type (WT) or mutant (Mut) EGR-2 3’UTR in the SGC7901 cells and BGC-823 cells co-transfected with miR-330 inhibitor (miR-330-i) or miR-330 mimic (miR-330-m); C and D: the mRNA and protein levels of EGR-2 in the gastric cancer tissues and adjacent tissues; E and F: the mRNA and protein levels of EGR-2 in the GES-1 cells and different gastric cancer cell lines. Mean±SD.n=3 in B, E and F;n=48 in C and D.&P<0.05vsNC-i group;@P<0.05vsNC-m group;▲P<0.05vsadjacent tissues;*P<0.05vsGES-1 cells;#P<0.05vsAGS cells;△P<0.05vsSGC7901 cells.
图4 验证EGR-2基因为miR-330的直接靶基因
5 miR-330表达对EGR-2表达的影响
采用RT-qPCR和Western blot检测miR-330表达对胃癌SGC7901细胞和BGC-823 细胞EGR-2表达的影响,结果显示转染miR-330 inhibitor后,胃癌SGC7901细胞和BGC-823 细胞的EGR-2 mRNA和蛋白表达降低(P<0.05);转染miR-330 mimic后,胃癌SGC7901细胞和BGC-823 细胞的EGR-2 mRNA和蛋白表达升高(P<0.05),见图5。
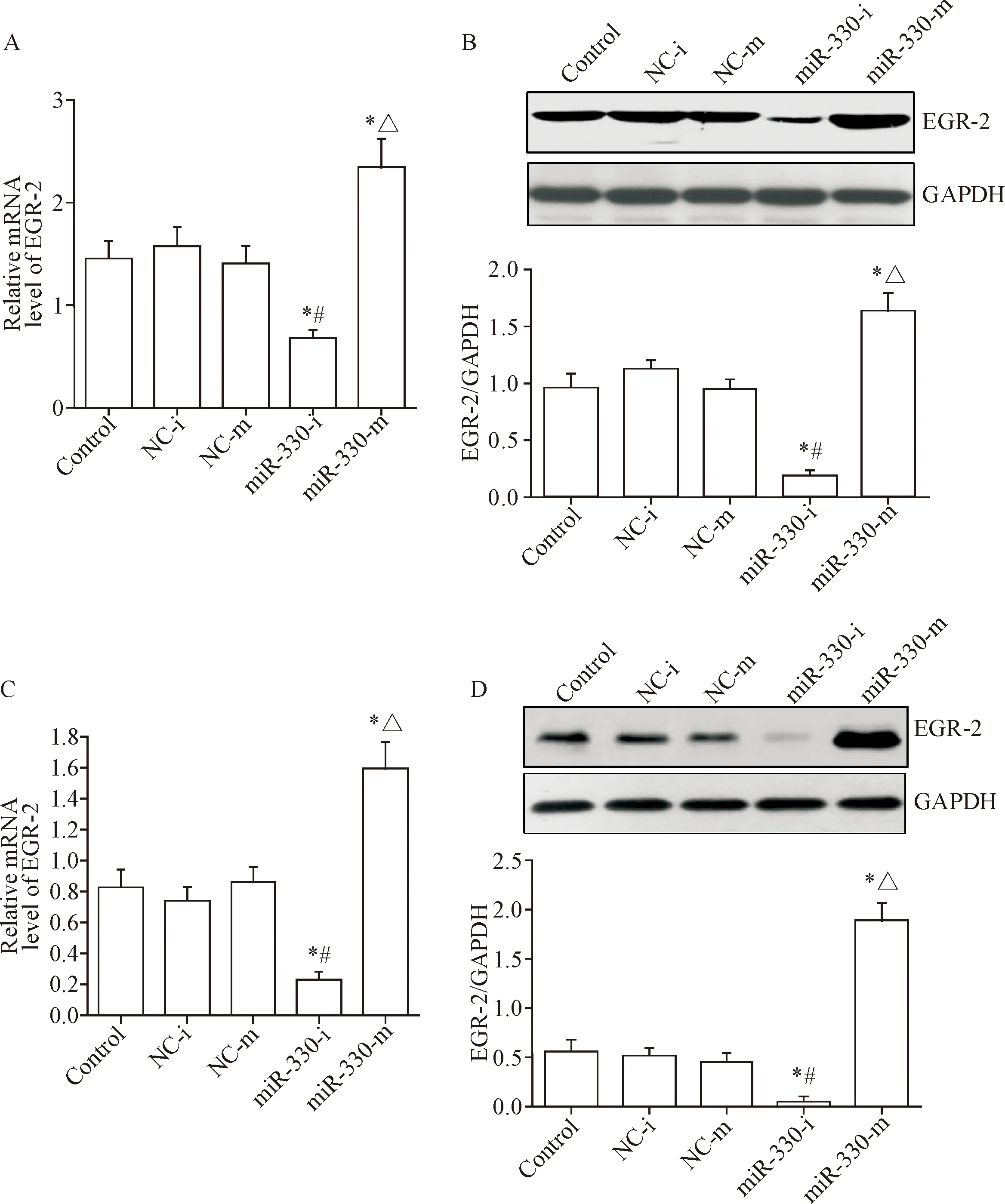
Figure 5. The effect of miR-330 expression on EGR-2 expression. A and B: the expression of EGR-2 at mRNA and protein levels in the SGC7901 cells after transfected with miR-330 inhibitor (miR-330-i) or miR-330 mimic (miR-330-m); C and D: the expression of EGR-2 at mRNA and protein levels in the BGC-823 cells after transfected with miR-330 inhibitor or miR-330 mimic. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vsNC-i group;△P<0.05vsNC-m group.
图5 miR-330表达对EGR-2表达的影响
6 用siRNA敲减EGR-2表达促进胃癌细胞的生长与迁移
与miR-330-m+NC-siRNA组相比,miR-330-m+EGR-2-siRNA组胃癌细胞活力显著升高(P<0.05),见图6A,迁移能力显著增强(P<0.05),见图6B。
讨 论
近年来,研究表明众多miRNAs参与调控胃癌的发生与进展,但是miRNA的具体的分子机制研究尚未完善[11]。因此,对参与调控胃癌的miRNAs的进一步功能鉴定以及具体机制的探讨将会拓展对胃癌的诊断和治疗。miR-330在不同类型肿瘤中有着显著的表达差异[11-14],这提示miR-330在不同肿瘤的异常表达具有一定的组织和细胞特异性,可能与细胞微环境有着密切的关系。这为研究miR-330在胃癌特异性表达和作用指明方向。本研究中采用RT-qPCR方法检测到胃癌组织中miR-330在胃癌组织低表达;同时检测到miR-330在胃癌细胞上低表达,且表达水平与胃癌细胞分化程度有关,在低分化的BGC-823细胞上表达最低。进一步通过病理特征分析发现,miR-330表达与肿瘤大小、淋巴结转移、病理分级和T分期呈负相关,因此,推测miR-330可能与胃癌进展相关。在SGC7901细胞和BGC-823 细胞转染miR-330 inhibitor能促进胃癌细胞活力、细胞集落形成和迁移能力,而转染miR-330 mimic能抑制胃癌SGC7901细胞和BGC-823 细胞的细胞活力、集落形成和迁移能力,提示miR-330在胃癌发挥抑癌基因的作用,可成为胃癌诊断和治疗的一个潜在靶点。

Figure 6. Knock-down ofEGR-2expression by siRNA promoted the viability and migration ability of gastric cancer cells transfected with miR-330 mimic (miR-330-m). A: the effect of EGR-2-siRNA on the viability of gastric cancer SGC7901 cells and BGC-823 cells transfected with miR-330 mimic deternimed by CCK-8 assay; B: the effect of EGR-2-siRNA on the migration ability of gastric cancer cells transfected with miR-330 mimic deternimed by Transwell assay (×200). Mean±SD.n=3.*P<0.05vsmiR-330-m+NC-siRNA group.
图6 EGR-2-siRNA促进miR-330 mimic转染的胃癌细胞活力与迁移能力
另外,本研究检测到EGR-2在胃癌组织和胃癌细胞的mRNA和蛋白水平呈低表达,且胃癌SGC7901细胞和BGC-823 细胞转染miR-330 inhibitor后,EGR-2 的mRNA和蛋白水平降低;胃癌细胞转染miR-330 mimic后,EGR-2的mRNA和蛋白水平升高。EGR-2可反式调控细胞的增殖、分化、细胞凋亡及转移等生物学行为[15-16]。比较直接的证据提示EGR-2在一些肿瘤细胞中对细胞的增殖和侵袭迁移起负调节作用[17]。EGR-2在骨肉瘤细胞低表达可以促进细胞的增殖[18]。近来有报道称,EGR-2在胃癌组织低表达,过表达EGR-2可以抑制miR-17-5p表达,抑制胃癌细胞增殖和迁移[19]。miRNAs通过调控靶基因mRNAs的翻译来发挥生物学效应[20]。为验证miR-330与EGR-2的关系,本研究通过miRanda预测靶基因软件发现miR-330与EGR-2存在靶向结合片段,且已有研究在非小细胞肺癌证明了miR-330与EGR-2的靶向关系[21],本研究进一步采用双萤光素酶报告基因验证在胃癌细胞EGR-2是miR-330的靶基因。进一步研究发现,EGR-2-siRNA能逆转miR-330 mimic转染的胃癌细胞的活力与迁移能力,说明miR-330调节胃癌细胞生长和迁移是通过靶向调节靶基因EGR-2来实现的。
综上所述,本研究结合以往文献提示miR-330通过促进靶基因EGR-2的表达抑制胃癌的生长和转移。因此,我们的研究提示miR-330或许可以作为胃癌的一个诊断指标和治疗靶点。

