乳酸片球菌ZPA017发酵合成γ-氨基丁酸的条件优化
刘 辉, 季海峰, 王四新, 张董燕, 王 晶, 张 伟, 王雅民, 王帅钦
(北京市农林科学院畜牧兽医研究所,北京 100097)
γ-氨基丁酸(GABA)是广泛存在于动植物及微生物细胞中的一种非蛋白氨基酸,是哺乳动物中枢神经系统中重要的抑制性神经递质,具有镇静、降血压、改善脑机能和脂质代谢等多种生理功能(Diana 等,2014;Jakobs等,1993)。有研究表明,GABA作为饲料添加剂应用于动物生产,能够提高动物生产性能、改善胴体品质、提高抗热应激及机体抵抗能力(施忠秋和齐智利,2014;沈名灿等,2012; Zendehdel等,2009;胡家澄等,2008),在饲料工业中展现出了良好的应用前景。
目前,GABA的生产制备主要采用微生物发酵的方法(Wang 等,2003;Kono 等,2000),乳酸菌是其中一类重要的生产菌种 (Dhakal等,2012;Li等,2010)。乳酸菌是动物肠道的正常菌群,被认为是可直接饲喂且安全的微生物(GRAS),也是目前应用最为广泛、效果较好的一类饲用微生物。Siragusa等(2007)研究发现,乳酸菌具有较强的GABA发酵能力。
本研究以一株能够合成GABA的乳酸片球菌ZPA017为研究对象,采用单因素筛选和响应面试验法,对其发酵合成GABA的发酵培养基和发酵条件进行优化,以期提高ZPA017的GABA产量,为进一步深入研究和开发饲用益生菌提供理论依据。
1 材料与方法
1.1 菌种与基础培养基 乳酸片球菌ZPA017:分离自健康北京黑猪粪便,由中国普通微生物菌种保藏管理中心鉴定并保存于本研究室。
基础培养基(MRS培养基):葡萄糖20 g/L、蛋白胨10 g/L、牛肉膏10 g/L、酵母膏5 g/L、柠檬酸氢二铵2 g/L、磷酸氢二钾2 g/L、乙酸钠5 g/L、硫酸镁 0.58 g/L、硫酸锰0.19 g/L、吐温-80 1 mL/L,调节pH为6.5,121℃灭菌15 min。
1.2 方法
1.2.1 发酵方法 将-80℃保存的菌种,连续两次复壮后按1%的接种量接种于装有100 mL灭菌液体培养基的500 mL三角瓶中,37℃静置培养24 h。
1.2.2 GABA的测定方法 参考窦海艳(2010)的方法,采用Berthelot比色法检测GABA的含量:取不同浓度的GABA标准液和处理后的发酵液上清液0.4 mL,加入0.1 mL 1 mol/L的碳酸钠溶液、0.5 mL 0.2 mol/L的四硼酸钠溶液、1 mL 6%苯酚、1 mL 10%次氯酸钠溶液,摇匀后静置10 min。沸水浴10 min后冰浴20 min,待溶液出现蓝绿色后,加入2 mL 60%的乙醇溶液,摇匀后静置30 min。640 nm波长处测定吸光值,依据标准曲线计算GABA含量。
1.2.3 发酵培养基优化
1.2.3.1 单因素试验法筛选培养基碳氮源及碳氮比 在MRS培养基的基础上,固定其他成分,选取不同的碳氮源分别取代MRS培养基中的碳氮源,研究不同碳氮源对GABA产量的影响,筛选出发酵培养基的最优碳氮源,并在此基础上筛选出发酵培养基的最优碳氮比。
1.2.3.2 响应面法优化培养基配方 以GABA质量浓度为响应指标,采用3步进行优化:首先采用Plackett-Burman试验确定对响应值影响显著的主要因素;然后进行最陡爬坡试验确定试验因素的中心点;最后运用Minitab软件采用Box-Behnken法创建响应面设计,进行响应面分析,确定最优培养基配方,并进行验证试验。
1.2.4 发酵条件的优化 在优化发酵培养基的基础上,采用单因素试验法研究发酵温度、初始pH、接种比例和发酵时间等培养条件对GABA产量的影响,确定最优发酵条件。
2 结果与讨论
2.1 发酵培养基单因素试验结果
2.1.1 不同碳源对GABA产量的影响 碳源物质是培养基的主要组分之一,是构成菌体合成GABA的碳架及能量来源。由图1可知,乳酸片球菌ZPA017可以利用多种碳源合成GABA,但利用率不同,产量不一。当以D-果糖为碳源时,GABA产量最高,因此将D-果糖作为乳酸片球菌发酵合成GABA的最适碳源。
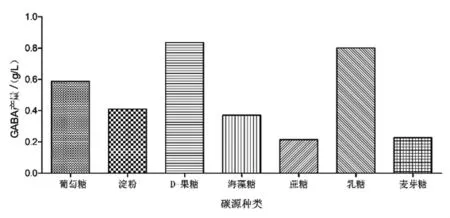
图1 不同碳源对GABA的影响
2.1.2 不同氮源对GABA产量的影响 氮源是组成菌体核酸和蛋白质的重要元素,对微生物的生长发育有着重要作用。由图2可知,当以大豆蛋白胨作为氮源时,乳酸片球菌的GABA产量明显高于其他氮源,因此选择大豆蛋白胨作为最优氮源。
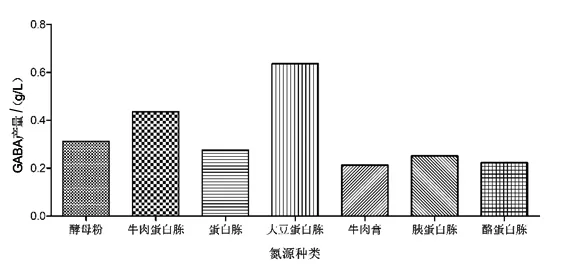
图2 不同氮源对GABA的影响
2.1.3 不同碳氮比对GABA产量的影响 碳氮比过高和过低都不利于细胞生长和代谢产物的合成,适当的碳氮比例有助于微生物发酵分解。由图3可知,当碳氮比为1∶2时,GABA的产量最高,因此选择1∶2作为发酵培养基的初始碳氮比。
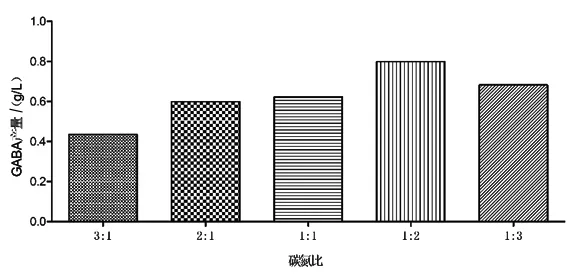
图3 不同碳氮比对GABA的影响
2.1.4 响应面法优化培养基
2.1.4.1 Plackett-Burman(P-B)试验设计筛选显著影响因子 选用N=12的P-B试验设计,以乳酸片球菌GABA产量为响应值,筛选出对GABA产量影响显著的培养基成分。试验选择7个因素:D-果糖(X1)、大豆蛋白胨(X2)、乙酸钠(X4)、磷酸氢二钾(X5)、柠檬酸氢二铵(X7)、硫酸镁(X8)和硫酸锰(X10),外加 3 个虚拟变量(X3、X6、X9)。 试验设计及结果见表1,各因素水平及主效应分析见表2。
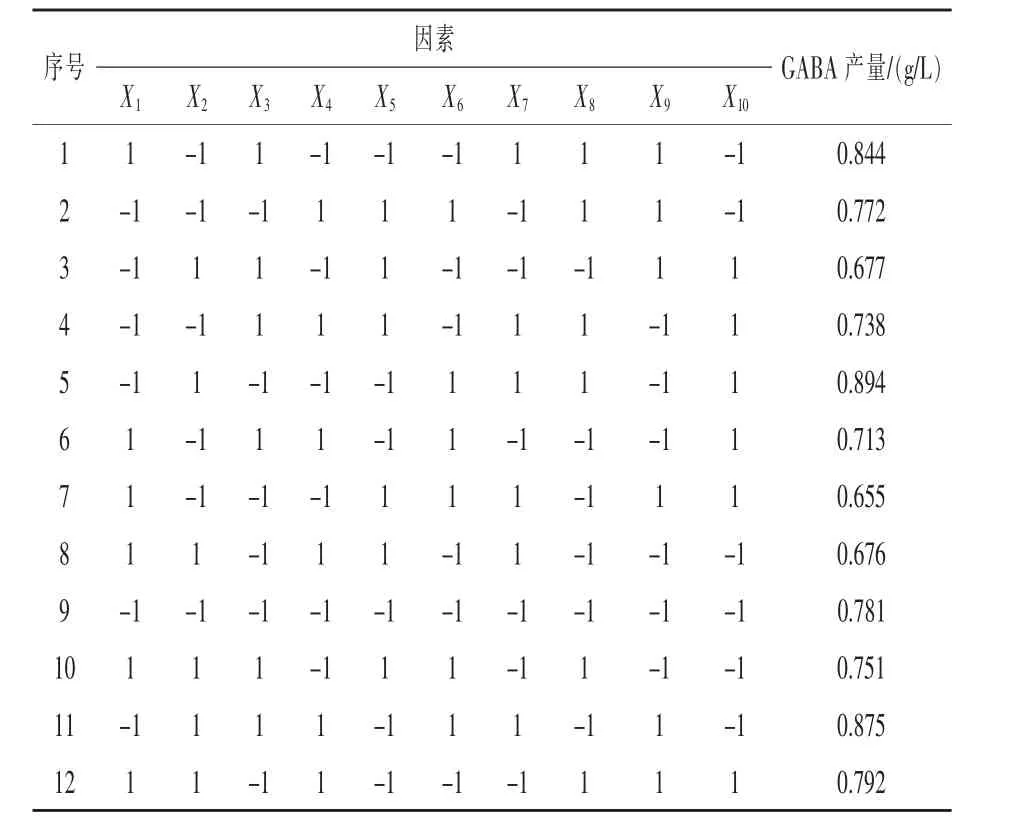
表1 Plackett-Burman试验设计及响应值
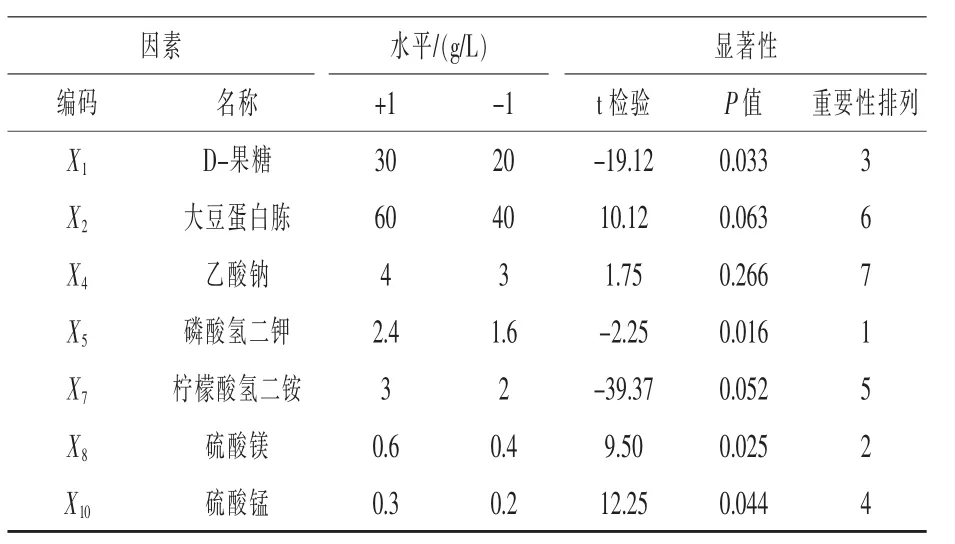
表2 Plackett-Burman试验结果分析
由表2可以看出,在这7个因素的主效应中,对结果产生正效应的因素有大豆蛋白胨、乙酸钠、硫酸镁和硫酸锰,对结果产生负效应的因素有D-果糖、磷酸氢二钾和柠檬酸氢二铵。在95%的水平上磷酸氢二钾、硫酸镁、D-果糖和硫酸锰差异显著,其他因素在这个水平上差异不显著。将负效应的因素固定在-1水平,正效应的因素固定在+1水平,选取磷酸氢二钾、硫酸镁、D-果糖和硫酸锰这4个显著因素进行下一步试验。
2.1.4.2 最陡爬坡试验设计确定重要影响因素的水平 对P-B试验设计筛选得到的显著影响因素进行最陡爬坡试验,确定最陡爬坡试验的方向和梯度,进而确定试验因素的中心点。试验设计及结果见表3。由表3可以看出,随着硫酸镁和硫酸锰质量浓度升高、磷酸氢二钾和D-果糖质量浓度的降低,GABA产量呈先上升后下降的变化趋势,产量最高的响应值区域在第4组试验,因此以第4组因素的水平作为响应面试验设计的中心点,即磷酸氢二钾1.4 g/L、硫酸镁0.65 g/L、D-果糖19 g/L和硫酸锰0.31 g/L。
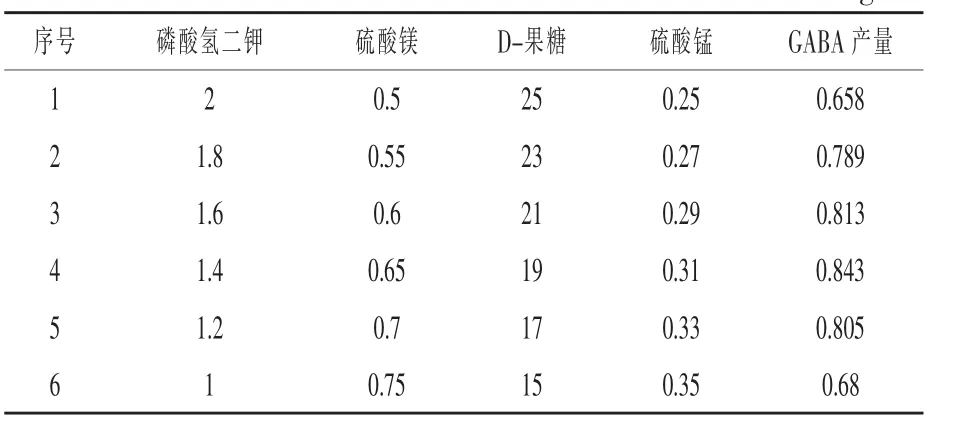
表3 最陡爬坡试验设计及结果 g/L
2.1.4.3 响应面分析法确定最大响应值 根据P-B试验、最陡爬坡试验,以及Box-Behnken的中心组合设计原理,设计4因素3水平的响应面试验,以磷酸氢二钾、硫酸镁、D-果糖和硫酸锰4个因素为自变量,以GABA的产量为响应值,根据最陡爬坡试验的结果确定试验中心和水平。试验因素与水平的选取见表4,Box-Behnken试验设计及结果见表5。
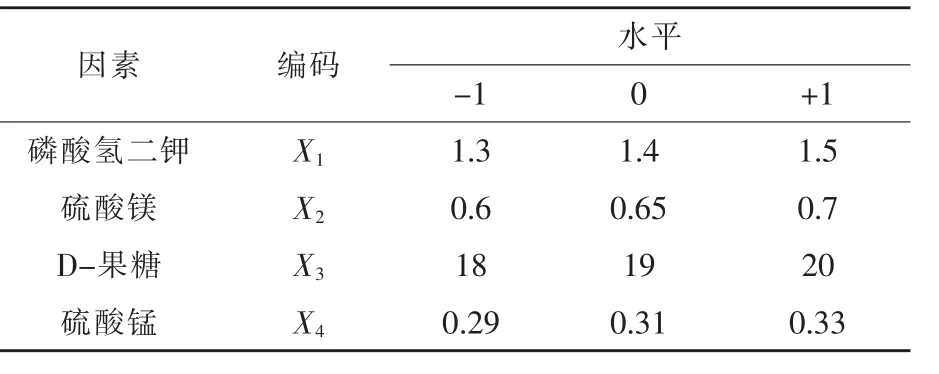
表4 Box-Behnken试验因素与水平
根据表5结果,用Minitab 16软件对数据进行二次回归分析,得到的回归方程为:
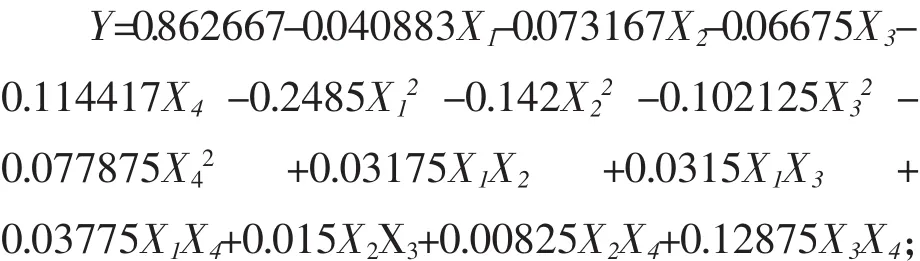
式中:Y为乳酸片球菌GABA产量的预测响应值;X1、X2、X3、X4分别为磷酸氢二钾、 硫酸镁、D-果糖和硫酸锰的编码值。
由 表 6 可 以 看 出 ,X1、X2、X3、X4、X12、X22、X32、X42、X3X4对 GABA 产量有显著的影响(P < 0.05)。由表7可知,回归方程P<0.01,失拟项P>0.05,说明所得数据拟合效果较好;相关系数R2=95.47%,R2(调整)=90.18%,说明模型相关度很好。所以,此模型可以用来分析和预测GABA的产量。
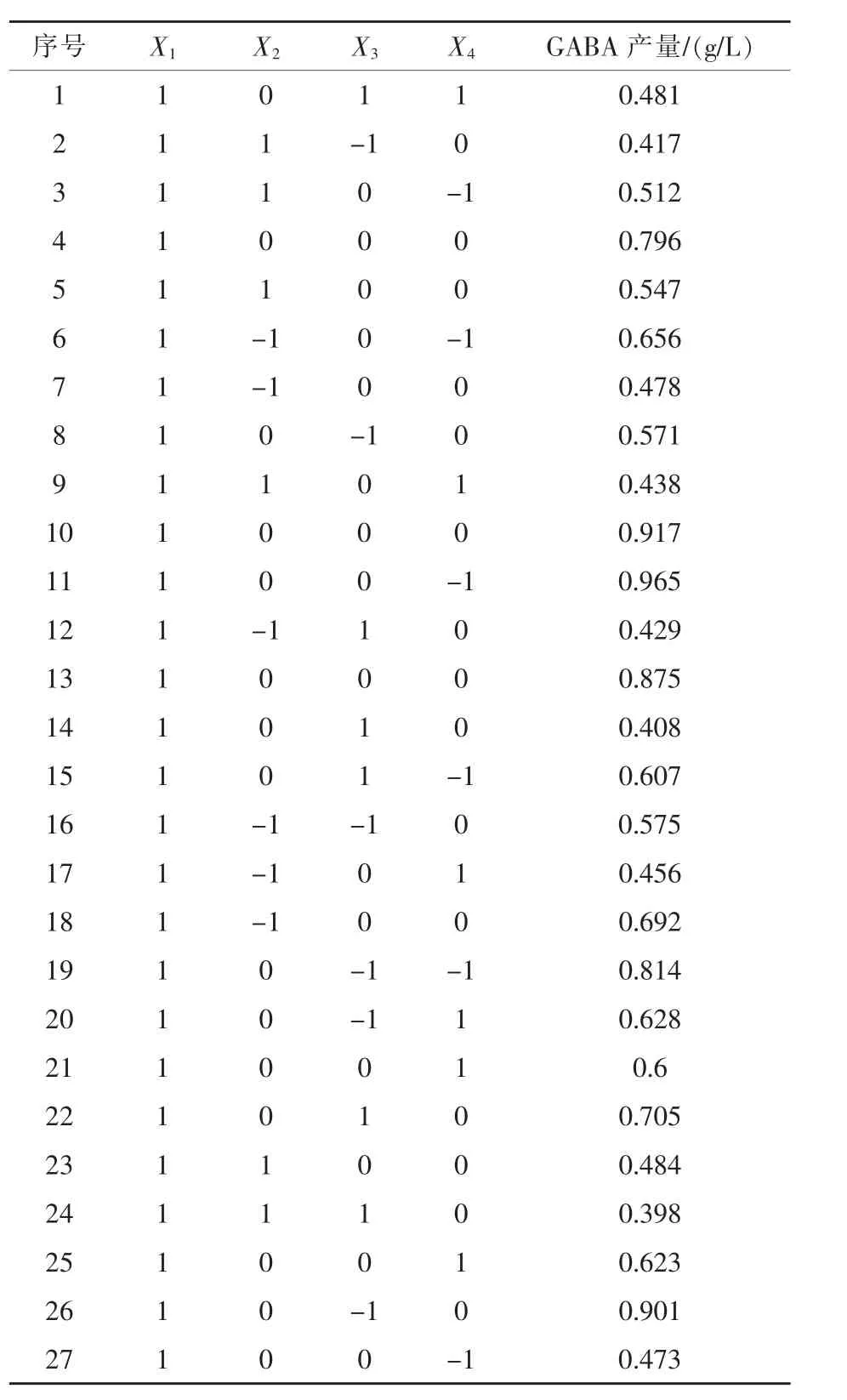
表5 Box-Behnken试验设计及结果
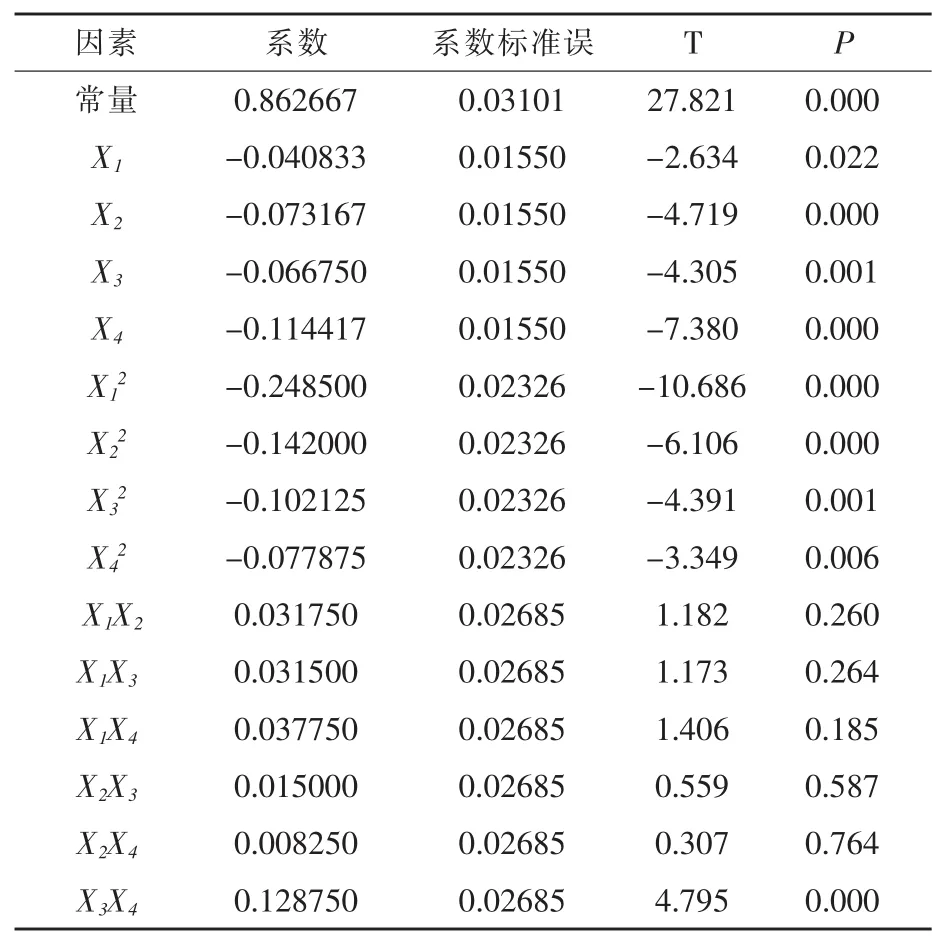
表6 回归方程中回归系数的估计值
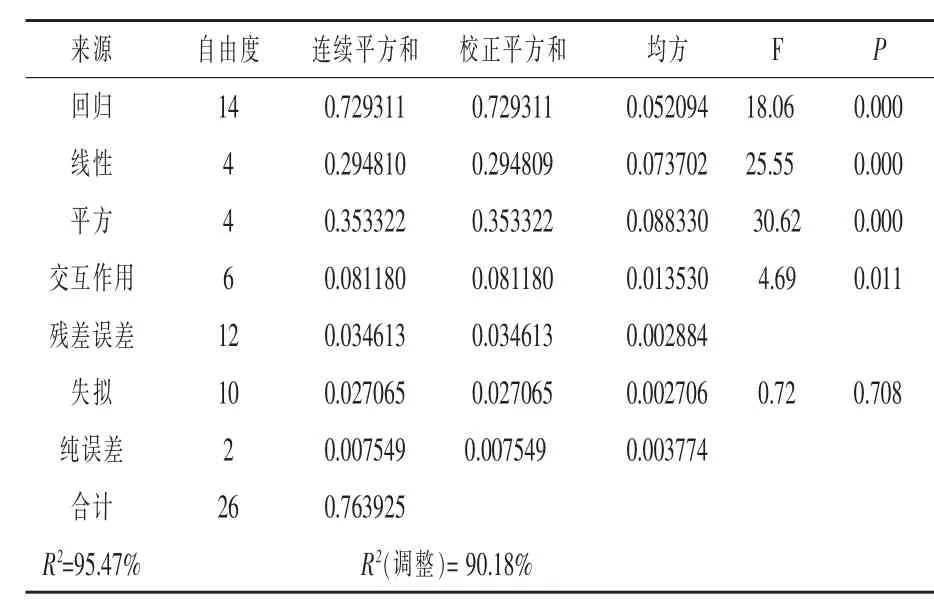
表7 回归方程的方差分析
根据上述回归方程绘出响应面分析图及等高线图,以确认磷酸氢二钾、硫酸镁、D-果糖和硫酸锰4个因素对GABA产量的影响,响应面图和等高线图见图4。由图及软件分析可知所得拟合回归方程存在稳定点,即极大值点。根据Minitab软件得到的回归方程,可计算得到GABA产量的最大预测值为1.0237 g/L,此时4个因素的质量浓度为:磷酸氢二钾1.3747 g/L、硫酸镁0.6313 g/L、D-果糖18 g/L、硫酸锰0.29 g/L。
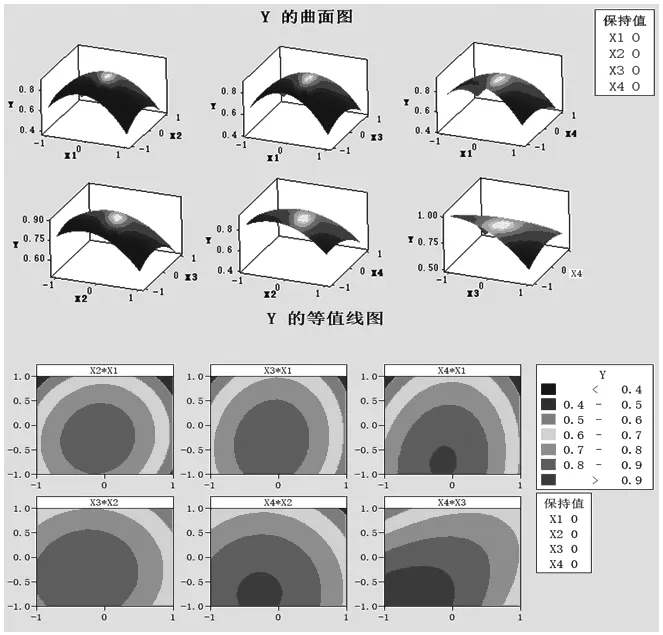
图4 各因素交互作用响应面分析图与等高线图
2.1.4.4 验证试验 为了验证模型预测的准确性,采用优化培养基重复试验3次,结果乳酸片球菌发酵液中的GABA平均产量为1.006 g/L,与响应面预测的最大产量1.0237 g/L接近,误差为1.76%,这表明该模型能够很好地预测试验结果。
由上得到乳酸片球菌ZPA017的最佳发酵培养基为:磷酸氢二钾1.37 g/L、硫酸镁0.63 g/L、D-果糖18 g/L、硫酸锰0.29 g/L、大豆蛋白胨40 g/L、乙酸钠3 g/L、柠檬酸氢二铵2 g/L、吐温-80 1 mL/L。
2.2 发酵条件的确定
2.2.1 发酵温度 不同温度(25、28、30、32、35、37、40℃和42℃)对乳酸片球菌ZPA017发酵合成GABA的影响见图5。由图5可知,培养温度对乳酸片球菌ZPA017发酵合成GABA具有明显的影响,较高或较低的温度均不利于GABA的合成,当温度为37℃时,GABA的产量最高(为1.005 g/L),因此将37℃作为该菌株产GABA的最适发酵温度。
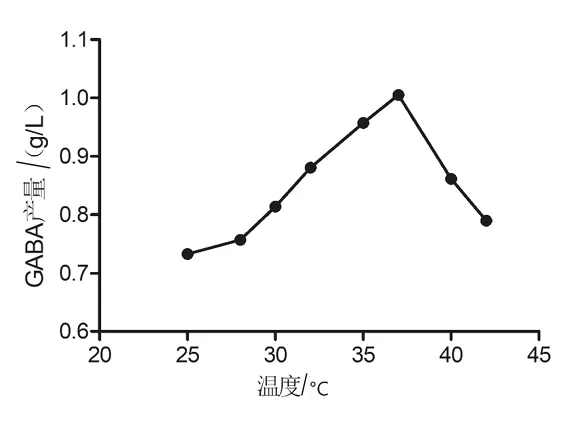
图5 不同温度对GABA的影响
2.2.2 初始 pH 不同培养基初始 pH(5.0、5.5、6.0、6.5、7.0、7.5 和 8.0) 对乳酸片球菌 ZPA017 发酵合成GABA的影响见图6。结果表明,乳酸片球菌ZPA017合成GABA的最适初始pH为6.5,初始pH增大或减小均会影响GABA的合成。这可能是因为培养基的pH可通过改变菌体膜表面电荷影响菌体对营养物质的吸收,从而影响菌体的生长和体内GABA的合成。
2.2.3 接种比例 不同接种比例 (0.1%、0.2%、0.5%、1%、3%和5%)对乳酸片球菌ZPA017合成GABA的影响见图7。由图7可以看出,当接种比例为1%时GABA的产量最高,为1.019 g/L,因此将1%作为该菌株发酵合成GABA的最佳接种比例。
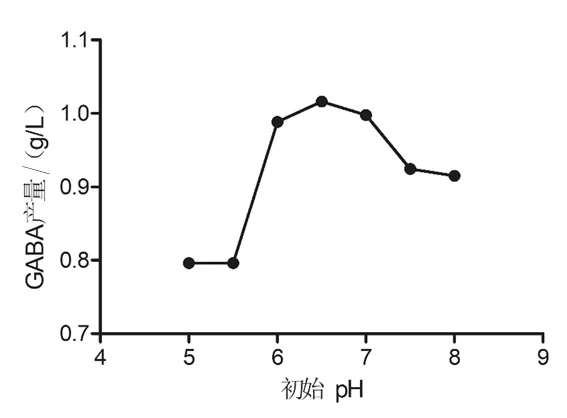
图6 不同初始pH对GABA的影响
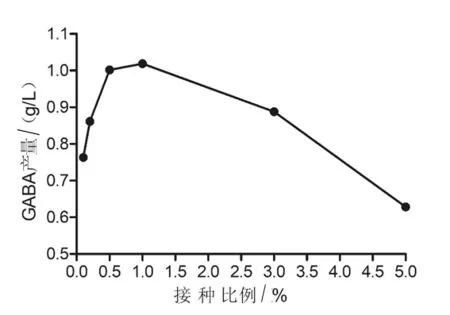
图7 不同接种比例对GABA的影响
2.2.4 发酵时间 不同发酵时间(6、18、24、30、42、48、60 h 和 72 h)对乳酸片球菌 ZPA017 合成GABA的影响见图8。由图8可知,当培养开始后,GABA的产量随着发酵时间的延长而提高;当培养到30 h时,GABA产量达到1.036 g/L;此后,发酵液中的GABA含量趋于稳定。这可能是因为随着培养基中的营养物质被消耗和代谢产物的增加,菌体活力下降并进入衰亡期,GABA的合成也逐渐停止。综上,将GABA生物合成量较高的30 h作为该菌株发酵合成GABA的最佳培养时间。
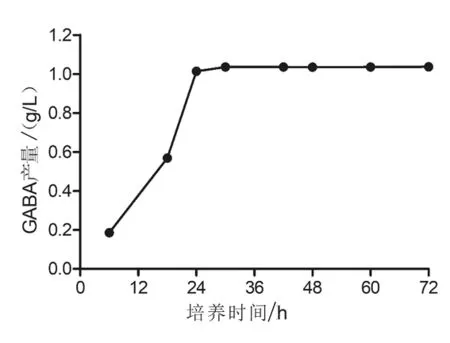
图8 不同发酵时间对GABA的影响
3 结论
采用单因素筛选和响应面法,对乳酸片球菌ZPA017发酵合成GABA的条件进行了优化,结果得到其最佳发酵培养基配方为:D-果糖18 g/L、大豆蛋白胨40 g/L、乙酸钠3 g/L、磷酸氢二钾1.37 g/L、柠檬酸氢二铵2 g/L、硫酸镁0.63 g/L、硫酸锰0.29 g/L、吐温-80 1 mL/L;其最佳发酵条件为:温度37℃、初始pH 6.5、接种比例 1%、发酵时间30 h。乳酸片球菌ZPA017在此培养基和发酵条件下培养,发酵液中γ-氨基丁酸的含量可达1.036 g/L,是未优化前产量(0.275 g/L)的3.77倍,达到了提高GABA产量的目的。

