脂蛋白(a)水平对冠状动脉罪犯血管斑块的影响-基于OCT的研究
刘泽森,张朝义,张婷玉,李云涛,蔺洁,孟康
冠状动脉粥样硬化性心脏病(冠心病,CHD) 是指由于冠状动脉(冠脉)粥样硬化使血管狭窄导致的心肌缺血、缺氧而引起的心脏病。引起冠状动脉病变的危险因素有很多,传统高危因素包括高血压、糖尿病、吸烟、高脂血症等[1,2]。然而,即使传统的危险因素被很好的控制,部分患者出现心血管疾病事件的风险依然存在,这被称为心血管病的残余风险[3]。脂蛋白(a),[Lp(a)]是低密度脂蛋白(LDL)与载脂蛋白A (Apo A)的复合物,现有研究认为,高Lp(a)血症不仅是动脉粥样硬化性心血管病的残余风险也是冠心病的独立危险因素,当冠心病患者Lp(a)明显升高时,即使其LDL-C已达标,部分患者的冠心病进程仍会不断进展[4-7]。光学相干断层扫描技术(OCT)作为目前分辨率最高(10 μm)的血管内影像学技术,可以准确识别冠脉粥样硬化斑块的特征,观察到斑块的易损性及纤维帽、脂质核及血管内血栓等冠脉血管的微观结构[8,9]。本项研究通过回顾分析北京安贞医院行冠脉造影及血管内OCT检查的冠心病患者的Lp(a)水平及OCT图像结果,从而探讨脂蛋白(a)水平与冠心病患者冠脉罪犯血管内斑块特点的关系,并分析Lp(a)水平对脂质斑块稳定性的影响。
1 资料与方法
1.1 研究对象这项回顾性研究选择2015年1月至2017年12月于北京安贞医院行冠脉造影及OCT检查的患者95例为研究对象,其中男性71例,女性24例,平均年龄为(54.14±12.21)岁,对其临床资料进行回顾性分析。入选标准:①患者年龄<75岁;②至少有一支冠脉主要分支(前降支,右冠脉及回旋支)进行OCT检查的检测的冠心病患者。排除标准:①严重心力衰竭、肝肾功能异常及恶性肿瘤的患者;②左主干严重病变或慢性完全闭塞性病变的患者;③排除临床资料不完整,OCT图像不清晰或冠脉造影体位数不足,从而影响病例资料收集的患者。
1.2 分组方法根据患者术前血清Lp(a)值分为两组,Lp(a)<30 mg/dl为正常组(n=61例),Lp(a)≥30 mg/dl为高Lp(a)血症组(n=34例)。
1.3 冠影及OCT检查的实施及分析方法在进行冠
脉造影及OCT检查之前,所有患者均按照常规服用阿司匹林和P2Y12受体拮抗剂。选择性冠脉造影依照标准的治疗程序进行[10],通过桡动脉或股动脉路径进行冠脉血管造影,常规左冠状动脉采集包括正足位、右前斜足位、右前斜头位、正头位、左前斜头位和蜘蛛位等6个体位;右冠脉造影至少采用左前斜位和正头位。个别病例根据病变显示情况加照体位以达清晰地显示冠脉。造影要求对比剂完全充盈整个血管段,血管壁显影清晰,无层流显像。并通过冠脉造影的结果结合患者的心电图改变(包括缺血性ST段改变、T波倒置和病理性Q波等)、负荷试验结果等来确定罪犯血管。
OCT影像采集及分析方法:在冠脉造影结束后,所有患者均使用C7-XR 频域OCT成像系统(C7-XR,OCT Intravascular Imaging System;St Jude Medical,St Paul,MN)对三个主支血管进行OCT检查。应用2.7-F OCT成像导管(C7 Dragonfly,Light-Lab Imaging)沿导丝延伸至病变远端,通过注射造影剂,使血液暂时清除,成像系统以20 mm/s的速度自动回撤成像。图像所包含的患者身份信息将被去除并以数字方式存储。由两名有经验的研究员在对患者信息不知情的情况下应用离线软件(LightLab Imaging)进行OCT图像分析。OCT图像不清晰或主支血管图像长度<50 mm的血管将被排除。
应用OCT所识别出的斑块被分为两类:①纤维斑块(同质、高信号和弱衰减区域,见图1A);②脂质斑块(边缘模糊、高背反射和强衰减区域,图1B),且每个斑块之间相距至少5 mm或与支架边缘相距至少5 mm[11]。当脂质斑块内任何横截面的图像其斑块角度>90%时,这个脂质斑块被定义为富含脂质的斑块,并被记录及测量。应用系统自带测量工具,对脂质斑块的长度进行测量,后每隔1 mm测量脂质斑块的脂质核心角度。在此脂质斑块纤维帽最薄处3次测量其纤维帽厚度并计算平均值,作为此斑块的纤维帽厚度(FCT)。分别记录此脂质斑块的长度,最薄纤维帽厚度,最大脂质核心角度,平均脂质核心角度及脂质指数。除此之外,记录每支罪犯血管上纤维斑块、脂质斑块的个数,及两者相加的总斑块个数,同时记录这支罪犯血管是否存在钙化斑块、巨噬细胞浸润,胆固醇结晶、血栓及斑块破裂。易损斑块(TCFA,图1C)定义为纤维帽厚度≤65 μm且脂质核心大于两个象限的脂质斑块[12]。钙化斑块定义为边缘锐利的低信号或不均匀区域(图1D);巨噬细胞定义为高反射、强衰减的点状或条带状结构,且常在高信号的点状区域后形成放射状光影(图1E);胆固醇结晶定义为信号强度较高、衰减较低的薄线性区域(图1F);血栓定义为附着在管腔表面或在管腔内漂浮的不规则团块(图1G)。斑块破裂定义为斑块纤维帽连续性中断,伴空腔形成[13](图1H)。最小管腔面积被定义血管内斑块影响下的最小管腔面积,从其近端或远端(范围多不超过10 mm)选取面积最大的正常管腔,测量其面积,为参考管腔面积。分别记录冠脉罪犯血管的最小管腔面积及参考管腔面积。

图1 不同斑块的OCT图像(已隐去患者相关个人信息)
1.4 统计学分析所有资料均采用SPSS 24.0软件进行统计分析。计数资料采用例数(百分比)描述,正态分布的计量资料采用均数±标准差,偏态分布的计量资料采用中位数(四分位数)描述。计数资料组间比较采用卡方检验或Fisher精确检验,计量资料组间比较采用t检验或秩和检验。以Lp(a)水平为自变量,以患者的年龄、性别、高血压、糖尿病史、吸烟史及术前血清总胆固醇、高密度脂蛋白、低密度脂蛋白水平及糖化血红蛋白水平后为混杂因素,行多因素logistic回归分析,计算Lp(a)水平每增加10 mg/dl对包括总斑块数、纤维斑块数、脂质斑块数、易损斑块等因变量的影响。采用双侧检验,以P<0.05为差异有统计学意义。
2 结果
2.1 入选患者的一般资料描述该研究共纳入患者95例,其中男性71例,女性24例,年龄26~81岁,平均年龄为(54.14±12.21)岁,根据患者Lp(a)分为两组,Lp(a)<0.3 g/L为正常组(n=61例),Lp(a)≥0.3 g/L为高Lp(a)血症组(n=34例),两组患者除Lp(a)值以外,其他资料统计结果差异均无统计学意义(P均>0.05)(表1)。
表1 入选患者的临床基线特征及术前实验室检查结果(±s)

表1 入选患者的临床基线特征及术前实验室检查结果(±s)
注:体质指数(kg/m2),高密度脂蛋白胆固醇,高敏C反应蛋白为偏态分布
项目正常组(n=61) 高Lp(a)血症组(n=34) P值年龄(岁) 53.62±11.05 55.09±14.19 0.578男性(n,%) 46 (75.41) 25 (73.53) 0.840高血压病史(n,%) 36 (59.02) 19 (55.88) 0.767糖尿病病史(n,%) 16 (26.23) 5 (14.71) 0.194吸烟史(n,%) 33 (54.10) 16 (47.06) 0.510体质指数(kg/m2) 25.08 (23.40,26.30) 26.06 (24.18,28.08) 0.036三酰甘油(mmol/L) 1.69±0.87 1.78±0.90 0.628总胆固醇(mmol/L) 4.13±1.11 4.25±1.35 0.625高密度脂蛋白胆固醇(mmol/L) 1.04 (0.89,1.27) 0.96 (0.84,1.15) 0.248低密度脂蛋白胆固醇(mmol/L) 2.42±1.01 2.57±1.16 0.509糖化血红蛋白(%) 6.11±0.97 5.88±0.83 0.231脂蛋白(a)(mg/dL) 11.33 ± 7.88 60.41 ± 25.89 <0.001高敏C反应蛋白(mg/L) 1.06 (0.46,2.84) 0.94 (0.44,2.36) 0.672肌酐(μmol/L) 70.61±12.72 71.14±14.37 0.854尿酸(μmol/L) 333.04±82.04 357.17 ±116.06 0.241同型半胱氨酸(μmol/L) 13.50±7.87 24.26 ±49.05 0.096
2.2 基于OCT的两组罪犯血管及斑块特点的对比共统计并分析了111支罪犯血管,正常组71支,高Lp(a)血症组40支;其中包括前降支67支(60.36%),回旋支15支(13.51%),右冠29支(26.13%)。两组患者罪犯血管均是以前降支为最多,但罪犯血管的分布并无明显统计学差异。应用OCT对罪犯血管的管腔面积进行测量,与正常组相比,高Lp(a)血症组罪犯血管的最小管腔面积(3.21±2.63 mm2vs. 2.61±1.63 mm2,P=0.192)及参考管腔面积(9.29±3.493 mm2vs.9.63±4.12 mm2,P=0.638)并无显著差异。
基于OCT定性测量的结果显示,高Lp(a)血症组患者每根罪犯血管上纤维斑块的个数显示高于正常组(1.08±0.75 vs. 1.48±0.72,P=0.009),但是两组每根罪犯血管上脂质斑块的个数并无统计学差异(1.00±0.99 vs. 1.12±0.99,P=0.523)。由于总斑块数=纤维斑块数+脂质斑块数,受两组纤维斑块较大差异的影响,高Lp(a)血症组罪犯血管上总斑块数也显著高于正常组(2.10±1.06 vs. 2.60±1.06,P=0.018)。除此之外,两组患者罪犯血管上易损斑块、破裂斑块、巨噬细胞浸润、胆固醇结晶及血栓形成的检出率均无明显差异。但是,高Lp(a)血症组患者钙化斑块(40.85% vs. 62.50%,P=0.028)的检出率显著高于正常组患者(表2)。
2.3 脂质斑块定量测量结果共统计并分析了入选患者罪犯血管内108个脂质斑块,其中正常组66个,高Lp(a)血症组42个。高Lp(a)血症组患者罪犯血管内脂质斑块的最大脂质核心角(136.67±45.60 vs. 182.21±66.29, P<0.001)、平均脂质核心角度(108.00±31.41 vs. 139.18±46.89,P<0.001)及脂质指数(510.92±387.72 vs. 787.88±676,P=0.008)均高于正常组患者,最薄纤维帽厚度(99.85±36.18 vs. 84.05±32.91,P=0.024)低于正常组。两组间脂质斑块的长度(4.56±2.80 vs. 5.56±4.00,P=0.130)无统计学差异(表3)。
表2 两组罪犯血管及斑块特点的比较(±s)
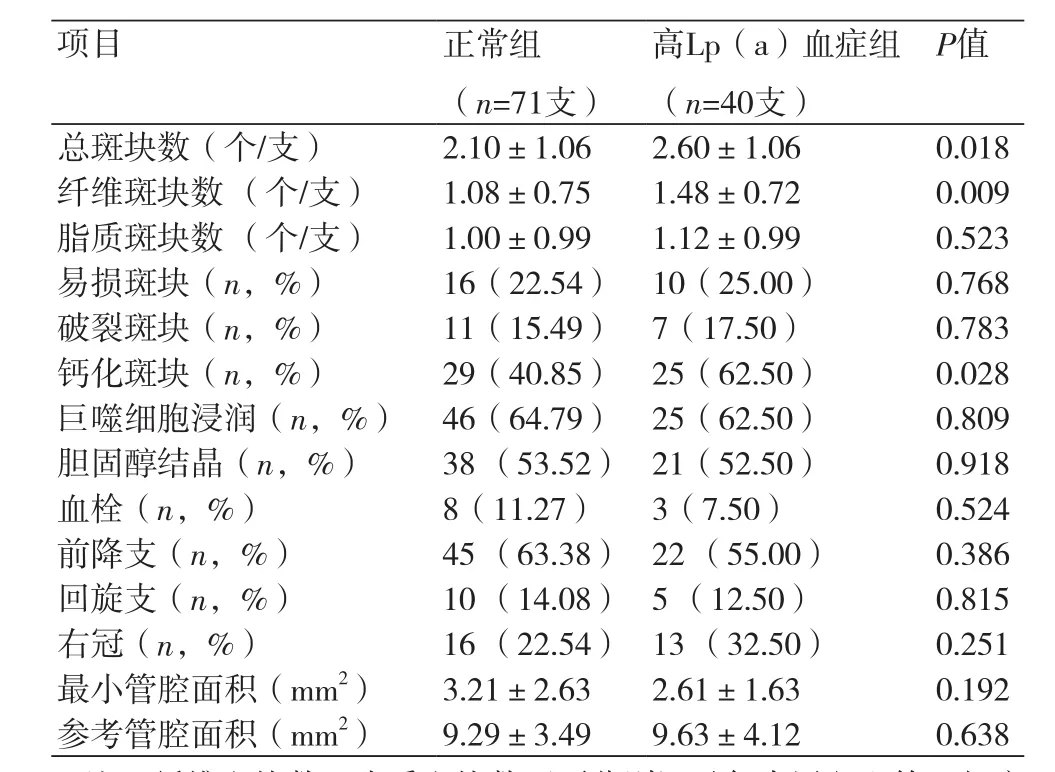
表2 两组罪犯血管及斑块特点的比较(±s)
注:纤维斑块数、脂质斑块数两项分别记录每支罪犯血管上相应斑块的个数,总斑块数=纤维斑块数+脂质斑块数
项目 正常组(n=71支)高Lp(a)血症组(n=40支)P值总斑块数(个/支) 2.10±1.06 2.60±1.06 0.018纤维斑块数 (个/支) 1.08±0.75 1.48±0.72 0.009脂质斑块数 (个/支) 1.00±0.99 1.12±0.99 0.523易损斑块(n,%) 16(22.54) 10(25.00) 0.768破裂斑块(n,%) 11(15.49) 7(17.50) 0.783钙化斑块(n,%) 29(40.85) 25(62.50) 0.028巨噬细胞浸润(n,%) 46(64.79) 25(62.50) 0.809胆固醇结晶(n,%) 38 (53.52) 21(52.50) 0.918血栓(n,%) 8(11.27) 3(7.50) 0.524前降支(n,%) 45 (63.38) 22 (55.00) 0.386回旋支(n,%) 10 (14.08) 5 (12.50) 0.815右冠(n,%) 16 (22.54) 13 (32.50) 0.251最小管腔面积(mm2) 3.21±2.63 2.61±1.63 0.192参考管腔面积(mm2) 9.29±3.49 9.63±4.12 0.638
表3 两组间罪犯血管内脂质斑块定量测量结果对比(±s)

表3 两组间罪犯血管内脂质斑块定量测量结果对比(±s)
项目 正常组(n=66)高Lp(a)血症组(n=42)P值最大脂质核心角度(°) 136.67±45.60 182.21±66.29 <0.001平均脂质核心角度(°) 108.00±31.41 139.18±46.89 <0.001脂质斑块的长度(mm) 4.56±2.80 5.56±4.00 0.130脂质指数 510.92±387.72 787.88±67.6 0.008最薄纤维帽厚度(μm) 99.85±36.18 84.05±32.91 0.024
2.4 Lp(a)水平对冠脉罪犯血管斑块影响的多因素分析单因素回归分析显示,Lp(a)水平对入选患者冠脉罪犯血管内的脂质斑块的个数、脂质斑块的长度、脂质指数、最薄纤维帽厚度以及易损斑块、破裂斑块、巨噬细胞浸润、胆固醇结晶血栓检出率等指标并无独立相关性。在未调整相关混杂因素前,Lp(a)水平升高是入选患者冠脉罪犯血管内的总斑块数[β=0.08 (0.02,0.15),P=0.0157]、 纤维斑块数[β=0.06(0.02,0.11),P=0.0088]、 脂质斑块的最大脂质核心角度[β=6.86(3.47,10.26),P=0.0001]、 平均脂质核心角度[β=5.54(3.23,7.85),P<0.0001]以及钙化斑块的检出率[OR=4.91(1.22,19.66),P=0.0247]增加的独立危险因素(表4)。

表4 Lp(a)对冠状动脉罪犯血管及脂质斑块影响的单因素回归分析
在调整了包括年龄、性别、高血压、糖尿病史、吸烟史及术前血清总胆固醇、高密度脂蛋白、低密度脂蛋白水平及糖化血红蛋白水平等因素后,Lp(a)水平升高是入选患者冠状动脉罪犯血管内的纤维斑块数[β=0.06(0.01,0.11),P=0.0299]、脂质斑块的最大脂质核心角度[β=6.13 (2.23, 10.03),P=0.0027]、平均脂质核心角度[β=4.71(2.09,7.33),P=0.0006]以及钙化斑块检出率的[OR=1.23(1.04,1.46),P=0.0152]增加的独立危险因素。Lp(a)每增加10 mg/dl,患者冠状动脉罪犯血管脂质斑块的最大脂质核心角度将增加6.13°;平均脂质核心角度将增加4.71°(表5)。

表5 Lp(a)水平对冠状动脉罪犯血管及脂质斑块影响的多因素线性回归分析
3 讨论
随着近些年针对Lp(a)标准化检测方法的更新及有效控制Lp(a)水平药物逐渐变多,目前针对高Lp(a)血症对在冠脉粥样硬化中其作用机制的研究也在逐步增多,并对高Lp(a)血症有了全新的认识。新近认为,高Lp(a)血症是发生动脉粥样硬化性心血管病(ASCVD)的残余风险[14]。Lp(a)同时含有LDL颗粒及载脂蛋白(a),因此与等量LDL相比,Lp(a)导致动脉粥样硬化的作用更强。同时,它在人体内的水平的高低受环境或饮食等因素影响较小,Lp(a)水平升高具有家族遗传倾向。通过促进血栓、炎症和抑制纤溶等都多重作用,Lp(a)可以加快动脉粥样硬化的进程[15]。多项研究显示,高Lp(a)血症不仅是冠心病、缺血性脑卒中和其他动脉粥样硬化性血栓形的独立危险因素,也是ASCVD的独立危险因素[16,17]。一项对9330例无缺血性心脏病的成年人进行10年随访的研究显示,随着Lp(a)水平的增加,参与者发生心肌梗死的风险也逐步增加,数据显示并没有阈值效应。在一般人群中Lp(a)水平极端升高会导致心肌梗死的发生风险增加3~4倍。同时,Lp(a)对数浓度每增加1个标准差,极端事件的风险上升3.6倍,发生ASCVD的风险比上升1.2倍[6]。
目前有关Lp(a)的研究多集中于其导致心脑血管疾病的风险、介导动脉粥样硬化的病理生理学机制以及相关药物治疗上,有关高Lp(a)血症患者冠脉病变特点及血管内斑块特征的临床资料较为有限。本研究通过对比并分析高Lp(a)血症和非高Lp(a)血症的冠心病患者冠状动脉罪犯血管的OCT图像,探讨了高Lp(a)血症患者冠脉内斑块的特点。首先,高Lp(a)血症患者冠脉每支罪犯血管内的纤维斑块多于正常组患者,而两组间脂质斑块的数量并无明显差异。由于每支罪犯血管上总斑块数=纤维斑块数+脂质斑块数,因此高Lp(a)血症组患者每支冠状动脉罪犯血管在总斑块数也高于正常组患者。多因素logistic回归提示Lp(a)水平每增加10 mg/dl,罪犯血管内纤维斑块将增加0.06个/支,提示了Lp(a)水平的升高与冠状动脉内纤维斑块的增多呈正相关。在动脉硬化斑块的形成过程中,脂质沉积是重要的因素,也是动脉内膜受损后早期的表现之一。而较大纤维斑块的形成往往由脂质斑块发展后稳定而形成,同时也可能是脂质斑块反复破裂、愈合的结果。现有研究显示,在冠心病患者中,小于45岁的患者其Lp(a)水平显著增高,并与冠脉斑块发展呈正相关[14,18]。本研究中高Lp(a)血症患者罪犯血管内总斑块数及纤维斑块数的显著增加,提示了Lp(a)水平的升高加快了人冠脉动脉粥样硬化的进程。
在冠心病患者人群中,Lp(a)水平的心血管疾病的严重程度有关,急性心肌梗死组Lp(a)水平最高,不稳定型心绞痛组、稳定型心绞痛组及非冠心病组Lp(a)水平依次降低[19]。TSIMIKAS等对2160例年龄介于45~79岁的患者进行了6年的随访,并发现Lp(a)水平的升高与冠脉事件的发生有显著的相关性[20]。OCT作为目前临床应用中分辨率最高的腔内影像技术可以显示冠状动脉内各层的结构特点,与血管内超声(IVUS)相比,在识别易损斑块及脂质斑块纤维帽测量等方面有着不可替代的优势。本研究中,高Lp(a)血症组患者罪犯血管内脂质斑块的最大脂质核心角、平均脂质核心角度、脂质指数均高于正常组,而脂质斑块的最薄纤维帽厚度低于正常组,提示Lp(a)的升高可能导致患者罪犯血管上脂质斑块不稳定性增加。同时,Lp(a)水平的升高会导致脂质斑块核心增加,在调整了包括年龄、性别、高血压、糖尿病史、吸烟史及术前血清总胆固醇、高密度脂蛋白、低密度脂蛋白水平及糖化血红蛋白水平等因素后,多元回归结果提示Lp(a)水平每增加10 mg/dl对入选患者冠状动脉罪犯血管内的脂质斑块的最大脂质核心角度增加6.13°,平均脂质核心角度增加了4.71°。高Lp(a)血症患者脂质斑块不稳定性的增加特别是纤维帽的变薄及脂质斑块核心的增大使脂质斑块破裂的可能性增加,从而继发引起急性血小板聚集和血栓形成,这可能解释了现有研究中发生急性心肌梗死组患者其Lp(a)水平较高的现象。
本研究中,高Lp(a)血症组患者罪犯血管出现钙化斑块的概率显著高于正常组患者;而Lp(a)的浓度每增高10 mg/dl,患者冠脉罪犯血管出现钙化斑块的概率将增加23%,这与现有基础和临床研究中关于Lp(a)导致动脉钙化的结果相符。现有研究表明,Lp(a)是氧化磷脂(OxPL)在血浆中的主要载体,其生理学作用是结合和转运血浆中促动脉粥样硬化的OxPL。Lp(a)颗粒可进入并累积于动脉内膜和主动脉瓣叶,通过OxPL的氧化应激反应上调相关转录因子-2的水平引起动脉内皮细胞的成骨化,引起血管的炎症和钙化反应[21,22]。血浆中Lp(a)水平升高是钙化性主动脉狭窄快速进展的独立预测因子,特别是年轻患者[23]。
有关病理学研究表明,Lp(a)进入动脉壁后会与大分子硫酸葡萄糖形成复合物而被巨噬细胞吞噬而后形成泡沫细胞,而巨噬细胞浸润引起的炎症反应和大量的泡沫细胞形成扩大斑块脂质核是易损斑块形成的重要机制之一;同时,Lp(a)可以上调细胞黏附分子表达,其与纤维蛋白原具有高度同源性,参与血栓性事件的发生[24]。Lp(a)升高是冠脉血栓形成的独立危险因子[25]。但是,在本研究中两组患者罪犯血管中易损斑块及血栓的检出率在统计学上均无明显差异。这可能与本研究中纳入的部分患者长期使用抗血小板及降脂药物,同时本研究中大部分患者为择期进行冠脉介入治疗,引起一定的选择偏倚。
本项研究具有一定的局限性:①本研究为单中心研究,同时OCT检查费用较高,因此本研究样本量有限;②由于OCT多应用于指导冠脉介入治疗的过程,因此临床上的OCT图像大多是患者的罪犯血管,也因此本研究仅对靶病变血管的图像进行分析及入组;③本研究为回顾性研究,同时由于部分OCT成像不清晰而被排除,可能存在一定的选择偏倚。相关结论还有待更多的研究来进一步讨论及研究。
综上所述,高Lp(a)血症罪犯血管的脂质斑块更加不稳定,Lp(a)是冠心病患者罪犯血管的纤维斑块数、脂质斑块的最大脂质核心角度和平均脂质核心角度的增加的独立危险因素。

