实时荧光RPA 快速检测犬冠状病毒方法的建立
熊 炜 ,蔡一村 ,王楷宬 ,张 强 ,黄保续 ,田桢干 ,林颖峥,李 健
(1.上海市检验检疫科学技术研究院,上海浦东200135 ;2.中国动物卫生与流行病学中心,山东青岛 266032)
犬冠状病毒(Canine coronavirus,CCV)是一种以胃肠炎为主要症状的高度接触性传染病,临床上以犬严重脱水、呕吐、腹泻和血便为主要特征,致死率较低,但与其他传染病混合感染时,死亡率提高,对幼犬危害严重,是养犬业危害较大的疫病之一[1-4]。CCV 为代表的冠状病毒极易变异,导致冠状病毒血清型众多,且新的血清型还在不断出现,如严重急性呼吸综合征(Severe acute respiratory syndrome,SARS)的病原就是一种新型冠状病毒。由于宠物饲养者数量日益增多,犬的健康与否与人类健康密切相关,因此,研制犬冠状病毒快速检测技术、缩短检测周期,对控制犬冠状病毒的传播具有重要的意义[5-6]。除病毒分离、电镜检测、ELISA 等方法外,反转录聚合酶链式反应(RTPCR)方法是目前检测CCV 最常用的方法,此外还有胶体金、实时荧光RT-PCR 等多种检测方法[7-9]。实时荧光重组酶聚合酶扩增(real-time recombinase Polymerase Amplification assay,real-time RPA)是一种新型的、可以替代传统PCR 检测技术的核酸快速检测方法,它能够在20 min 内完成常温下核酸的扩增和检测,检测设备小巧、便携,特别适合野外及检疫现场使用。本研究建立了实时荧光RPA 检测CCV 的方法,并对方法的特异性、敏感性和稳定性进行了验证。
1 材料与方法
1.1 主要试剂 TRIzol 购自Invitrogen 公司;Taq酶、AMV 逆转录酶、RNA 酶抑制剂、dNTP、随机引物、DNA Marker(DL-2 000),购自TaKaRa 公司;RPA 检测试剂购自英国TwistDx Inc 公司;DNA 抽提试剂盒(QIAamp DNA Blood Mini Kits)购自QIAGEN 公司;磷酸盐缓冲液(PBS,pH 值7.4)购自Gibico 公司;其他试剂购自国药集团上海化学试剂有限公司。
1.2 病毒样品来源及处理 CCV 病毒、阳性核酸和组织病料为本室保存,来自上海口岸入境的宠物及上海地区宠物医院的病犬,组织病料包括病犬的血液、尿液、粪便等,及病死犬的肝、脾、肺、肠等组织。本研究使用的其他病毒,如犬瘟热病毒(CDV)、犬细小病毒(CPV)、犬副流感病毒(CPIV)、猪传染性胃肠炎病毒(TGEV)、猫传染性腹膜炎病毒(FIPV)、小鼠肝炎病毒(MHV)等均由本室保存。将待检组织或粪便样品加等体积PBS 研磨匀浆,3 000 g 离心15 min,收集上清液待检。
1.3 核酸抽提及cDNA 模板制备 取100 μL 待检上清液或血清,加1 mL TRIzol 试剂进行RNA 提取;加30 μL DEPC 水溶解RNA 沉淀。取11 μL RNA溶液,加5 倍逆转录酶浓缩缓冲液4 μL、dNTP 1 μL、随机引物1 μL、RNA 酶抑制剂1 μL、AMV 逆转录酶2 μL,置PCR 仪上42 ℃反应60 min,即得cDNA 模板。取100 μL 上清液或体液样本用DNA抽提试剂盒说明书进行病毒DNA 提取,最后将DNA 用50 μL 水溶解。
1.4 PCR 检测 引物针对CCV 核衣壳蛋白(Nucleocapsid)基因设计,扩增基因片段大小为461 bp,其上游引物(CCVF)序列为:5′-CTA AGA CAA GAG ACA CTA CAC C-3′,下游引物(CCVR)序列为:5′-CTC AAC CTG TGT GTC ATC AAA C-3′。在PCR 薄壁管中,加cDNA 或DNA 模板1 μL、10 倍Taq酶浓缩缓冲液2.5 μL、dNTP 0.5 μL、上下游引物各0.25 μL、Taq 酶0.25 μL,加水补足总体积至25 μL。将PCR管置PCR 仪上,按如下程序扩增:首先94 ℃3 min;然后94 ℃15 s,56 ℃15 s,72 ℃30 s,35 个循环;最后72 ℃3 min。PCR 产物经琼脂糖凝胶电泳后,用凝胶成像系统拍摄。
1.5 荧光RPA 引物和探针设计 使用Vector NTI Suite 软件分析不同国家和地区分离的CCV 核蛋白(nucleoprotein)编码基因的保守序列,用Primer Express 软件设计RPA 引物和探针。实时荧光RPA 检测的上游引物(RPAY-CCVF)序列为:5′-CTG GAA GAG AAC TGC AGG TAA AGG TGA TGT GAC-3′,下游引物(RPAY-CCVR) 序列为:5′-TCG CCA TCT TCC TTT GCA GTC CAA TAG CTT CC-3′,RPA 探针(RPAY-CCVP)序列为:5′-CAT TAC CCA CAA CTG GCT GAA TGT GTT CCA TCT G(FAM-dt)(THF)(BHQ1-dt)TAG CAT TCT G-C-3′。引物和探针由上海辉睿生物科技有限公司合成。
1.6 实时荧光RPA 检测 采用GENIE Ⅱ恒温扩增PCR 仪。反应体系为:25 μL 2 倍反应缓冲液、7.2 μL dNTP、5 μL 10 倍探针酶混合物、上下游引物(RPAYCCVF、RPAY-CCVR)各2.1 μL、10 μmol/L 荧光探针0.6 μL;混匀后,再加入2.5 μL 20 倍核心反应液、1 μL 50 倍RT 反应液、1 μL 50 倍Exo 反应液;混匀后,最后加入2.5 μL 280 mmol/L 醋酸镁、1 μL待检核酸溶液。反应条件为:39 ℃孵育25 min。反应结束后,查看荧光扩增曲线进行结果判定。
2 结果
2.1 实时荧光RPA 检测CCV 的特异性试验 分析CCV 核蛋白基因序列,设计引物及探针,建立实时荧光RPA 检测CCV 方法,并分别使用其他犬病毒(如:CDV、CPV、CPIV)和其他物种的冠状病毒(如:TGEV、FIPV、MHV)作为对照,确认所建立方法的特异性。结果显示,经实时荧光RPA 检测,CCV 阳性样品在反应7 min 后荧光信号出现显著增强,其他病毒未检测到荧光信号(见中插彩版图1)。
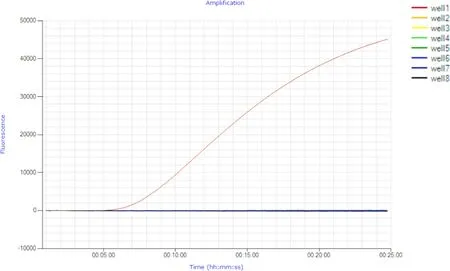
图1 实时荧光RPA 检测CCV 的特异性
2.2 实时荧光RPA 检测CCV 的敏感性试验 为测试建立的实时荧光RPA 方法的敏感性,将CCV阳性样品cDNA 进行定量并梯度稀释,制备浓度分别为1 ng/μL、100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL 的模板,再分别用实时荧光RPA 和PCR 方法检测。结果显示,RPA 检测CCV cDNA 模板的下限量为100 fg,与之对应PCR检测CCV cDNA 模板的下限量为1 pg(见中插彩版图2 及图3)。

图2 实时荧光RPA 检测CCV 的敏感性
2.3 实时荧光RPA 检测CCV 感染犬的临床样本为了进一步验证建立的实时荧光RPA 方法的可靠性,将其应用于CCV 病死犬的组织器官及血液、尿液和粪便等易于采集的体表样本以及30 份CCV阴性犬粪便样本的检测。结果显示,经实时荧光RPA 检测,4 份CCV 病死犬的组织样品(小肠、肝、肺、脾等)和3 份CCV 感染犬的体表样本(血液、尿液和粪便)均可检测到荧光信号的显著扩增,而空白对照和所有CCV 阴性样品均未检测到荧光信号(见中插彩版图4);使用传统的RT-PCR 方法,对所有临床样本进行复检,其检测结果与实时荧光RPA一致,符合率为100%(图5)。
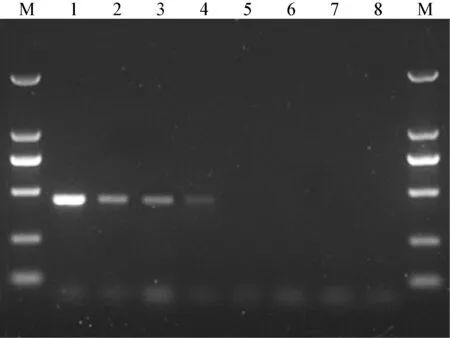
图3 RT-PCR 检测CCV 的敏感性试
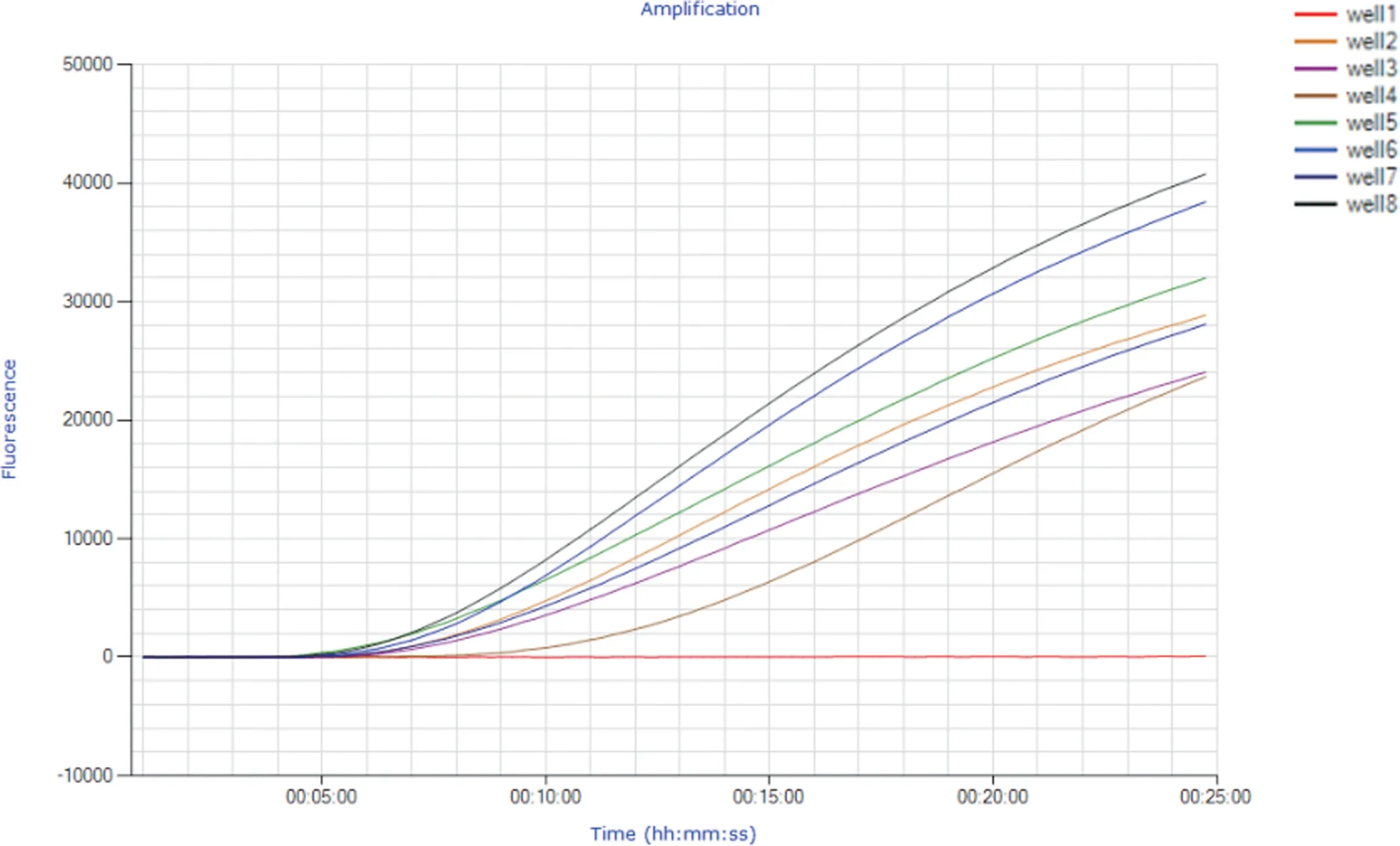
图4 实时荧光RPA 检测CCV 阳性犬的临床样本
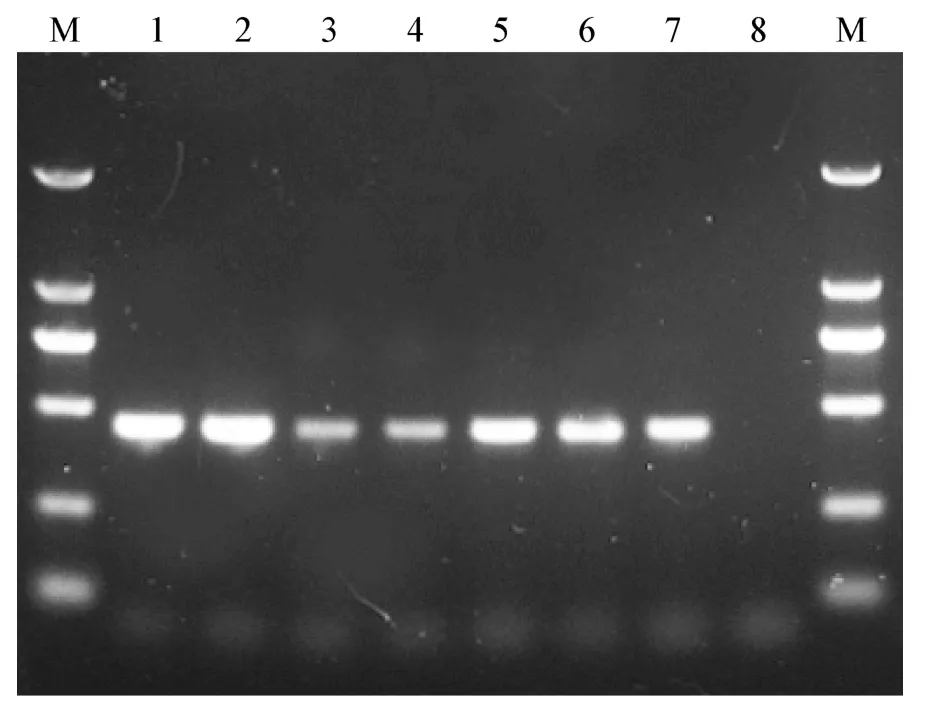
图5 RT-PCR 检测CCV 阳性犬的临床样本
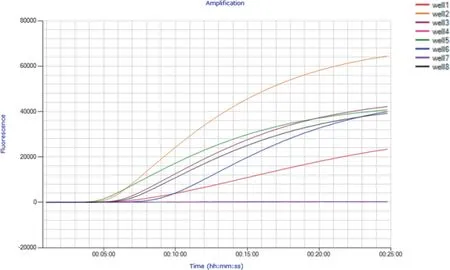
图6 实时荧光RPA 检测不同地区犬中分离到的CCV 阳性样本
2.4 实时荧光RPA 检测不同地区犬中分离到的CCV 阳性样本 用建立的实时荧光RPA 方法检测本室于2007 年至2015 年从口岸入境犬中分离到的6 份CCV 阳性样本,这其中2 份来自日本入境犬(CCV-JP1、CCV-JP2)、2 份来自澳大利亚入境犬(CCV-AU1、CCV-AU2)、2 份来自俄罗斯入境犬(CCV-RU1、CCV-RU2)。结果显示,6 份CCV 阳性样本经实时荧光RPA 检测均出现了荧光信号的显著扩增,而空白对照未检测到荧光信号(见中插彩版图6);经RT-PCR 复测,这6 份样本均扩增出了目的大小的基因片段(图7)。
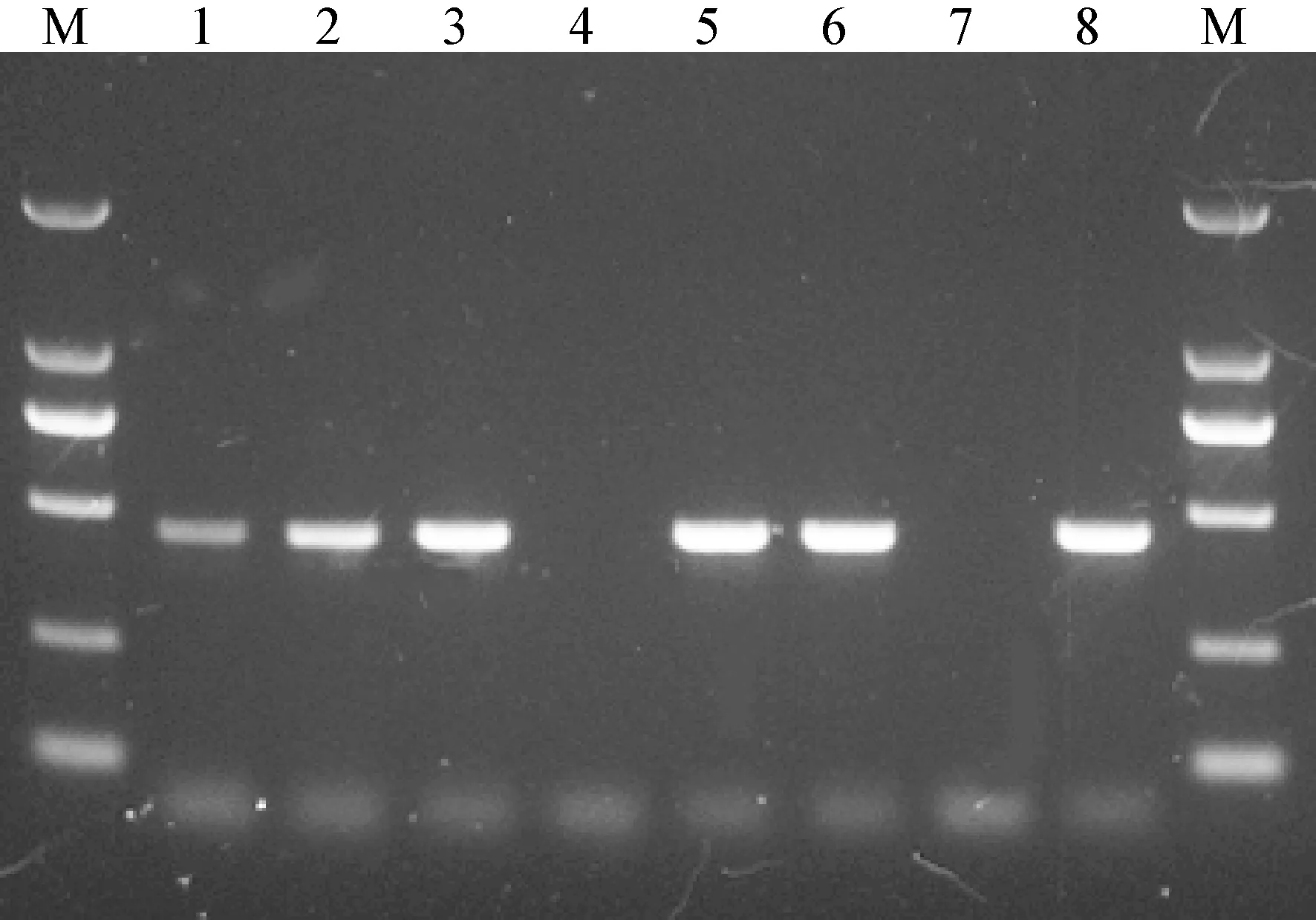
图7 RT-PCR 检测不同地区犬中分离到的CCV 阳性样本
3 讨论
CCV 属于套氏病毒目(Nidovirales)、冠状病毒科(Coronaviridae)、冠状病毒属(Coronavirus)I 群病毒,其基因组为不分节段单正链RNA,大小在27~32 kb 之间,是所有RNA 病毒中最大的。CCV 是的一种重要的感染犬的病毒,其发病率高,通常与多种犬病并发,具有一定的致死性,对犬养殖业危害严重,是我国出入境口岸宠物及野生动物检疫监测的重要对象。为适应口岸对进出境宠物快速检疫的需要,本研究建立了实时荧光RPA 快速检测CCV的方法。该方法具有良好的特异性,其与对照犬病毒(如:CDV、CPV、CPIV)和TGEV、FIPV、MHV 等同属的冠状病毒均未出现交叉反应。通过与RT-PCR方法的比对检测,证实本研究建立的实时荧光RPA方法的敏感性比传统RT-PCR 方法高了一个数量级。通过与RT-PCR 对比检测CCV 临床组织样本(如:肝、脾、肺、小肠)、易于采集的体表样本(如:血液、尿、粪便),以及30 份CCV 阴性样品,证实本研究建立的实时荧光RPA 方法具有与RT-PCR 一致的稳定性和可靠性,未出现阳性样品的漏检以及阴性样品的误检出;将该方法应用于复检不同时期从不同国家地区分离到的6 份CCV 阳性样本也均得到了阳性结果。另外,CCV 感染犬粪便的荧光信号峰值较血液和尿液均高,也更易于采集,是良好的筛查CCV 的样本。与传统PCR 方法相比,本研究建立的实时荧光RPA 检测方法的优势在于其检测周期极短(包括结果判读在内,仅需10 -20 min)、操作简单(只需将核酸与检测体系混合放于恒温设备中即可,RNA 检测不需逆转录过程)、检测设备便携(笔记本大小,一次充电可运行12 h)、结果判定简便直观,特别适合于现场及野外使用。本研究建立的荧光RPA 检测CCV 的新方法,不仅可应用于出入境口岸宠物及野生动物的检疫,同时也特别适合野外监测点、犬猫科动物繁育场和一线兽医检测实验室的使用,这对控制CCV 的传播,减少特种动物养殖业的经济损失,以及提升动物和公众的健康都具有重要的意义。

