高致病性猪繁殖与呼吸综合征病毒微滴式数字PCR 检测方法的建立及初步应用
王 林 ,孙 丹 ,韦海涛 ,宋彦军 ,周德刚 ,高晓龙 ,梅 力,冯小宇
(1.北京市动物疫病预防控制中心,北京大兴102600 ;2.北京市兽医药品监察所,北京大兴 102600)
猪繁殖与呼吸综合征(PRRS),俗称“猪蓝耳病”,是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种严重危害养猪业发展的病毒性传染病[1]。2006 年,我国出现高致病性PRRSV 毒株,导致严重型PRRS 的暴发,给我国养猪业造成了巨大的经济损失[2-3]。
目前实验室用于检测高致病性PRRSV 的分子生物学方法主要有RT-PCR 和荧光定量PCR,RTPCR 产物容易污染且只能定性检测,荧光定量PCR做定量检测时需要建立标准曲线。微滴式数字PCR(Droplet digital PCR,ddPCR)作为第3 代PCR技术,具有检测复杂来源样品中极低含量核酸分子和无须标准曲线直接绝对定量的检测技术[4]。目前广泛应用到转基因作物成分检测[5]和临床抗病毒治疗效果的评估[6]的研究领域中。本试验通过对微滴式数字PCR 检测高致病性PRRSV 毒株的退火温度、引物和探针浓度等反应条件的优化,以及特异性、敏感性、重复性和临床样本检测的研究,建立了基于ddPCR 技术的高致病性PRRSV 的绝对定量检测技术,为高致病性PRRSV 的早期快速检测提供了新的技术手段,也为北京市高致病性PRRS 的防控提供了技术支持。
1 材料
1.1 病毒 灭活的PRRSV 高致病性病毒和PRRSV 低致病性病毒由中国动物疫病预防控制中心提供。
1.2 临床样本 10 份临床样本为2016 年采集的北京猪场高致病性PRRS 病料。
1.3 仪器与试剂 QX100 微滴式数字PCR 仪、QX100 Droplet Generator、PX1 Plate Sealer、QX100 Droplet Reader、CFX96 Touch 荧光定量PCR 仪,均购自美国伯乐公司;NanoDrop 紫外分光光度计,购自美国赛默飞公司;RNA 提取试剂盒,购自北京世纪元亨动物防疫技术有限公司;TaKaRa One-step primescript RT-PCR Kit,购自宝生物工程(大连)有限公司;One-step RT-ddPCR Advanced Kit for Probes、Droplet generation oil for probe 和Droplet reader oil均,购自美国伯乐公司。pMD19-T 载体、TaqDNA聚合酶、DL-2000 DNA Marker、DNA 提取试剂盒、凝胶回收试剂盒,均购自宝生物工程(大连)有限公司。
2 方法
2.1 引物和探针 根据GenBank 已发表的高致病性猪繁殖与呼吸综合征病毒非结构蛋白2(NSP2)基因序列,用Primer Premier 5.0 软件设计引物和探针(表1),引物和探针由生工生物工程(上海)股份有限公司合成。
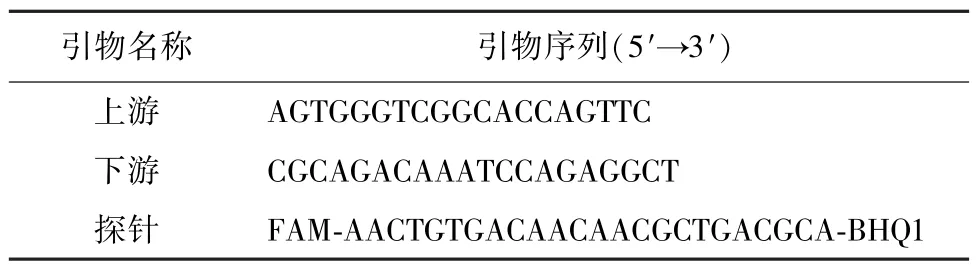
表1 引物和探针序列
2.2 病毒DNA/RNA 的提取 各取相应的病毒液100 μL,根据北京世纪元亨动物防疫技术有限公司病毒RNA 提取试剂盒说明书操作步骤提取高致病性PRRSV 的总RNA,置于-70 ℃保存备用。
2.3 微滴式数字PCR 微滴式数字PCR 试验使用的是伯乐公司的QX100 微滴式数字PCR 仪,主要包括微滴生成、PCR 扩增和微滴读取3 个主要试验步骤。
2.3.1 微滴生成 采用ddPCR Supermix for Probe试剂推荐的20 μL 体系,以相同浓度的病毒RNA 为模板,选用优化好的上游、下游引物浓度和探针浓度,加入2 × One-step RT-ddPCR supermix 10 μL,25 mM Manganese acetate solution 0.8 μL(1 mM),加无RNA 酶水补齐至20 μL,在微滴生成卡中加入70 μL微滴生成油,将生成卡放入微滴生成仪,生成微滴。
2.3.2 PCR 扩增 将生成的微滴转移至96 孔板内,用PX1 热封仪进行封膜。将封好膜的96 孔板放在伯乐PCR 仪器上进行PCR 扩增。PCR 的扩增程序为50 ℃反转录10 min; 95 ℃预变性3 min;94 ℃变性10 s,退火50~60 ℃60 s,共40 个循环;98 ℃10 min 结束反应。
2.3.3 微滴读取 将扩增完的96 板放入QX100微滴读取仪上,运行QuantSoft 软件,进行微滴结果读取。
2.4 微滴式数字PCR 反应条件优化
2.4.1 退火温度的优化提取高致病性PRRSV RNA 为模板。然后在QX100 ddPCR 平台上,ddPCR体系配方:4 × One-step RT-ddPCR Supermix 5 μL,RE 2 μL,DT 1 μL,上下游引物各1 μL,探针0.5 μL,RNase Free dH2O 7.5 μL,阳性模板2 μL,总体积20 μL(引物和探针的浓度均为10 μM)。做8个复孔,然后生成微滴,转移到96 孔板内,封铝膜。PCR 扩增程序为:50 ℃反转录10 min;95 ℃预变性10 min;94 ℃变性30 s,50~60 ℃(仪器自动分布8 个温度梯度)退火60 s,共40 个循环;98 ℃10 min,升降温速度都设2.5 ℃/s,结束反应。上微滴数字PCR 检测仪检测。
2.4.2 引物和探针浓度的优化 采用ddPCR Supermix for Probe 试剂推荐的20 μL 体系,以相同浓度的病毒RNA 为模板,分别对引物浓度和探针浓度组合(650 nM +150 nM、900 nM +250 nM 和1 150 nM +350 nM)和退火温度(50 ℃、51 ℃、52 ℃、54 ℃、56 ℃、58 ℃、59 ℃、60 ℃)进行优化,重复进行3 次试验,求平均值,确定最佳的引物浓度、探针浓度和退火温度。
2.5 微滴式数字PCR 特异性、重复性和敏感性试验
2.5.1 特异性试验 用建立的数字PCR 方法分别对PRRSV 高致病性毒株,PRRSV 低致病性毒株,猪圆环病毒2 型,猪传染性胃肠炎病毒,猪流行性腹泻病毒,猪瘟病毒和口蹄疫病毒进行检测,验证该方法的特异性。
2.5.2 重复性试验 选取3 份高致病性PRRSV 阳性样本与2 份阴性样本,分别进行批内重复试验与批间重复试验,每份样本重复检测8 次,并计算标准偏差及变异系数。
2.5.3 灵敏性试验及与荧光定量PCR(qPCR)比对试验 将0.8 ng/μL 的质粒DNA 进行10 倍稀释,连续稀释7 个梯度,编号1~7,分别在QX100 的平台上进行ddPCR 试验和荧光定量仪做荧光定量试验,比较检测方法的灵敏性。
2.6 临床样本的检测 利用本试验建立的ddPCR方法对临床上感染HP-PRRSV 的10 份样本进行检测,同时设立阴性、阳性对照。
3 结果
3.1 退火温度的优化 分别计算温度在50 ℃、51 ℃、52 ℃、54 ℃、56 ℃、58 ℃、59 ℃、60 ℃共8 个梯度,3 次重复试验测得标准样品的平均值,结果分别为84.9、80.9、82.7、82.7、88.1、82.3、81.4、82.5拷贝/μL(图1),在退火温度为56 ℃时,检测样品的拷贝数最多,所以确定最佳的退火温度为56 ℃。
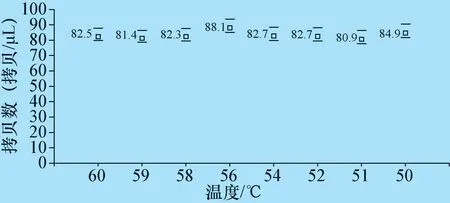
图1 不同退火温度检测的拷贝数
3.2 引物和探针浓度的优化引物和探针浓度的优化采用3 组不同浓度的组合进行筛选最佳反应浓度,分别为第1 组(引物浓度650 nM+探针浓度150 nM)、第2 组(引物浓度900 nM+探针浓度250 nM)、第3 组(引物浓度1 150 nM+探针浓度350 nM)。结果显示,第1 组、第2 组和第3 组检测病毒拷贝数分别为0 拷贝/μL、13.8 拷贝/μL 和13.4 拷贝/μL,第2 组引物和探针浓度组合检测的病毒拷贝数最多,所以确定最佳的引物和探针浓度分别900 nM 和250 nM(图2)。
3.3 微滴式数字PCR 特异性和重复性试验 本试验建立的高致病性PRRSV 数字PCR 检测方法分别检测PRRSV 美洲型高致病性毒株,PRRSV 美洲型经典株,猪圆环病毒2 型,猪传染性胃肠炎病毒,猪流行性腹泻病毒,猪瘟病毒,口蹄疫病毒,结果显示,PRRSV 美洲型高致病性毒株检测结果为129 拷贝/μL,其他均为0 拷贝/μL(图3)。重复性试验结果显示,3 次重复性试验的变异系数小于5%,表明具有良好的重复性(表2)。

图2 不同引物和探针浓度检测的拷贝数图

图3 ddPCR 特异性验证拷贝数图
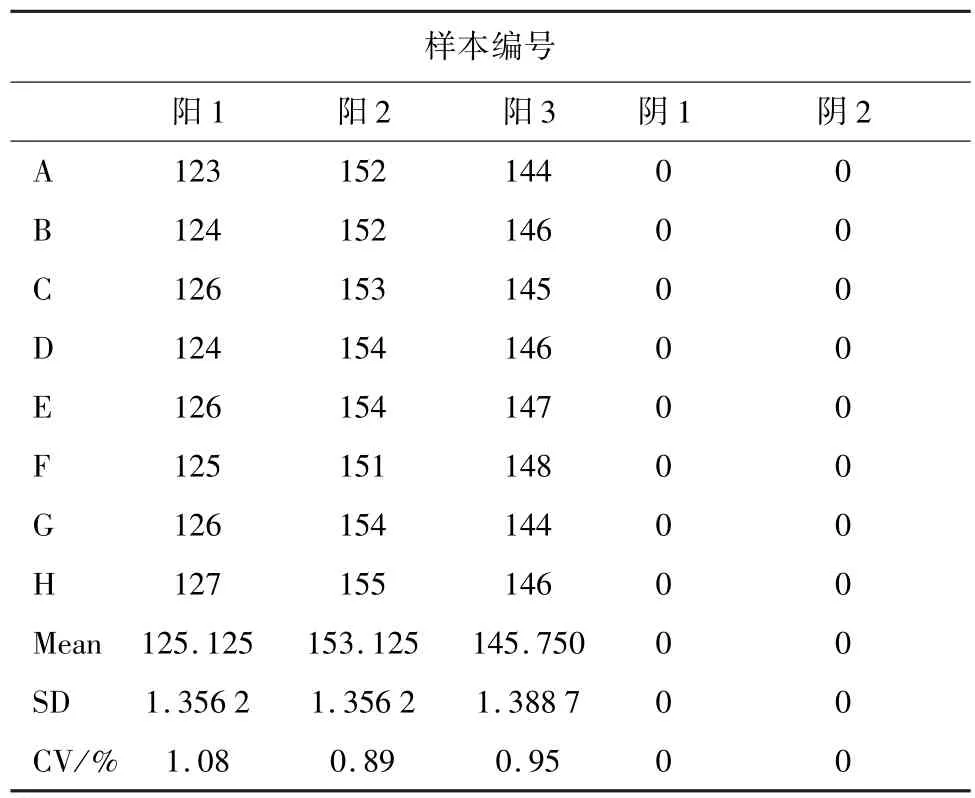
表2 重复性试验
3.4 微滴式数字PCR 灵敏性试验 将连续倍比稀释好的阳性标准质粒分别进行qPCR 和ddPCR 试验。结果显示,数字PCR 的R2值为0.999 1(图4),线性关系良好,表明检测方法可靠。ddPCR 灵敏度比qPCR 高10 倍,且能实现核酸含量的绝对定量(表3)。

表3 荧光定量PCR CT 值与数字PCR 拷贝数值比较
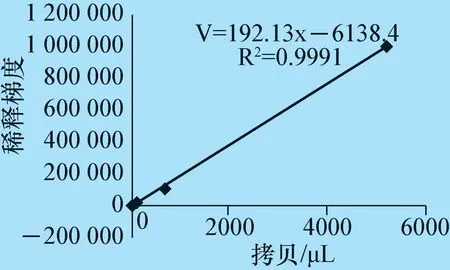
图4 ddPCR 标准曲线图
3.5 微滴式数字PCR 对临床样本中拷贝数的定量检测应用 对临床上感染高致病性PRRSV 的10 份样本,进行微滴式数字PCR 定量检测检测结果分别为1 980、97 000、4 200、203、104 000、823、197、822、2 150和202 拷贝/μL,表明建立好的ddPCR 方法能对临床样本进行绝对定量。
4 讨论
更准确和更灵敏的检测技术是分子生物学的发展方向,而微滴式数字PCR 作为第3 代PCR,与第1 代普通PCR 和第2 代荧光定量PCR 相比,具有灵敏性更高和直接绝对定量的检测优势。其主要原理是通过DNA 有限稀释法和泊松分布的统计原则来准确计算DNA 的浓度,能够在复杂背景条件下检测靶基因序列[7]。数字PCR 作为新一代分子诊断工具,已经越来越广泛应用到产前诊断[8]、癌症检测[9]、病原检测[4,10-11]、基因突变检测[12]和转基因研究[13]等。而利用ddPCR 对高致病性猪繁殖与呼吸综合征病毒的研究和应用相对较少。
本试验针对高致病性猪繁殖与呼吸综合征病毒NSP2 基因序列设计特异性引物和探针,并进行了最佳反应退火温度、最佳引物浓度、最佳探针浓度、特异性试验、灵敏性试验和重复性试验等一系列试验,建立了高致病性猪繁殖与呼吸综合征病毒ddPCR 检测方法。试验表明最佳的退火温度为56 ℃,最佳引物浓度和探针浓度分别为900 nM 和250 nM。微滴式数字PCR 的检测结果与标准品拷贝数的相关系数为R2=0.999 1,表明该方法检测结果具有良好的线性关系和可信度。将建立的ddPCR方法与qPCR 方法进行比较和分析,试验表明,ddPCR 最低检测限度为3.5 拷贝/μL,灵敏度比qPCR 高10 倍,因此具有较高的灵敏度,在早期感染或潜伏感染诊断中具有巨大的潜力。特异性和重复性试验结果表明,ddPCR 具有良好的特异性,与其他猪常见病毒不发生交叉反应,且重复性较好。对10 份临床样品的检测结果表明,ddPCR 可以对临床样品的病毒含量进行绝对定量。因此,本试验建立的ddPCR 检测方法灵敏度高、特异性强、能够快速检测到极低的HP-PRRSV,适用于HP-PRRSV 的早期检测和流行病学调查,为PRRSV 的防控和科学研究提供了有力的技术储备。

