犬细小病毒临床分离株VP2 基因进化分析
温峰琴 ,项海涛 ,郝宝成 ,邢小勇 ,包世俊 ,胡永浩
(1.甘肃农业大学动物医学院,甘肃兰州730070 ;2.中国农业科学院兰州畜牧与兽药研究所,甘肃兰州 730050)
犬细小病毒感染是由犬细小病毒(Canine parvovirus,CPV)引起的犬的一种急性传染病,特征为出血性肠炎或非化脓性心肌炎,多发生于幼犬,病死率10%~50%[1]。
CPV 属于细小病毒科细小病毒亚科的Protopar-vovirus属,与猫细小病毒(FPV),水貂肠炎病毒(MEV)和浣熊细小病毒(RaPV)均为食肉动物原细小病毒1 的变种[2]。CPV 是一类结构简单的单链线状DNA 病毒,病毒颗粒直径约为25 nm,无囊膜,呈二十面体[3]。病毒基因组全长为5 323 nt,含有2个ORF,5′端主要编码早期转录的调节蛋白NS1 和NS2,3′端编码晚期转录的结构蛋白,即病毒衣壳蛋白VP1 和VP2,VP2 是衣壳蛋白的主要成分,具有较强的免疫原性,可用于制备亚单位疫苗或DNA疫苗[4]。
由于犬细小病毒,尤其是VP2 基因容易发生变异,且在同一动物体有时能够检测到几种病毒变体,即共同感染[2],对VP2 序列的扩增和分析有助于了解流行毒株的抗原和基因变异情况。由于VP2的突变和重组影响宿主范围和受体结合的亲和力,因此对毒株VP2 基因的监测有助于了解流行株与疫苗株的关系及CPV 的进化模式,本试验对兰州分离的2 例犬细小病毒VP2 进行遗传进化分析及氨基酸变异分析,为犬细小病毒病的分子流行病学调查及防控提供了数据。
1 材料与方法
1.1 病料 2 例犬细小病毒病患病犬粪便均来自兰州某宠物医院,采集时间分别为2017 年4 月和2017 年6 月。
1.2 试剂 2 ×TaqPCR Master Mix、病毒基因组DNA/RNA 提取试剂盒,购自TIANGEN 公司;胶回收试剂盒,购自OMEGA 公司;DL-2 000 DNA Marker,购自生工生物工程(上海)股份有限公司;pMD19-T Vector,购自TaKaRa 公司;IPTG、X-gal、DH5α,购自北京全式金生物技术有限公司。
1.3 方法
1.3.1 引物设计 参照NCBI 数据库犬细小病毒VP2 基因保守区设计扩增全长的引物,引物序列包含酶切位点,由金唯智生物科技有限公司合成。引物序列如下:
VP2-forward:5′ATACATATGAGTGATGGAGCAGTTCAACC 3′
VP2-reverse:5′TATGGATCCTTAATATAATTTTCTAGGTG 3′
1.3.2 病毒基因组DNA 提取 2017 年4 月分离的病毒株命名为CPV/canine/LZ/1/2017,2017 年7 月分离的病毒命名为CPV/canine/LZ/2/2017,按照TIANGEN 病毒基因组DNA/RNA 提取试剂盒说明书进行。
1.3.3VP2 基因的扩增 PCR 反应体系:2 ×TaqPCR Master Mix 25 μL,ddH2O 23 μL,上游引物1 μL,下游引物1 μL,模板1 μL,总体积50 μL。PCR 反应条件:95 ℃预变性5 min;95 ℃1 min,53 ℃40 s,72 ℃90 s,30 次循环;72 ℃10 min。扩增后的产物进行琼脂糖凝胶电泳。电泳后切取目的条带,用胶回收试剂盒进行纯化回收。
1.3.4 连接与转化 胶回收产物与pMD19-T 载体连接。连接体系为10 μL,其中SolutionI 5 μL;pMD19-T 载体2 μL;胶回收产物3 μL;16 ℃连接30 min。连接产物转化100 μL 感受态大肠杆菌DH5α。冰浴30 min,42 ℃热激45 s,冰浴2 min。在上述感受态细胞中加入950 μL 不含抗生素的LB液体培养基37 ℃震荡培养1 h。用移液器吸取100 μL培养液涂布含有IPTG、X-gal 和氨苄青霉素的LB 平板培养基,37 ℃培养12 -16 h。
1.3.5 阳性重组质粒的鉴定 挑取平板中的白斑(阳性)于含氨苄青霉素的LB 肉汤中37 ℃摇床中培养8 h 至菌液浑浊;吸取少量菌液进行菌液PCR 扩增,PCR 产物经1%琼脂糖凝胶(含溴化乙锭)电泳,观察是否出现目的条带。取出现目的条带的菌液1 mL,离心,弃上清,送金唯智生物科技有限公司测序。
1.3.6 序列测定与分析:将临床分离株VP2 基因序列与NCBI 中的24 株犬细小病毒及3 株猫细小病毒VP2 基因序列用MEGA7.0 进行比对分析,并绘制遗传进化树。用MegAlign 软件分析核苷酸同源性,同时分析氨基酸变异情况。
2 结果
2.1 PCR 扩增结果 PCR 扩增产物大小约为1 700 bp,与预期一致,如图1 所示。

图1 犬细小病毒VP2 基因PCR 产物电泳
2.2 核苷酸遗传进化及同源性分析 测序结果显示,2 株病毒VP2 基因大小为1 755 bp,CPV/canine/LZ/1/2017VP2 基因 NCBI 登录号分别为MH155192,CPV/canine/LZ/2/2017VP2 基 因MH155193。遗传进化分析显示,猫细小病毒和犬细小病毒明显位于不同的进化分支上,MH155192 与MF467233.1、JQ743891.1 和KY937659 进化关系较近,位于同一进化分支。MH155193 与KY937651.1、KP260509.1、KY937641.1 进化关系较近,位于另一独立的进化分支上,如图2 所示。核苷酸同源性分析显示,MH155192 与MF467233.1 和JQ743891.1 的核苷酸同源性最高,均为99.9%,与MG264078.1 同源性较低(99%)。MH155193 与KY937651.1、KP260509.1、KY937641.1 核苷酸同源性均为99.8%,与KF149967.1 同源性较低(99.1%),MH155192 和MH155193 同源性为99.3%,如表1所示。

图2 犬细小病毒临床分离株VP2 基因系统发育树
2.3 氨基酸变异分析 MH155192 在易发生变异的位点氨基酸分别为5A,80R,87 L,93 N,101T,103A,178D,212F,232I,267Y,297A,300G,305Y,322T,323N,324I,370R,373D,426D,440A,564S,568G。各毒株之间氨基酸差异明显的位点主要在267、324、370、426、440 位,如表2 所示。MH155192 和MH155193 共有13 个核苷酸差异,其中的10 个核苷酸的变化仅造成同义突变,而3个核苷酸突变导致氨基酸改变,分别位于370、426 和440 位残基。总体来看,在24 株犬细小病毒中,中国分离株267 位均为Y,324 位均为I,与美国、厄瓜多尔分离株差异明显,370 位中国分离株为Q 或R。CPV-2c分离株440 位均为T。
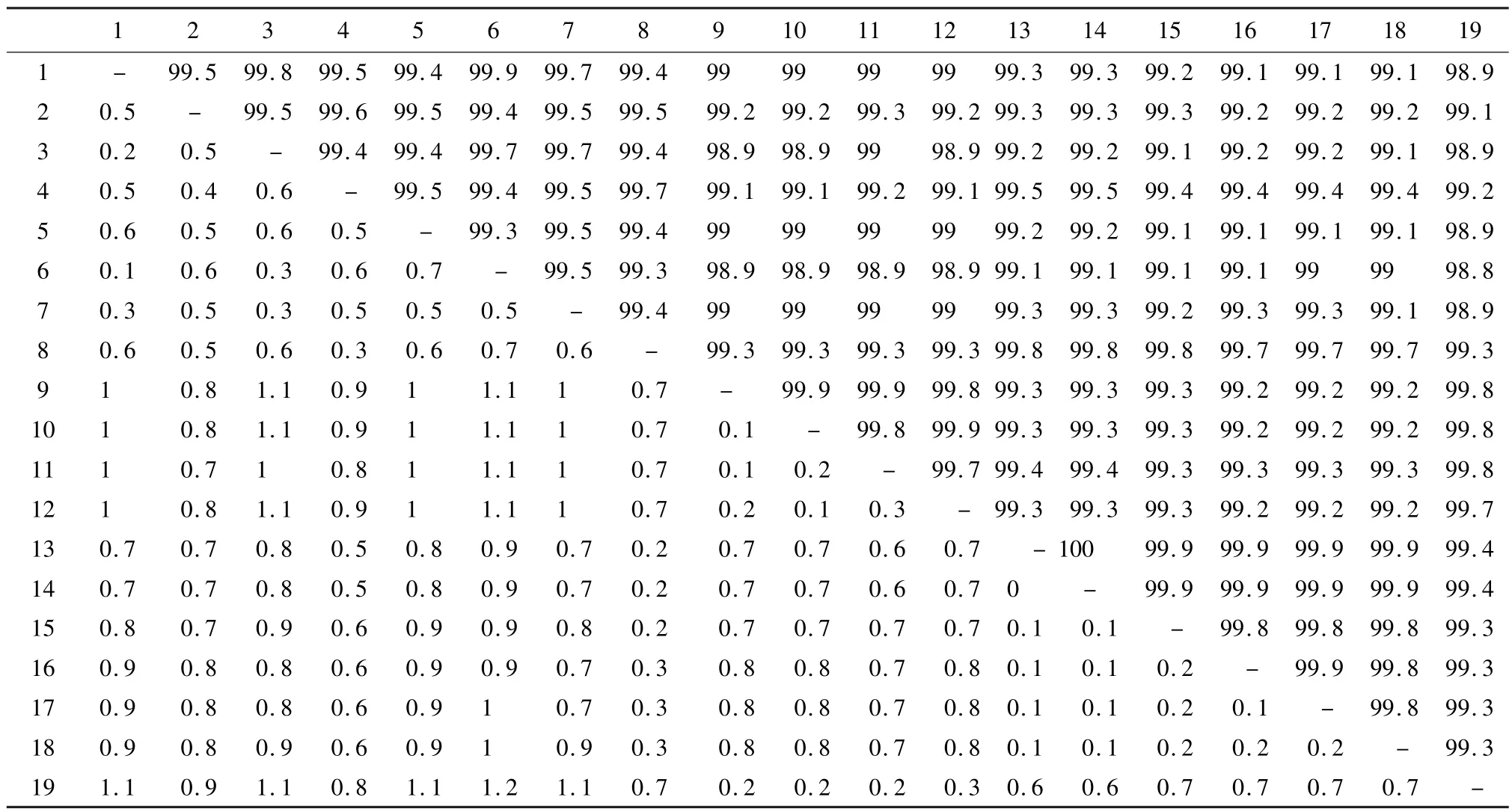
表1 犬细小病毒临床分离株VP2 基因同源性分析

表2 VP2 蛋白氨基酸变异情况
3 讨论
犬细小病毒,为将其与抗原无关的犬科动物微小病毒(MVC 或CPV1) 区分开来,也称为CPV2,1978 年出现在美国,并迅速蔓延在世界各地的狗群中引起居高不下发病率[5]。在1979 年和1984 年,CPV-2a 和2b 两种新抗原类型分别取代了原来的CPV-2,获得了在猫中高效复制的能力。CPV-2a 和CPV-2b 至少在VP2 衣壳蛋白上有5 个或6 个氨基酸与最初的CPV2 不同。在CPV-2a 和CPV-2b 中VP2 第297 位(Ser→Ala)的额外氨基酸改变产生了“新CPV-2a”和“新CPV-2b”。此外,在2000 年报道了另一种抗原变体,其特征在于氨基酸替代426-Asp→Glu。这种CPV-2c 随后在全球范围内被报道,并与严重的临床病程相关,死亡率较高[6]。CPV-2a (Met87Leu,Ile101Thr,Ala300Gly,Asp305Tyr,Asn375Asp,和Val555Ile 氨基酸变体) 和 CPV-2b (Asn426Asp),CPV-2c(Asp426Glu)仅有1 个氨基酸位置不同(VP2 426 残基)[7]。VP2 的426 和297 位氨基酸在空间上分别接近衣壳表面上三倍体突起的残基97 和300 。结构研究表明,该区域与宿主细胞的转铁蛋白受体(TFR)相互作用以介导感染,限制宿主范围,并且具有很高的抗原性[6]。近年来中国分离株CPV-2a,CPV-2b,CPV-2c 三种类型都有。在本文氨基酸分析的24 株病毒中,除KJ813835.1 第297 位为Ser外,其余菌株都为Ala,故认为CPV/canine/LZ/1/2017 和CPV/canine/LZ/2/2017 分别是新CPV-2b和CPV-2c。尤其CPV-2c 甚至能引起成年犬的严重疾病,应引起重视。
一般氨基酸替换发生于K80R,K93 N,V103A,D323N,N564S 和A568G,在本文的氨基酸序列分析中发现,不同毒株之间的主要突变发生在F267Y,Y324I,Q370R,N426D 或D426E,T440A。这些突变可能会导致病毒通过抗原漂移免疫逃避和随之而来的疫苗失败。在非同义突变中,氨基酸残基267 未暴露于衣壳表面,因此在这个位置的替代可能不会影响病毒的抗原性。Y324I 突变常见于亚洲国家特别是中国和南美。该突变可能对细小病毒宿主范围有影响,且由于Y324I 突变发生在潜在的重要的抗原表位区域,这个替代可能对病毒生物学有直接影响。T440A 突变对于CPV 也很重要,因为残基440 位于衣壳表面VP2 的3 倍体突起的顶部,主要的病毒抗原位点。因此导致其他抗原性变体出现[8]。台湾CPV-2c 毒株VP2 蛋白也存在Q370R 的替代,突变Q370R 在中国的大熊猫和中国的CPV-2c 株中观察到。370 残基位于残基359 和375 之间(它是衣壳蛋白的表面环),毗邻双Ca2+结合位点,这些对于病毒感染性是必不可少的,这些位点的改变与病毒凝集红细胞的能力相关[9]。因此,Q370R 变异是否导致抗原变化仍有待调查。总的来说,进一步研究犬细小病毒流行毒株的基因变异情况,以及变异引起的生物学特性的变化对于该病的防控有重要意义。

