定生型和漂浮型铜藻的形态及超微结构观察
朱 旗, 任继锐,2, 陈娟娟, 杨 锐
(1. 宁波大学 浙江省海洋生物工程重点实验室, 宁波 315211; 2. 浙江省渔业互保协会, 杭州 310006)
铜藻(Sargassumhorneri),在分类学上隶属于褐藻门、圆子纲、墨角藻目、马尾藻科和马尾藻属[1],是北太平洋西部特有的一种暖温性大型底栖褐藻[2]。藻体黄褐色,有固着器、茎和叶3个部分,气囊和生殖托顶生或生于叶腋中,藻体主干及分枝较细[3]。铜藻营底栖定生或漂浮生活。定生型铜藻生长在低潮带深沼中或大干潮潮线以下4 m处的岩石上[3],漂浮型铜藻可借助气囊漂浮在海面,形成海藻床,为众多海洋生物提供避敌、索饵、产卵、栖息生长的良好环境[4-6]。受到黑潮、千岛寒流和中国海近岸水体运动等因素影响,铜藻在我国北起大连,南至雷州半岛的沿海呈现不连续分布[7-8]。从生物量和分布区密集度分析,其分布中心应在浙闽沿海[9]。另外,在韩国和日本沿岸、美国加利福尼亚的长滩也报道有铜藻种群的分布[4]。铜藻是这些地区海藻床的重要组成部分,对当地海洋生态系统的形成和多样性维持具有重要作用[10]。此外,铜藻在吸收CO2[11]修复水体富营养化和控制赤潮等方面具有优势[12-13],被海洋生态学家列为重建海藻场和实施海洋生态修复的重要物种之一[4]。
但是一旦水温适宜铜藻生长,周围海水中又富含磷酸盐和硝酸盐,也可能造成漂浮型铜藻暴发式增殖而引发新型藻类灾害“金潮”,给沿岸养殖和环境造成危害[14]。2013年6月日照以东远岸海域、2015年8月大连海滨和2017年1月盐城都曾出现此类“金潮”,给当地海水养殖、旅游和船舶运输等行业造成严重损失。当铜藻藻体大量解体后会导致局部海域水体富营养化,引发硅藻等其他生物量的异常暴发[15],引发赤潮等其他生态环境灾害。此外,由于海水温度上升和近岸陆源污染等因素影响,定生型和漂浮型铜藻的种群数量和栖息空间也在发生变化。Komatsu等[10]依据目前海水温度升高的速度预测定生型铜藻种群将逐渐从浙江沿海消失;铜藻的分布范围将会北移,原有的海域将被较小的亚热带种所取代,到2099年前后中国东海和朝鲜半岛的铜藻将消失。深入了解铜藻的漂浮生长机制和种群资源现状,对于铜藻潮的防治和预警以及铜藻资源的健康、可控利用具有重要的意义。
关于铜藻的生长和暴发机制,目前的研究主要集中在铜藻生长和繁殖最适宜的温度、光照强度和营养盐等环境因素[16-17]和通过人工繁育技术来扩大定生型铜藻种群的规模[18],而关于铜藻不同生态型的形态及结构的研究则鲜有报道。本实验通过比较分析漂浮型和定生型两种不同生态型铜藻在表观、显微和亚显微结构上的异同点,为进一步探讨铜藻漂浮机制提供基本数据。
1 材料与方法
1.1 材料、试剂与仪器
本实验所用材料定生型铜藻采集于温州平阳县南麂岛的马祖岙(27°27′N, 121°05′E),漂浮型铜藻采集于南麂岛的小虎屿海滩上(27°28′N, 121°06′E)。样品采集后用海水洗掉藻体上的附着藻类和生物,尽快放入保温箱加冰袋带回实验室,用过滤消毒海水反复刷洗干净,备用。
电子显微镜(Olympus DP70,北京瑞科中仪科技有限公司);冷冻切片机(CM 1850 UV,广州守诚贸易发展有限公司);透射电镜(日立H-7650,日立高新技术上海国际贸易有限公司);PBS缓冲液(美国Irvine Scientific公司);OCT冷冻切片包埋剂(美国Sakura公司);戊二醛、无水乙醇和丙酮(国药集团化学试剂有限公司,分析纯);锇酸、Pon812环氧树脂包埋剂(美国Spi-chem公司)。
1.2 形态观察方法
1.2.1 取样测量
分别取定生型铜藻和漂浮型铜藻(取自同一海域,不同藻团,每藻团随机取出1株)各10株。随机选取每株主枝上大致相同部位30 cm长度枝条,测量单位长度内分枝数、分枝节间长度、气囊数目、生殖托个数,用SPSS16.0进行独立样本t检验统计分析和测量(分枝数、分枝长度、气囊数、生殖托个数)。
1.2.2 冷冻切片
冷冻切片步骤:取新鲜铜藻组织用灭菌海水反复刷洗,滤纸擦拭组织块后放入OCT包埋剂中至完全包埋,置于托物台放入-20℃恒冷箱切片机中,10 min后进行恒冷箱切片,厚度在10 μm左右,选择较完整的切片贴于载玻片上,在显微镜下观察。
1.2.3 透射电镜
Pon812环氧树脂包埋制作:将新鲜组织剪切成小于1 mm的块状放入1.5 mL的离心管中,加入4%戊二醛固定2 h。用0.1 mol/L PBS浸洗3~4次,每次15 min。浸洗后,采用1%锇酸固定1~2 h(黑暗处理)并用0.1 mol/L PBS浸洗3次。此后,分别用30%、50%、70%和90%酒精、90%丙酮和无水丙酮梯度脱水,每次15 min;丙酮和包埋剂渗透2 h后,吸出,并加入新的包埋剂,开盖渗透过夜,第2天将组织进行包埋,放入烘箱中进行梯度聚合(37℃,12 h;60℃,48~72 h),完全聚合后送样切片。
2 结果与分析
2.1 形态数据分析
定生型和漂浮型铜藻在形态上具有显著差异(图1)。定生型铜藻固着器裂瓣状,色泽深褐,气囊少,雌生殖托粗短、雄生殖托细长,生殖托顶端无再生枝。漂浮型铜藻无固着器,色泽黄绿,主枝短,分枝多且短,生殖托顶端再生枝。
定生型铜藻的分枝节间长度和生殖托数目分别为漂浮型铜藻的1.68倍和5.08倍,而漂浮型铜藻的单位长度分枝数和气囊数则分别为定生型铜藻的2.59倍和4.54倍(图2)。经独立样本t检验分析,定生型铜藻和漂浮型铜藻的分枝长度差异极显著(F=0.90,P<0.01),两者生殖托数差异极显著(F=0.904,P<0.01),分枝数差异极显著(F=6.977,P<0.01),气囊数差异显著(F=15.157,P<0.05)。结果显示,在表型上定生型铜藻和漂浮型铜藻已存在极显著差异,漂浮型铜藻为适应其漂浮生活在形态上已经进化为不同于定生型铜藻(图1和图2),气囊多是为了适应漂浮的生活,分枝多、生殖托少说明漂浮型主要依靠营养生长来扩增群体。这都符合藻潮物种的特点[19]。
铜藻的表观形态是基因、外部环境和内部生理共同作用的结果[20]。据推测中国东海的漂浮铜藻最初可能来源于固着在海岸岩石上的定生型铜藻[21],当藻体折断后,残枝利用气囊的浮力随着表面洋流漂浮在海面上,开始营漂浮生活并完成整个营养生殖过程[3]。在漂浮过程中,由于受到外部环境和内部生理的共同作用(如水温、光和植物激素),漂浮型铜藻在表观上显现分枝节间长度减少,单位长度分枝数和气囊数增加,使其具备了暴发潜能,其生物量积累从幼苗长到2~3 m能在10个月内完成[6, 22]。

A:漂浮型铜藻生长状态;B:漂浮型铜藻分枝、叶、气囊状况;C:漂浮型铜藻有再生枝的生殖托;D:漂浮型铜藻主枝末端变形;E:网绳上的定生型铜藻生长状态;F:定生型铜藻小苗;G:定生型生殖托;H:定生型铜藻固着器
图1 漂浮型铜藻和定生型铜藻
Figure 1 Floating and benthic types ofS.horneri
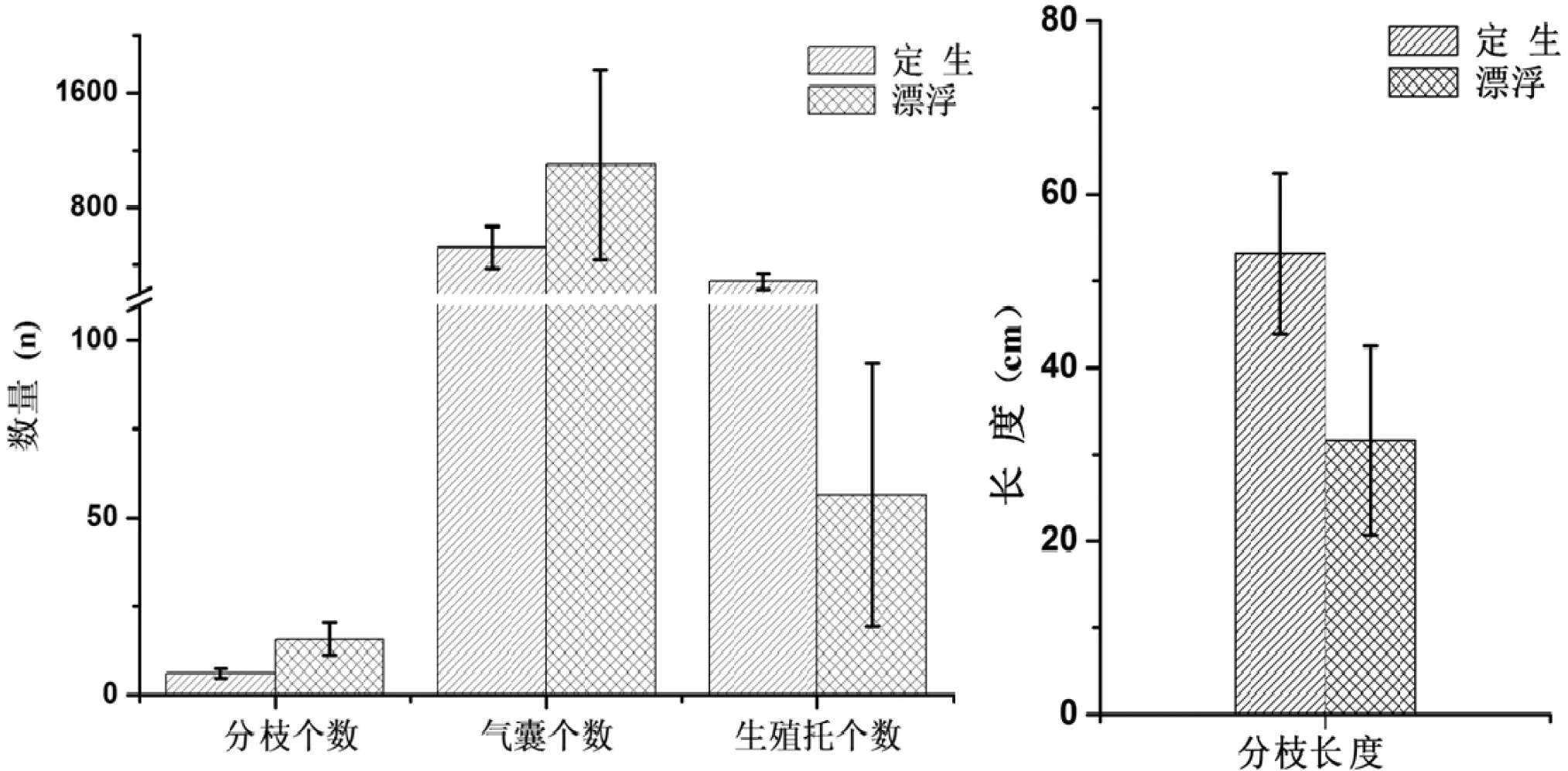
图2 定生型铜藻和漂浮型铜藻测量数据差异分析Figure 2 Morphological differences between benthic type and floating type of S. horneri
2.2 显微结构观察
对定生型和漂浮型铜藻样本进行冷冻切片观察内部结构(图3)。由图3可知,定生型铜藻的固着器只有表皮和皮层细胞,无髓部细胞,表皮细胞含有大量色素体,皮层细胞大小几乎均一、排列紧密,色素不明显,此外还有不规则块状结构。两种生态型铜藻的叶片和茎均由表皮、皮层和髓部3部分组成。其中,最外层的表皮细胞最小,含有大量色素体,向内依次为皮层细胞和髓部细胞。内外皮层由数层到十数层长椭圆形或长柱形细胞整齐排列而成。髓部由3~4层或4层以上大小不一的圆形细胞致密排列而成,细胞由外向内逐渐变大而所含色素则逐渐减少,故藻体由表皮向内部颜色越来越浅。通过细胞结构比较分析,发现定生型和漂浮型铜藻的叶和气囊的内部构造基本相同。
2.3 超微结构观察
通过细胞超微结构(图4)比较,发现定生型和漂浮型铜藻的固着器、茎、叶片、气囊和生殖托的表皮和皮层的亚显微结构差异不明显。
漂浮型铜藻没有固着器,定生型铜藻的固着器仅有表皮和皮层,细胞致密排列,表皮细胞几乎被藻泡(physode, Ph)充满,此外还含有一些色素体(chloroplast, C),皮层细胞的细胞壁很厚,但在2个细胞相连接处某点突然变薄,上面有许多小孔洞,这是皮层细胞间发达的胞间连丝(plasmodesmata, Pla)。
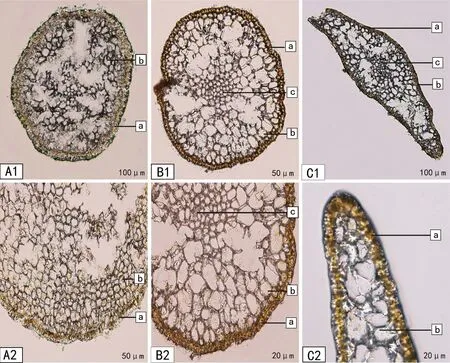
A1、A2:铜藻固着器;B1、B2:铜藻茎;C1、C2:铜藻叶片。a:表皮; b:皮层; c:髓部
图3 铜藻的内部结构
Figure 3 Microstructure ofS.horneri
铜藻茎中的表皮细胞内含较多的藻泡(Ph)和色素体(C),色素体多为周位,呈不规则形状排列成两排,此外还含有少量的液泡(vacuole, V),皮层细胞的细胞核(cell nucleus, N)位于细胞中央偏侧面,形状不规则,色素体(C)较表皮细胞少,位于细胞周围。皮层细胞之间亦存在有胞间连丝(Pla)。在定生型和漂浮型铜藻茎的皮层细胞外侧都发现致密的绒毛样结构(tomentum, T),其功能尚不明确。
铜藻叶片细胞的表皮细胞仅有一层,色素体(C)卵圆形,多为周位,藻泡(Ph)内容物较零散,很少有大块藻泡内容物出现,基本分布以细胞内近外围为主,皮层细胞为数层近于椭圆形的薄壁细胞组成,皮层细胞之间亦存在有胞间连丝(Pla)。色素体(C)较表皮细胞少。
铜藻气囊细胞的表皮细胞由长柱状细胞紧密排列而成,色素体长椭圆形或长棒形,沿细胞内侧底部排列成V字形,靠近藻体表面的细胞区,含较多藻泡(Ph)和液泡(V)。皮层细胞的细胞壁厚,由纤维组成,排列呈波纹,细胞之间有胞间连丝(Pla),在胞间连丝处可以看到两侧细胞内容物的连续性。
铜藻生殖托细胞内细胞器丰富,核结构(N)明显,色素体(C)含量比较多,藻泡(Ph)含量比较少。雌性生殖托和雄性生殖托的区别在于雌性生殖托还含有大量的线粒体(mitochondria, M),并且雌生殖托在成熟时有卵囊。但本次实验材料采集时生殖托尚未成熟放卵,因此未在雌性生殖托中发现卵囊结构。
在本研究的各类藻体细胞中都发现数量不一的同心层形结构(concentric lamini form structure, Cls)。王素娟在铁钉紫菜、海带和裙带菜等藻类中都观察到同心层结构[23],目前尚无藻类中该结构的成分或功能的报道。结合动物细胞的特点[24],作者推测该结构可能是藻类受到感染或藻体生理状态变差,造成的细胞结构(如色素体或内质网等)凋亡或者解体而形成的。
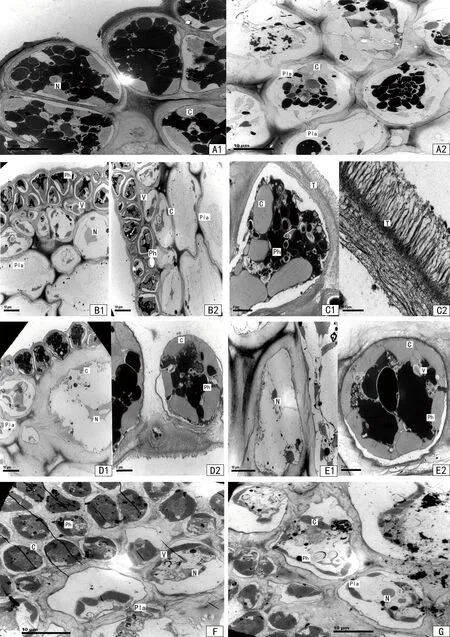
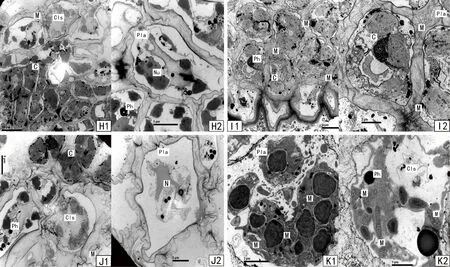
A1、A2:定生型铜藻固着器;B1:定生型铜藻茎;B2:漂浮型铜藻茎;C1、C2:茎的绒毛样结构;D1、D2:定生型铜藻叶片;E1、E2:漂浮型铜藻叶片;F:定生型铜藻气囊;G:漂浮型铜藻气囊;H1、H2:定生铜藻雄性生殖托;I1、I2:定生铜藻雌性生殖托;J1、J2:漂浮型铜藻雄性生殖托;K1、K2:漂浮型铜藻雌性生殖托。*Nu:nucleolus(核仁)
图4 铜藻超微结构
Figure 4 Ultrastructure ofS.horneri
3 小结
本研究结果显示漂浮和定生铜藻的藻体在表观水平上具有显著差异,而在显微和亚显微水平上两类铜藻差异不明显。漂浮型铜藻较定生型铜藻在表观上显现为分枝节间长度减少,单位长度分枝数和气囊数增加;定生型铜藻的固着器没有髓部细胞,茎和叶组织由外向里依次为表皮、皮层和髓部;表皮细胞比皮层细胞含有更多的藻泡和色素体,与显微结构观察到的藻体由表皮向里颜色越来越浅相一致;在铜藻的皮层细胞间广泛分布着胞间连丝,且在胞间连丝处两侧细胞的内容物存在连续性。漂浮铜藻在表观上的变化可能是对营漂浮过程中环境和内部生理(如水温、光和植物激素)适应的结果。

