掌叶覆盆子套种对板栗林土壤细菌群落结构演变及多样性的影响
徐 阳, 龚榜初, 吴开云, 江锡兵, 孙维敏, 胡卫滨, 陈喜良
(1. 中国林科院亚热带林业研究所, 杭州 311400; 2.浙江省林木育种技术研究重点实验室, 杭州 311400; 3. 浙江省金华武义县林业科技推广站, 金华 321200; 4. 浙江万寿康生物科技有限公司, 金华 321200)
板栗(Castaneamollissima)是我国重要的特色坚果,栽培历史久,种植面积广,但目前栗园普遍低产低效[1-2]。掌叶覆盆子(Rubuschingii)为蔷薇科悬钩子属落叶灌木,果实具有固精、益肾等保健功能[3-4],市场需求增大,极具推广价值[4-5]。充分利用板栗林下丰富的空间、土壤与水源条件,改变单一种植模式,进行掌叶覆盆子套种,短期内可产生较高经济效益[5]。但板栗-掌叶覆盆子复合模式中土壤养分及土壤生态等指标,尚未开展系统评价,科学而可持续的经营技术体系尚未建立。
土壤细菌参与土壤有机质分解、养分转化[6],其群落结构关系到土壤的可持续利用和抗压力,是土壤养分、质量和生态评价的重要指标[7]。近年来,成熟的宏基因组高通量测序技术为土壤细菌群落结构演变及多样性研究提供了坚实的技术保障。目前,虽板栗共生菌根真菌研究较为深入[8-9],但板栗林土壤细菌方面的研究,尚处于起步阶段。徐秋芳等研究发现集约栽培的板栗林,头10年里,土壤微生物群落功能多样性下降趋势明显,10年后则变化不大[10]。秸秆腐解物覆盖经营可显著影响板栗林土壤氨化细菌、真菌、放线菌数量[11]。而关于板栗林土壤细菌结构的研究则鲜有报道。为此,本文采用高通量测序技术,从微观角度阐述不同掌叶覆盆子套种密度的板栗林土壤养分及细菌群落结构变化,为生产中板栗-掌叶覆盆子复合经营技术提供依据,为科学评价该种植模式的生态风险提供科学依据。
1 材料与方法
1.1 试验处理与材料
试验地位于浙江省金华市武义县王宅镇。10年生板栗林,林相整齐,主栽品种为毛板红(CastaneamollissimaBL Maobanhong)。于海拔700~800 m处,选择土壤类型、质地相似的3个地块,每地块约4亩。2014年冬,林下整地,2015年春,掌叶覆盆子分株栽植,分别设置板栗纯林模式(0株掌叶覆盆子/亩,CM)、低密度掌叶覆盆子的板栗-复合模式(100株掌叶覆盆子/亩,CMRC1)及高密度板栗-复合模式(400株掌叶覆盆子/亩,CMRC2)。
1.2 取样方法
2017年夏,掌叶覆盆子进入稳产成熟期。 2017年10月底,分别在CM、CMRC1与CMRC2模式地块内,每模式选定3个采样区(每样区20 m×20 m),采样区内以Z型选5个样点,采集0~20 cm深的土样,混合均匀,共计9份土样。土样去除石砾和植物残体,过2 mm钢筛后分2份保存: 一份冷冻,用于提取土壤细菌DNA; 另一份室内自然风干,用于土壤基本理化分析。
1.3 试验方法
1.3.1 土壤因子检测
委托国家林业局经济林产品质量检验检测中心(杭州)按常规法分别测定土壤中水溶性盐分含量、有机质含量、全氮含量、水解性氮含量、全磷含量、有效磷含量、全钾含量、速效钾含量、交换性钙含量、交换性镁含量、pH值。
1.3.2 土壤细菌16S rDNA基因测序
采用 Fast DNA SPIN Kit for Soil(MP Biomedicals, USA)试剂盒,分别提取9个土样细菌总DNA,用琼脂糖凝胶电泳及Agilent 2100 Bioanalyzer、超微量分光光度计检测DNA的质量与浓度,合格的DNA稀释为10 ng/μL,于-20℃冰箱保存备用。
取10 ng土壤DNA为模板,设计16S rDNA V4-V5区特定引物扩增特异区域,委托南京集思慧远生物工程有限公司采用Illumina Hiseq 2500平台,采用PE250测序策略进行高通量测序。
1.4 数据分析
原始序列质控后,用Usearch软件[12]进行去嵌合体、聚类和随机抽平处理,以97%相似度为标准,提取对应OTUs (Operational Taxonomic Units)。利用QIIME软件[13]对抽平后的OTUs进行分析,对每个OTU进行物种分类。归类后,根据每个OTU中序列的条数,从而得到OTU丰度表,最后根据该OTU丰度表进行后续分析。
采用SPSS16.0软件进行DUNCAN新复极差法比较,各指标用不同大写字母表示差异显著 (P<0.05)。
2 结果与分析
2.1 土壤环境因子分析
表1显示,掌叶覆盆子套种后,板栗林土壤有机质及全氮、水解性氮、有效磷、全磷含量增加,但随套种密度提升,又显著回落。其中土壤有机质及水解性氮最明显,有机质从CM中23.57 g/kg上升到CMRC1中的37.13 g/kg,套种密度升高后,又回落到26.67 g/kg。土壤水解性氮含量从CM中122.33 mg/kg上升到CMRC1中的301.67 mg/kg,掌叶覆盆子密度升高后,也回落到145.67 mg/kg,但仍显著高于板栗纯林。土壤全钾与速效钾含量随掌叶覆盆子密度提升反而呈现下降趋势,其中速效钾含量从CM中58.73 mg/kg显著下降到CMRC1中的45.10 mg/kg,密度升高后,又显著下降到35.23 mg/kg。土壤交换性钙与交换性镁含量则在掌叶覆盆子密度在400株/亩时,从纯林和低密度的46.93、28.63 mg/kg与10.7、13.73 mg/kg分别显著升高到210.33与79.43 mg/kg。
2.2 土壤细菌序列分析
对3个处理(9样本)的土壤细菌进行16S rDNA高通量测序,分别得到25 976~39 100条序列。将序列抽平至18 296条后,在97%的相似水平下,共获得6414个 OTUs。抽平后,所有土壤样本OUTs数目均介于2071~2724之间。各样品测序覆盖率均在0.93 以上,表明样品序列测序量足以覆盖样品菌群组成,序列未测到概率低。

表1 不同掌叶覆盆子套种密度的板栗林土壤理化性质
2.3 掌叶覆盆子套种对板栗林土壤细菌丰度及多样性的影响
OTUs维恩图(图1)表明,各模式样品共有OTUs数量为980个。CMRC2样本特异性OTUs数量最多,为1010个,CM特异性OTUs数量最少,为674个,表明不同种植模式土壤细菌多样性存在一定差异。

表2 土壤细菌群落结构多样性指数

图1 不同掌叶覆盆子套种密度的板栗林土壤细菌群落 OTUs 维恩图
Figure 1 Venn diagram of bacterial OTUs of Chestnut soil with different inter-planting densities of Raspberry
样本多样性指数(表2)显示,板栗-掌叶覆盆子模式(CMRC1、CMRC2)的土壤微生物 Chao1指数(3859.58、3985.08)显著高于板栗纯林(CM,3133.97),但两种套种模式间Chao1指数差异不显著,表明套种掌叶覆盆子后,能显著提高板栗林土壤细菌丰富度,但掌叶覆盆子密度对土壤细菌影响不显著。Shannon指数随掌叶覆盆子套种密度提高呈增势,但不显著,表明板栗林土壤微生物多样性较稳定,一定密度的掌叶覆盆子套种对其影响不显著。低密度套种掌叶覆盆子的板栗林Simpson 指数与板栗纯林差异不显著,而套种掌叶覆盆子在400株/亩左右时,Simpson指数为0.992,显著高于其他模式,显示此时的土壤微生物优势种突出,但土壤多样性显著下降。
2.4 掌叶覆盆子套种对板栗林土壤主要细菌群落结构的影响
门分类水平上,板栗林土壤细菌分布在20个已知细菌门。各处理优势细菌群落组成基本一致。板栗纯林土样中属于变形菌门(Proteobacteria)与酸杆菌门(Acidobacteria)的序列分占全部序列的31.20%和29.70%,放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、浮霉菌门(Planctomycetes)与疣微菌门(Verrucomicrobia)序列占6%~8%,这6门的序列总比例达89%左右,为板栗林土壤中优势菌落。此外各模式土壤中芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)与厚壁菌门(Firmicutes)序列比例也在1%以上。
精确到目水平,板栗纯林土壤样本中属于变形菌门的弧菌目(Vibrionales,7.80%)、根瘤菌目(Rhizobiales,5.53%)、红螺菌目(Rhodospirillales,3.38%)、黏球菌目(Myxococcales,2.23%)、黄色单胞菌目(Xanthomonadales,2.61%)、亚硝化单胞菌目(Nitrosomonadales,2.08%)、伯克氏菌目(Burkholderiales,2.43%)及浮霉菌门的浮霉菌目(Planctomycetales,7.20%),酸杆菌门的酸杆菌目(Acidobacteriales,6.38%),疣微菌门纤线杆菌目(Ktedonobacterales)芽单胞菌门的芽单胞菌目(Gemmatimonadales,1.97%)及Solibacterales(5.94%)、Subgroup 10(1.87%)的菌种总和占总比例的50%以上,为目层次上的优势菌落。
分别在门与目水平对各模式土壤细菌群落构建分层聚类图(图2),3个模式土样均明显地分成2大类。门水平上,板栗纯林土壤单独为一支;掌叶覆盆子套种的2个栗林土壤细菌群落结构较接近,聚为一支。而目水平上,低密度和无掌叶覆盆子套种的土壤细菌群落结构较接近,聚为一支;高密度套种的土壤样本单独为一支。这或许暗示了掌叶覆盆子套种对土壤细菌群落结构在门水平上影响较大,而套种掌叶覆盆子需在达到一定密度后,才在目水平上对土壤细菌群落结构产生较大影响。
由图2和图4进一步分析掌叶覆盆子套种对板栗林土壤细菌丰度的影响。门水平上,土壤细菌丰度显著变化同样主要出现套种掌叶覆盆子后,其中酸杆菌门、放线菌门、迷踪菌门(Elusimicrobia)、疣微菌门与芽单胞菌门细菌丰度显著上升,但高密度掌叶覆盆子套种下酸杆菌门略有回落;变形菌门与浮霉菌门细菌丰度明显下降,但随密度提高,略有上升。而绿弯菌门细菌丰度呈先升高后下降的趋势。目水平上,土壤细菌丰度随掌叶覆盆子套种密度呈显著变化(图3和图5)。弧菌目、浮霉菌目、根瘤菌目、伯克氏菌目在掌叶覆盆子套种后丰度显著下降,其中弧菌目变化最明显,从板栗纯林CM中7.80%显著下降到CMRC1中0.46%,掌叶覆盆子密度增加后,显著下降到0.005%。红螺菌目、黏球菌目与芽单胞菌目在掌叶覆盆子套种后丰度显著上升。而Solibacterales、黄色单胞菌目、亚硝化单胞菌目、纤线杆菌目、Subgroup 10则在高密度掌叶覆盆子套种时才发生显著变化,其中Solibacterales、Subgroup 10、黄色单胞菌目、亚硝化单胞菌目显著增高,而纤线杆菌目显著降低。酸杆菌目细菌丰度(6.38%)随掌叶覆盆子套种密度呈先升高(7.87%)后下降(6.27%)的趋势。
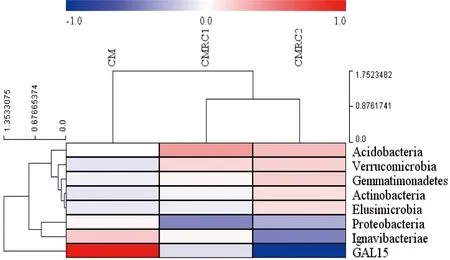
图中左侧聚类树为物种聚类树; 上方为样品聚类树; 热图颜色表示每行细菌门标准化后的相对丰度
图 2 不同掌叶覆盆子套种密度的板栗林土壤细菌门分层聚类
Figure 2 Hierarchical clustering analysis for bacterial phylum community in Chestnut soil with different inter-planting densities of Raspberry

图中左侧聚类树为物种聚类树; 上方为样品聚类树; 热图颜色表示每行细菌目标准化后的相对丰度
图 3 不同掌叶覆盆子套种密度的板栗林土壤细菌目分层聚类
Figure 3 Hierarchical clustering analysis for bacterial order community in Chestnut soil with different inter-planting densities of Raspberry
2.5 土壤细菌与土壤因子RDA分析
分别在门和目水平上分析土壤细菌种群与环境因子关系。排序图(图6)前两轴可解释栗林土壤细菌群落变异程度的95.4%及94.6%,表明土壤环境因子对细菌群落结构影响较大,排序轴前两轴能真实地反映环境因子对细菌群落的影响程度,其中,土壤水溶性盐分含量(r=-0.802)、有效磷含量(r= 0.864)、全钾含量(r=-0.637)、速效钾含量(r=-0.946)、交换性钙(r= 0.909)以及交换性镁(r= 0.955)与轴1相关性较大。

图 4 不同掌叶覆盆子套种密度的板栗林土壤各门细菌相对丰度图Figure 4 The relative abundance of bacterial phylum in Chestnut soil with different interplanting densities of Raspberry
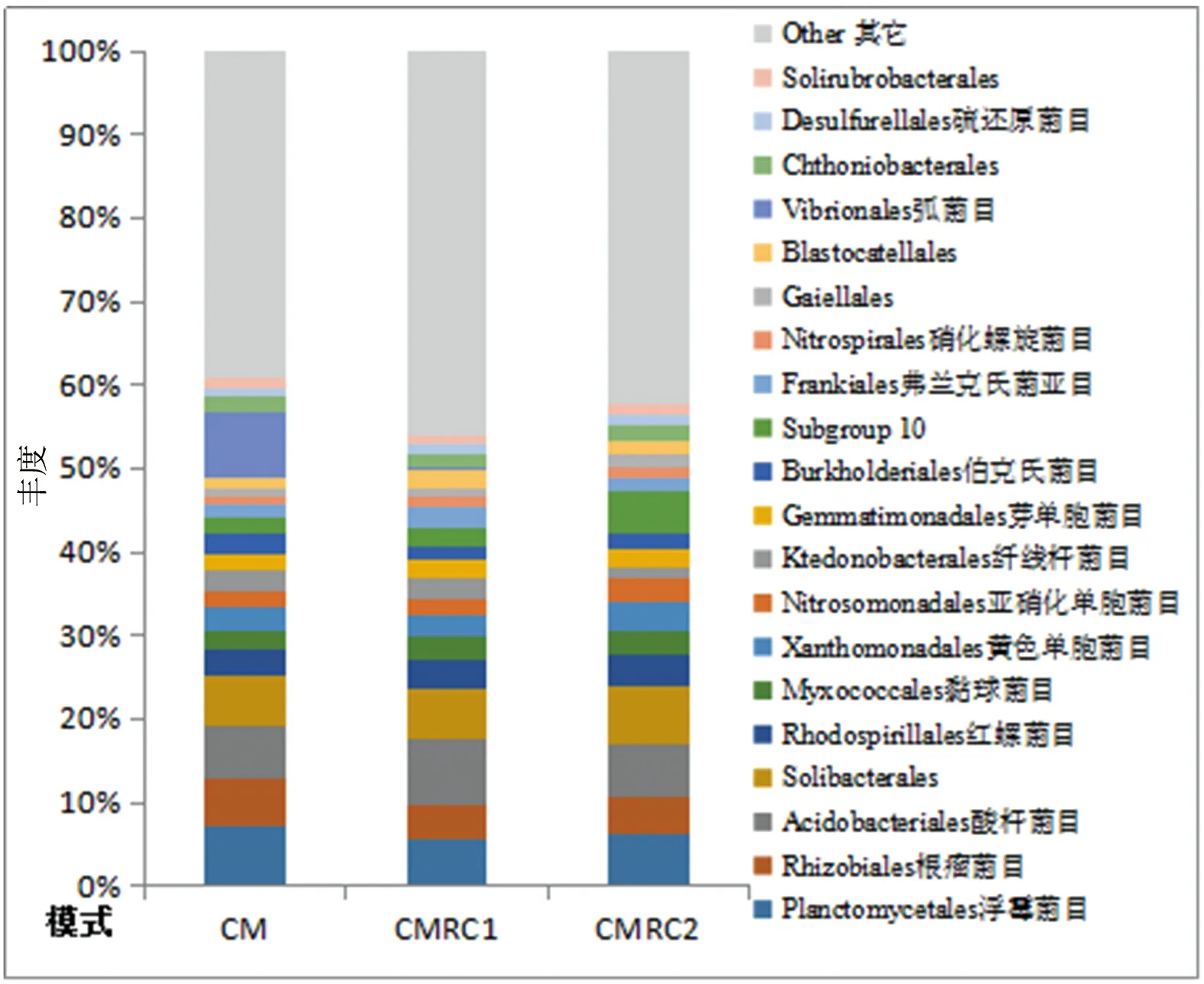
图 5 不同掌叶覆盆子套种密度的板栗林土壤各目细菌相对丰度图Figure 5 The relative abundance of bacterial order in Chestnut soil with different inter-planting densities of Raspberry
门水平上,RDA三序图(图6-A)显示绿弯菌门、GAL15、Ignavibacteriae与土壤水溶性盐分含量相关性最大;变形菌门、厚壁菌门、蓝藻门、浮霉菌门与土壤速效钾含量相关性较大;酸杆菌门与土壤水解性氮相关性最大;Latescibacteria、硝化螺旋菌门、绿弯菌门与土壤有机质含量相关性最大;疣微菌门、迷踪菌门则与掌叶覆盆子密度密切相关,奇古菌门、芽单胞菌门、装甲菌门、放线菌门与土壤交换性钙含量密切相关。目水平上(图6-B),纤线杆菌目与土壤水溶性盐分含量相关性最大;酸杆菌目、Blastocatellales与土壤全氮含量、土壤水解性氮含量密切相关;弗兰克氏菌亚目、硫还原菌目与土壤有机质含量密切相关;芽单胞菌目、红螺菌目、黏球菌目与土壤有效磷含量相关性最大;黄色单胞菌目、亚硝化单胞菌目与土壤交换性钙含量密切相关;Chthoniobacterales、Solirubrobacterales与土壤pH值密切相关。
RDA三序图也表明:门水平上,板栗纯林样本均聚集在右侧,而高密度和低密度掌叶覆盆子套种样本则共同聚集在左侧。而目水平上,各模式内样本明晰地分聚在一起。浮霉菌目、根瘤菌目、伯克氏菌目、弧菌目、伯克氏菌目与板栗纯林的3个样本(CM1、CM2、CM3)分布相关密切。酸杆菌目、Blastocatellales与CMRC1样本(CMRC1.1、CMRC1.2、CMRC1.3)分布密切相关。Solibacterales、Subgroup 10、黄色单胞菌目、亚硝化单胞菌目细菌与CMRC2样本(CMRC2.1、CMRC2.2、CMRC2.3)分布密切相关。
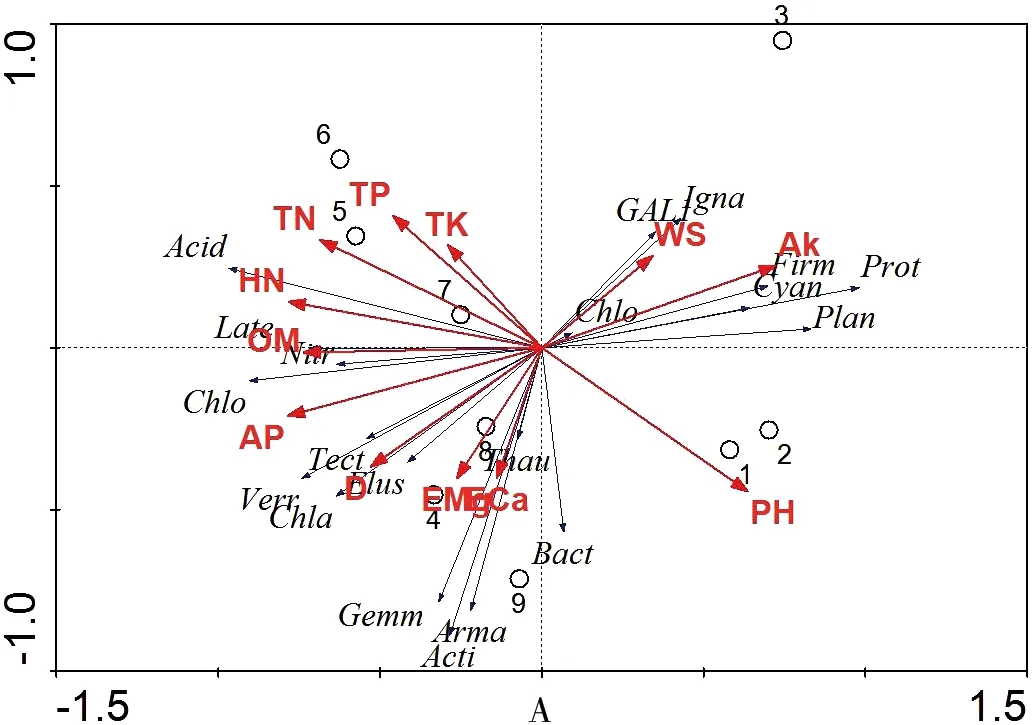

D:掌叶覆盆子密度、WS:土壤水溶性盐分含量、OM:土壤有机质含量、TN:土壤全氮含量、HN:土壤水解性氮含量、AP:土壤有效磷含量、TP:土壤全磷含量、TK:土壤全钾含量、Ak:土壤速效钾含量、ECa:土壤交换性钙含量、EMg:土壤交换性镁含量、pH:土壤pH值。1:CM1、2:CM2、3:CM3:、4:CMRC1.1、5:CMRC1.2、6:CMRC1.3、 7:CMRC2.1、8:CMRC2.2、9:CMRC2.3。优势细菌门(A图)。Acid:Acidobacteria酸杆菌门、Prot:Proteobacteria变形菌门、Acti:Actinobacteria放线菌门、Chlo:Chloroflexi绿弯菌门、Plan:Planctomycetes浮霉菌门、Verr:Verrucomicrobia疣微菌门、Gemm:Gemmatimonadetes芽单胞菌门、Bact:Bacteroidetes拟杆菌门、Nitr:Nitrospirae硝化螺旋菌门、Firm:Firmicutes厚壁菌门、Arma:Armatimonadetes装甲菌门、Elus:Elusimicrobia迷踪菌门、Cyan:Cyanobacteria蓝藻门、 GAL1:GAL15、Thau:Thaumarchaeota奇古菌门、Late:Latescibacteria、Igna:Ignavibacteriae、Chla:Chlamydiae衣原体门、Tect:Tectomicrobia、Chlo:Chlorobi绿菌门。优势细菌目(B图)。Plan:Planctomycetales浮霉菌目、Rhiz:Rhizobiales根瘤菌目、Acid:Acidobacteriales酸杆菌目、Soli:Solibacterales、Rhod:Rhodospirillales红螺菌目、Myxo:Myxococcales黏球菌目、Xant:Xanthomonadales黄色单胞菌目、Nitr:Nitrosomonadales亚硝化单胞菌目、Kted:Ktedonobacterales纤线杆菌目、Gemm:Gemmatimonadales芽单胞菌目、Burk:Burkholderiales伯克氏菌目、Subg:Subgroup 10、Fran:Frankiales弗兰克氏菌亚目、Nitr:Nitrospirales硝化螺旋菌目、Gaie:Gaiellales、Blas:Blastocatellales、Vibr:Vibrionales弧菌目、Chth:Chthoniobacterales、Desu:Desulfurellales硫还原菌目、Soli:Solirubrobacterales
图6 优势细菌门(A)和优势细菌目(B)与土壤环境因子冗余分析
Figure 6 Redundancy analysis on soil dominant bacteria phylum (A) and soil dominant bacteria order (B) constrained by soil variables
3 讨论
3.1 掌叶覆盆子套种对栗林土壤环境因子的影响
栗园套种药材后,耕作更为细密,对林地土壤理化性质有一定的改良作用,但不同养分改良效益存在差异。林下套种掌叶覆盆子后,增加了林分地被物及凋落物,固定了土壤养分[14],从而使土壤有机质、全氮、水解性氮、有效磷、全磷含量显著增加。较高的氮元素含量,也相应降低了土壤pH值。但套种密度提升后,板栗-掌叶覆盆子系统中元素需求增加,土壤有机质、水解性氮含量有所回落。钾元素为果实发育中关键元素[15-16],在掌叶覆盆子开花结实过程中大量消耗,于是系统中土壤钾元素随套种密度提升而显著下降的趋势更为明显。这些或许暗示林地套种结果作物在改良土壤的同时,也增加了系统元素需求负荷,生产中需合理控制套种密度并适时增施肥料。
3.2 掌叶覆盆子套种对栗林土壤细菌群落的影响
门分类水平上,各模式细菌组成较一致,但各门相对丰度不同。板栗纯林土壤优势菌种为变形菌门(31.2%)与酸杆菌门(29.7%),其他,放线菌门、绿弯菌门、浮霉菌门与疣微菌门也均为森林土壤的常见门类[17]。与其他研究一致[17-18],板栗纯林土壤中变形菌门数量最高,主要为弧菌目(7.8%)、根瘤菌目(5.53%)、红螺菌目(3.38%)、黏球菌目(2.23%)、黄色单胞菌目(2.61%)。其中红螺菌目多为光合细菌和固氮细菌,对生态系统氮的稳定性和土壤能量的平衡起重要作用[19]。而弧菌目、根瘤菌目、黄色单胞菌目多是植物的病原体,能够导致农作物病害[20],这些目细菌在板栗纯林土样中存在较高含量,或许与板栗纯林长年种植后,土壤中病原菌数量大量增加,益生菌数量下降等土壤遭受胁迫有关[21-22]。板栗林土壤中酸杆菌门相对含量与亚马逊原始森林等森林土壤(20%~30%)相当[23-24],而高于农田土壤样本中13%~24%的含量[25-26],也与板栗林中变形菌门数量相当。通常,酸杆菌门是土壤中仅次于变形菌门的第二大微生物类群,板栗林土壤中酸杆菌含量的提升或许和较高海拔的分布有一定关系[24]。
土壤细菌Chao1指数与分层聚类均表明,掌叶覆盆子套种可对栗林土壤细菌门群落产生影响。套种一定密度掌叶覆盆子后,才在目水平上对土壤细菌群落结构产生较大影响。这或许是套种后,土壤养分含量显著增大,促进了土壤细菌的繁殖[19, 27]。正如数据显示,土壤细酸杆菌门与放线菌门、迷踪菌门、疣微菌门、芽单胞菌门细菌以及变形菌门的红螺菌目与黏球菌目丰度显著上升。套种掌叶覆盆子后,同时也优化了土壤细菌结构[28],弧菌目、黄色单胞菌目、根瘤菌目等有害菌数量减少,其中,弧菌目最为明显,从CM样本中的7.8%骤减到CMRC1中的0.46%及CMRC2中的0.005%。而高密度套种下,土壤养分结构等较板栗纯林有较大改变,Simpson指数显著提高,土壤细菌优势度增加,多样性下降,使得土壤细菌丰度及组成结构在目水平上重新调整[19]。同样数据也显示,Solibacterales、黄色单胞菌目、亚硝化单胞菌目、纤线杆菌目、Subgroup 10则在低密度套种中变化不明显,高密度时才发生显著变化,细菌结构重新调整,逐步形成新的相对优势群落,达到一个新的相对稳定状态。
3.3 土壤细菌群落与土壤环境因子的关系
RDA结果显示,土壤有机质、氮等养分含量变化对土壤细菌群落产生影响。Magill等对森林土壤的研究表明,酸杆菌门在土壤氮循环中起重要作用,土壤氮含量的增加会使酸杆菌门多样性增加[29],同样板栗-掌叶覆盆子系统中酸杆菌门与土壤水解性氮相关性最大,酸杆菌目与土壤全氮含量、土壤水解性氮含量密切相关。同时模式间酸杆菌门相对丰度的变化和土壤氮含量的变化基本一致,这也与酸杆菌门可作为较贫瘠土壤环境指标的结论一致[30]。绿弯菌门是一类通过光合作用产生能量的兼性厌氧类细菌,其数量的变化可能同土壤中有机质增加有关[23],同样RDA结果也显示绿弯菌门与土壤有机质含量相关性最大。

