工厂化淡水养殖凡纳滨对虾甲壳溃疡症病因与防治研究
樊慧敏, 马倩倩, 商泽昊, 张子涵, 董昭然, 唐庆权, 许晓牧,王黎明, 朱若林, 鲍传和,2,3, 彭开松,2,3, 万 全
(1. 安徽农业大学 动物科技学院 水生健康与公共卫生实验室, 合肥 230036; 2. 安徽农业大学 新农村研究院江淮分水岭(定远)综合试验站, 定远 233200; 3. 安徽省现代农业产业技术体系(水产)健康养殖研究室, 合肥 230036; 4. 安徽海辉水产养殖有限公司, 定远 233200)
凡纳滨对虾(Litopenaeusvannamei),俗称南美白对虾,属节肢动物门(Arthopoda)、甲壳纲(Crustacean)、十足目(Decapoda)、游泳亚目(Natantia)、对虾科(Penacidae)、滨对虾属(Litopenaeus)[1],是世界3大养殖对虾之一,也是我国重要养殖虾类[2]。凡纳滨对虾为广温、广盐性热带虾类,是近年供给侧结构调整中重要的淡水养殖品种。因适应高密度养殖,该虾的工厂化海水或半咸水养殖发展迅速且成熟,而工厂化淡水养殖尚属起步阶段。虽然该虾的淡水养殖可能会降低弧菌病风险,却会增加氨氮和亚硝酸盐氮中毒风险[3];氮代谢废物中毒后,虾更容易感染各种条件致病菌,如舒氏气单胞菌可引起淡水养殖凡纳滨对虾红体病[4]。气单胞菌科(Aeromonadaceae)、气单胞菌属(Aeromonas)的成员广泛分布于淡水、污水、淤泥、土壤等自然环境。气单胞菌属成员分为致病株和非致病株,前者可感染几乎所有门类的动物,是淡水水生动物的重要病原菌[5],也是新发重要人畜共患病病原[6],是国家食品安全检疫的重点对象。气单胞菌可引起淡水虾的疾病[7-8],但还未见气单胞菌可引起工厂化淡水养殖凡纳滨对虾甲壳溃疡症的报道。笔者对工厂化淡水养殖凡纳滨对虾甲壳溃疡症病例进行了病因和防治研究,旨在为该病的诊断和防治提供参考。
1 材料与方法
1.1 主要试剂
培养基、药敏纸片、氧化酶试纸和细菌微量生化鉴定管均购自杭州微生物试剂有限公司;细菌基因组DNA抽提试剂盒购自生工生物工程(上海)股份有限公司;TaqDNA聚合酶购自北京康为世纪生物科技有限公司;DNA胶回收试剂盒购自爱思进生物技术(杭州)有限公司;连接试剂盒购自北京艾德莱生物科技有限公司。蛋氨酸碘(有效碘含量4.5%~6%)购自惠州市三宝生物化学科技有限公司;聚维酮碘1(有效碘含量0.2%)购自合肥中龙神力动物药业有限公司;聚维酮碘2(有效碘含量1%)购自武汉中博水产生物技术有限公司;菌毒克(有效碘含量1.5%)、应激康、大补100等购自上海绿望生物科技有限公司。
1.2 临床诊断分析
对本病例发病前后的养殖管理、水质情况和病毒及寄生虫进行了临床分析。
1.3 细菌的分离纯化和鉴定
用于细菌分离的患虾和发病池水于2016年11月取自安徽省滁州市定远县某工厂化养殖场。患虾经表面消毒和漂洗后,无菌制备肝胰腺悬浊液,用TCBS琼脂分离纯化细菌。同样培养基分离纯化发病池水中细菌。纯化细菌28℃培养16 h后,观察菌落形态,按操作手册进行革兰氏染色、氧化酶试验和发酵试验,并用细菌微量生化鉴定管进行生理生化试验。参照朱若林等[9]方法进行16S rRNA基因扩增、系统进化分析和毒力基因检测。
1.4 浸泡攻毒试验
体长(8.5±1.1)cm的淡水养殖凡纳滨对虾,养殖池水过滤后加入水族箱(水体积100 L),经过硫酸氢钾复合盐消毒后充分曝气24 h,维持水温28℃,进行本动物浸泡攻毒试验。每株菌的攻毒试验分6个试验剂量组:0 (空白对照)、105、106、107、108和109cfu/mL,50尾虾/剂量组。试验期间按虾摄食状况投饵,不排污。观察14 d,取濒死虾或刚死虾,重新进行细菌分离鉴定。
1.5 内服抗菌药物和外用消毒剂的筛选
参考国家行业(商业)检验标准(SN/T 3229—2012)[10],采用稀释-中和法进行消毒剂的药敏试验。参考欧盟标准[11],采用K-B纸片扩散法及MIC肉汤稀释法进行内服抗菌药物的药敏试验。
1.6 防治研究
根据以上病因分析和药物筛选结果,采用综合防治措施,对本病进行了防治试验。
2 结果与分析
2.1 临床诊断及病毒和寄生虫病因的排除
根据养殖记录和试验检测,对水质、管理、病毒和寄生虫等病因进行了如下分析。水源采自地下水,经检测常规离子和重金属含量符合《渔业水质标准(GB11607)》和《无公害食品淡水养殖用水水质标准(NY 5051—2001)》,出水水温30℃。经过曝气和调温后进入养殖池。水温和溶解氧24 h实时监控,水温维持在25℃~28℃之间,日水温波动在1℃以内,溶解氧维持在6~8 mg/L。每天排污2~3次。水体氨氮和亚硝酸盐含量根据投饵状况1~3 d测定1次。根据虾龄和规格投喂虾奶粉(澳华)及对虾料(0#、1#、2#)。间隔性泼洒芽孢杆菌、EM菌、乳酸菌和绿藻源等肥水产品以维持水体透明度20~30 cm。购进的P8期苗(盐度15)经过3周的淡化和标粗后,分池进行养殖。养成期间,根据水源水和定期测定的养殖池水的钠钾钙镁浓度补充钾镁钙盐,盐度不超过2。根据水质状况2~3周分池1次。养殖中除清洗水泥池外,未使用消毒剂。
患虾体长6~8 cm。病初患虾触须和附肢发红,然后逐渐出现空胃空肠,肝胰腺肿胀、微红。2~3 d后,患虾甲壳现黑色点状病灶,中心溃烂;头胸甲容易剥离,肝胰腺发红发黄、糜烂。发病前3~5 d持续阴天,发生藻类大量死亡。发病时池水氨氮浓度均高于1.1 mg/L,最高达2.0 mg/L;亚硝酸氮浓度均高于0.15 mg/L,最高达0.25 mg/L。第一栋大棚的20个养殖池,1周内陆续发病,发病池数占总池数的80%。单池发病率10%~70%不等,死亡率5%~60%不等。本次放养苗种来源于卜蜂水产(东方)有限公司。经检测,苗种和患虾的白斑综合病毒、传染性皮下及造血组织坏死病毒、桃拉综合征病毒、肠孢子虫和EMS副溶血弧菌等均为阴性。正常虾和患虾的鳃部、体表和内脏的寄生虫检查中未发现可疑虫体。综合上述初步诊断结果,本病病因可初步排除病毒和寄生虫。氨氮和亚硝酸氮超标可能是重要诱因,细菌性病原有待后续研究确定。
2.2 细菌的分离纯化和鉴定
用TCBS平板分别从患虾肝胰腺和池水分离纯化得两株优势菌,并命名为F-L株和F-W株。分离株28℃过夜培养,在TCBS表面形成表面光滑、边缘整齐、凸起的黄色圆形菌落。F-L株和F-W株经鉴定为革兰氏阴性菌,且氧化酶、赖氨酸、精氨酸、鸟氨酸、蔗糖、甘露醇及水杨苷均为阳性;6% NaCl胨水均为阴性。此外,F-L株的葡萄糖产气为发酵型,枸橼酸盐为阳性;而F-W株的葡萄糖产气为氧化型,枸橼酸盐为阴性。
根据细菌编码鉴定手册,F-L株和F-W株分别疑似凡隆气单胞菌群和嗜水气单胞菌群成员。F-L株和F-W株的16S rRNA基因测序BLAST比对显示,分别与凡隆气单胞菌和点状气单胞菌的相似性最高,均为99%,系统发育树如图1。因此,综合形态、生理生化和16S rRNA基因序列,可确定F-L株为凡隆气单胞菌,F-W株为点状气单胞菌(现已归属于嗜水气单胞菌)。
由图2可知,可从凡隆气单胞菌F-L株中检测到6种毒力基因的单一条带;而热不稳定性肠毒素Alt和弹性蛋白酶ahyB可扩增到多个条带,其中含与预计大小相符的条带(分别为442 bp和513 bp);未检测到热稳定性肠毒素Ast和溶血素hlyA。从点状气单胞菌F-W株中检测到6种毒力基因的单一条带,未检测到热稳定性肠毒素Ast、细胞毒性肠毒素Act、核酶Exu和丝氨酸蛋白酶Ser。从基因水平可知,分离株均为致病性气单胞菌。
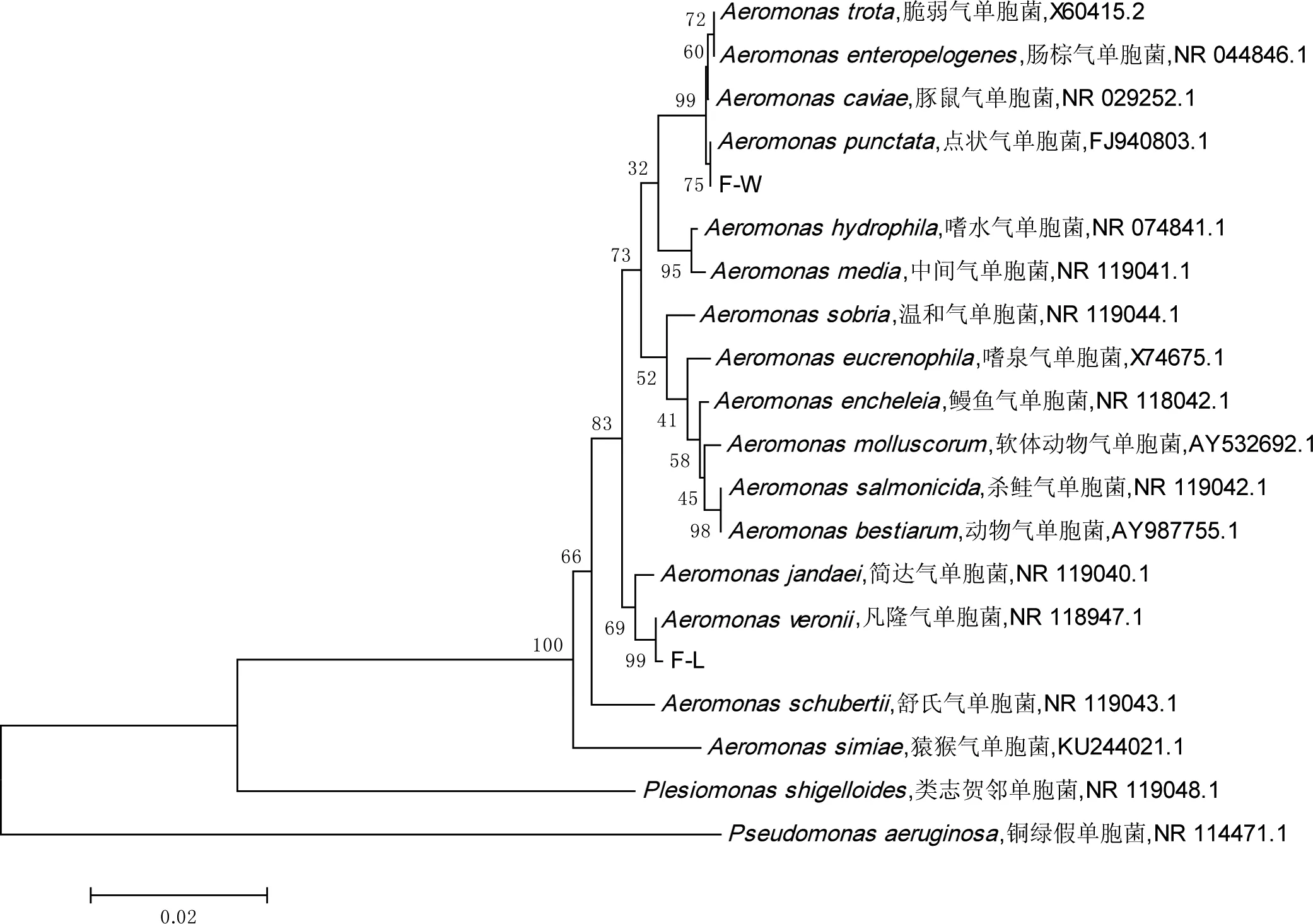
图1基于16S rRNA序列构建的 F-L株和F-W株系统进化树
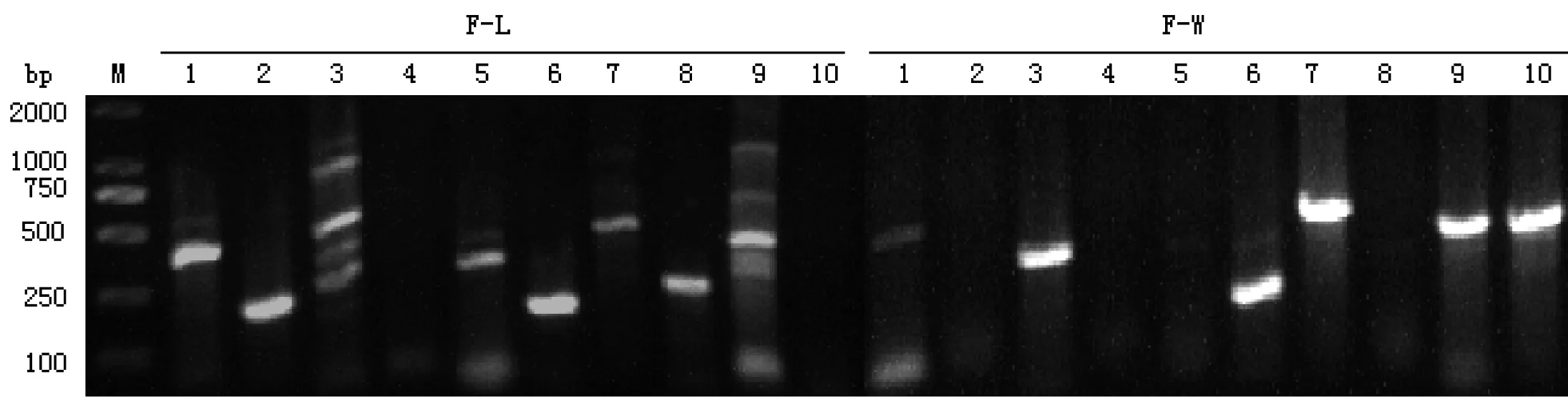
M:DNA分子质量标准DL2000;1:气溶素;2:细胞毒性肠毒素;3:热不稳定性肠毒素;4:热稳定性肠毒素;5:丝氨酸蛋白酶;6:酯酶;7:鞭毛;8:核酶;9:弹性蛋白酶;10:溶血素
图2分离株毒力基因的PCR扩增电泳图
Figure 2 PCR amplification of virulence genes of F-L and F-W
2.3 浸泡攻毒回归试验
凡纳滨对虾在攻毒后5~10 d相继发病,2株菌均能不同程度地引起虾的死亡,并有个别死亡虾有甲壳溃疡症状,使用简化寇氏法计算LD50。F-L株的各攻毒组随攻毒浓度升高(106、107、108和109cfu/mL)发病率依次为14%、44%、64%及96%;死亡率依次为6%、32%、54%及90%,其LD50为107.68cfu/mL。F-W株的各攻毒组随攻毒浓度升高(106、107、108和109cfu/mL)发病率依次为18%、42%、60%和86%;死亡率依次为10%、32%、48%和80%,其LD50为107.8cfu/mL。人工感染发病虾肝胰腺分离菌的经检测为攻毒所用菌株。
2.4 外用消毒剂和内服抗菌药物的药敏试验
菌毒克对两株分离菌的杀灭效果最好,MIC均为1.88 μL/mL,其次为蛋氨酸碘,对两株菌的MIC均为3.75 μL/mL。防治试验也显示菌毒克对甲壳溃疡虾的预防和治疗效果最好。此外,使用聚维酮碘1+菌毒克(1∶1)和聚维酮碘2+菌毒克(1∶1)对两株菌的MIC均为3.75 μL/mL;而单用聚维酮碘1对两株菌的MIC均为833.33 μL/mL,单用聚维酮碘2对两株菌的MIC均为30 μL/mL。
纸片法测定了2株菌对19种抗菌药物的敏感性(表1)。两株分离菌对甲氧苄啶、诺氟沙星、新霉素、恩诺沙星、氧氟沙星、氯霉素、庆大霉素、卡那霉素、新霉素和交沙霉素均敏感;F-L株对氟苯尼考、红霉素敏感,对头孢噻吩、环丙沙星和强力霉素中敏;F-W株对环丙沙星敏感,对强力霉素和红霉素中敏。进一步采用MIC法测定了2株菌对14种抗菌药物的敏感性,结果如下:氨苄西林钠、磺胺嘧啶、磺胺甲噁唑、磺胺间甲氧嘧啶、磺胺二甲嘧啶、盐酸土霉素及交沙霉素对F-L株和F-W株的MIC均大于或等于256 μL/mL。硫氰酸红霉素和甲砜霉素对F-L株和F-W株的MIC均为128 μL/mL。强力霉素和氟苯尼考对F-L株和F-W株的MIC分别为16和64 μL/mL。硫酸新霉素对F-L株和F-W株的MIC分别为8和128 μL/mL;恩诺沙星对F-L株和F-W株的MIC分别为16和32 μL/mL;盐酸环丙沙星对F-L株和F-W株的MIC分别为4和16 μL/mL。
综合两种方法测定所得的内服抗菌药物敏感性试验结果,可使用的国标渔药只有恩诺沙星;后续防治试验也进一步证实了内服恩诺沙星对本病有效。
2.5 防治试验效果
根据以上病因分析和试验,采用外用和内服相结合的方法,进行了防治试验。
外用方案以全池泼洒为主。第1天使用菌毒克0.5 g/m3;第2天上午使用硫代硫酸钠中和碘,下午使用“稳水110”和“亚硝克”吸附氨氮和亚硝酸氮,晚上将吸附氨氮和亚硝酸氮后的沉积物排出;第3天开始依次使用乳酸菌、光合细菌、芽孢杆菌、酵母菌调水,同时每天使用小球藻培藻直到无新增病例。每天3次排出死虾。
内服方案采用伴料内服。恩诺沙星、应激康和三黄散拌料内服3 d;第4天开始使用乳酸菌、应激康、大补100和保肝宁拌料内服7 d。待虾康复后,继续使用乳酸菌、大补100和应激康保护虾的肠肝。
经过上述综合处理后,除少部分(约占30%)发病严重的池外,大部分池中的患虾均相继康复。
3 讨论
凡纳滨对虾甲壳溃疡症的病原可能为弧菌、假单胞菌、革兰氏阳性菌及真菌等[12]。虽然气单胞菌可普遍引起鱼类皮肤溃疡病[13-14],但未见其引起虾甲壳溃疡的报道。本研究中的凡隆气单胞菌F-L株和点状气单胞菌(现划归为嗜水气单胞菌)F-W株不仅携带多种典型的气单胞菌毒力基因,且人工浸泡感染均能引起淡水养殖凡纳滨对虾的甲壳溃疡症。凡隆气单胞菌和嗜水气单胞菌都可以分泌几丁质酶[15-16],该酶能分解虾甲壳中的几丁质,进而引起甲壳溃疡。分离菌敏感的外用消毒剂和内服抗菌药物能在一定程度上控制该病发展,从防治角度进一步验证分离菌是本病病原。综上可知,凡隆气单胞菌F-L株和点状气单胞菌(现在归属于嗜水气单胞菌菌群)F-W株是引起本病例中甲壳溃疡的病原。
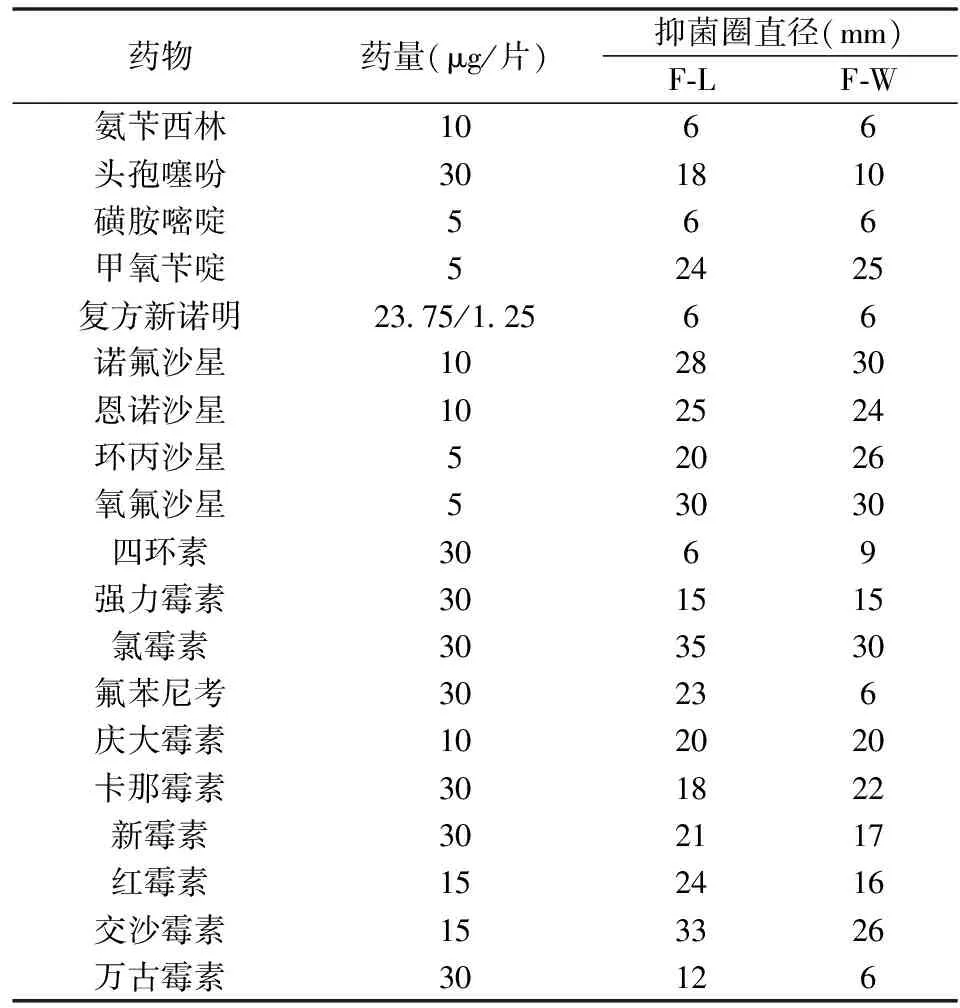
表1 内服抗菌药物的药敏试验
注:药敏纸片直径约6 mm、厚度约1 mm,平板琼脂饼厚度平均约5 mm
水体中的高氨氮和高亚硝酸氮是诱发水产动物气单胞菌的重要因素[3]。本研究也发现只有维持良好水质,特别是菌藻平衡、降低水体中氨氮和亚硝酸氮达到正常水平才能彻底治愈本病。水产动物源气单胞菌的耐药现象非常常见[17-18],本研究结果也看到类似现象。益生菌、中草药和寡糖防控凡纳滨对虾细菌病已有不少试验和实践验证[19-21],本研究中的防治试验也证实了这些非抗菌药物在防控细菌感染上的有效性。同时,笔者也发现部分发病池虾在内服恩诺沙星、外用菌毒克后,能在给药期间一定程度地控制死亡;但停药后死亡率又有所反弹,直到水质调控良好、经微生态制剂和保肝利胆健脾中草药调理好肠肝功能后,病情才彻底缓解。
因此,需要从病原、水环境和宿主3方面着手,做到控制水体病原菌数量和阻断病菌入侵虾体、维持良好的水环境(特别是菌藻平衡下的低氨氮和低亚硝酸盐氮)以及做好虾的肠肝保健,才能有效防控本病。

