人型结核分枝杆菌H37Ra在构建实验性自身免疫性重症肌无力大鼠模型中的应用
井 峰,陈 兵
重症肌无力(myasthenia gravis,MG)是一种T细胞依赖、B细胞介导的自身免疫性疾病,其主要发病机制为突触后膜乙酰胆碱受体(acetylcholine receptor,AChR)破坏,导致神经肌肉接头传递障碍,进而引起骨骼肌无力。实验性自身免疫性重症肌无力(experimental autoimmune myasthenia gravis,EAMG)动物模型因发病机制、临床表现、电生理特点、免疫学特点等方面与人类MG相似,已成为研究MG重要的工具,被广泛地用于MG发病机制的研究及治疗方案的探索。构建EAMG动物模型有多种方法,近年来国内多项实验均使用大鼠源性AChR蛋白α亚单位97-116肽段(R97-116)为免疫原接种大鼠而建立EAMG动物模型进行研究[1, 2]。按照现有实验方案,使用R97-116为免疫原造模时需使用结核菌H37Ra作为耗材。H37Ra是人型结核分枝杆菌的减毒株,其具有H37Rv毒株的免疫原性,但无致病性[3]。H37Ra在我国尚无试剂公司进行规模化生产,国外虽有商品化制剂,但由于试剂管控原因,难以从正规途径获得。是否可以在缺少H37Ra的情况下仍能以R97-116为免疫原成功建立EAMG模型尚未可知,查阅文献目前无相关研究报道。在本研究中,我们将以R97-116为免疫原接种Lewis大鼠,探讨H37Ra在该方案中的作用机制。
1 材料与方法
1.1 材料 实验动物使用雌性近交系SPF级Lewis大鼠,6~8周龄,平均体重(157.62±6.43)g,采购于北京维通利华有限公司。实验动物共30只,分为实验组、对照组、空白对照组,每组10只。3组动物在完全相同的条件下饲养于我院实验动物中心。R97-116肽段序列为D GD F A I V K F T K V L L D Y T G H I,分子量为2252.57,产品纯度>95%,委托金斯瑞生物技术公司合成。完全弗氏佐剂(complete Freund’s Adjuvant, CFA)和不完全弗氏佐剂(incomplete Freund’s Adjuvant, IFA)均购于sigma公司。PBS缓冲液,购于北京中衫金桥生物技术有限公司。结核菌H37RA干粉购于BD(Difico)公司。大鼠AChR-Ab ELISA检测试剂盒,购于北京瀚科恒誉生物科技有限公司。
1.2 方法 本实验参照Baggi等[4]的造模方法进行操作。将R97-116溶于PBS溶液中,配制浓度为1 mg/ml。首次接种时,R97-116溶液、CFA、PBS按照1∶1.5∶1.5进行配比,充分震荡混匀制成乳剂。使用微量注射器在大鼠足垫、背部、腹部多点进行皮下注射,每只大鼠注射混合乳剂共200 μl。实验组所用乳剂每200 μl中加入H37RA干粉1 mg,对照组不添加H37Ra,空白对照组在皮下注射等量生理盐水。首次接种后的30、45、60 d进行强化接种。强化接种试剂按以下方案配比:R97-116、IFA、PBS比例1∶1.5∶1.5,混合震荡为乳剂。使用微量注射器在大鼠足垫、背部、腹部多点进行皮下注射,每只大鼠注射混合乳剂200 μl。实验组所用乳剂每200 μl中加入H37RA干粉1 mg,对照组不添加H37Ra,空白对照组在相同时间于皮下注射等量生理盐水。
1.3 临床评估及抗体检测 实验动物每周称重1次。对大鼠进行分级前先使大鼠反复抓握笼顶30 s,以模拟疲劳试验的效果。动物模型临床症状评估采用Lennon等[5]制定的大鼠EAMG动物模型临床分级标准:0级,未出现无力症状;1级,活动轻度减少、撕咬无力、抓握力或叫声减弱且易疲劳,尤其在重复抓握活动后更明显;2级,无力症状明显,在抓握前就出现震颤、低头、隆背、抓握力弱;3级,在抓握前即有严重的肌无力表现,无力抓握,处于濒死状态;4级,死亡。症状居中者评分分别为 0.5、1.5、2.5、3.5。麻醉大鼠后于尾静脉取血,离心后取血清,使用ELISA法对所取血清的抗体进行检测。
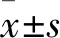
2 结 果
实验前5周各组大鼠均未出现明显肌无力症状,Lennon分级均为0。第6周后实验组大鼠出现明显肌无力表现,部分死亡;对照组仅有2只出现轻微症状,其余正常。空白对照组大鼠无异常表现。至结束时,实验组Lennon分级:4级3只,3~3.5级2只,2~2.5级2只,1~1.5级2只,0级1只。对照组1级2只,其余8只均0级。空白对照组均0级。实验组中Lennon分级为1~3.5级的6只大鼠AChR抗体检测均为阳性,0级的大鼠可疑阳性。对照组中Lennon分级为1级的2只大鼠中1只抗体可疑阳性,另1只阴性,Lennon分级为0级的8只大鼠抗体为阴性其余8只大鼠均为阴性。空白对照组抗体检测均为阴性。实验结束时,实验组大鼠接种处皮肤出现脱毛、溃烂、结痂,足垫肿胀明显并伴有炎性渗出物,提示局部炎性反应(图1A、B),大鼠活动明显减少,撕咬、鸣叫力弱,静止状态下呈隆背姿态(图1C、D),可发现明显震颤,以上症状在持续抓握笼顶或活动后更为明显,肌无力症状明显,同时体重降低。对照组大鼠仅在局部接种处出现炎性反应,未观察到明显肌无力症状,仅2只大鼠出现轻微无力症状。空白对照组未发现异常变化。实验结束时,实验组大鼠体重[(190.21±8.35)g],较对照组[(243. 22±7.98)g]和空白对照组[(251.22±5.81)g]低,差异均有统计学意义(P<0.05);对照组与空白对照组比较,差异无统计学意义(表1)。
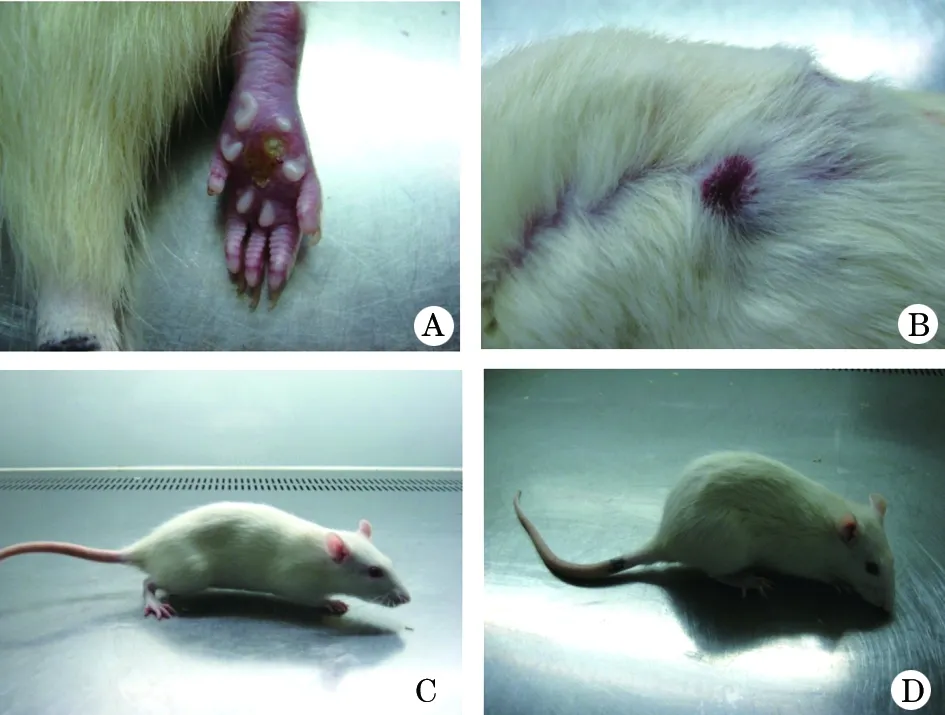
图1 实验组大鼠接种处及活动状态
A、B.实验组大鼠足垫、皮肤接种处出现肿胀、溃烂等局部炎性反应;C.正常大鼠静止状态下的姿态;D.实验组大鼠活动减少,静止状态下低头、隆背
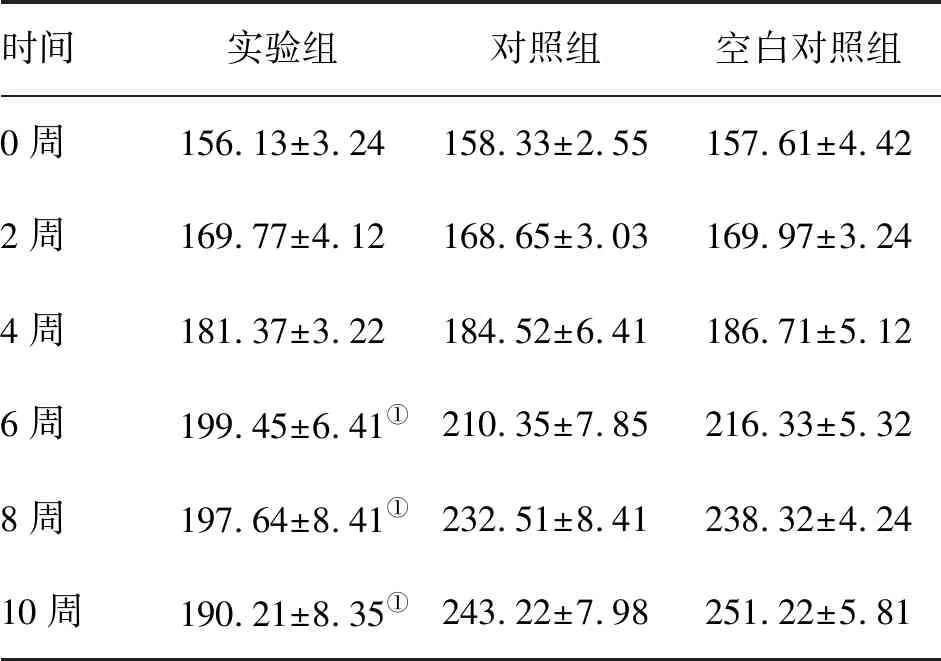
时间实验组对照组空白对照组0周156.13±3.24158.33±2.55157.61±4.422周169.77±4.12168.65±3.03169.97±3.244周181.37±3.22184.52±6.41186.71±5.126周199.45±6.41①210.35±7.85216.33±5.328周197.64±8.41①232.51±8.41238.32±4.2410周190.21±8.35①243.22±7.98251.22±5.81
注:与对照组、空白对照组比较,①P<0.05
3 讨 论
据文献[6]记载,首只EAMG动物模型是Patrick在1973年使用从电鳗中提纯AChR蛋白接种免疫家兔构建而成。此后的研究发现大鼠、小鼠、豚鼠、猴均可用于EAMG模型的建立,其中又以大鼠最为常用。EAMG建模方案包括主动和被动免疫,主动免疫建模的过程与人类MG的发病过程及病理机制更为接近且实验操作相对简便,所以被多数实验所采用,使用提纯的电鳗电器官AChR蛋白为免疫原最为经典。然而电鳗在我国数量少且不易捕获,且分离提纯AChR蛋白的过程复杂,免疫原获取困难限制了该方案的应用。1990年Zhang等[7]的研究发现以人工合成的电鳗AChR蛋白α亚单位肽段为免疫原可诱导大鼠建立EAMG模型。随后Baggi等[4]的研究发现,与异种肽段相比,鼠源性肽段可更稳定、有效地建立大鼠EAMG模型。研究发现以R97-116为免疫原建模成功率最高,该方案近年来已被多项研究所采用[8]。以往文献报道使用该方法成模率>70%,本项研究中成模率相对较低可能与样本量较小有关。
T淋巴细胞的抗原决定簇为小分子多肽片段,肽段序列的线性排列顺序决定T细胞识别的特异性[9],这是人工合成肽段用于建立免疫相关模型的理论基础[10]。但R97-116肽段作为AChR蛋白所包含的众多免疫决定簇之一仅可被大鼠T淋巴细胞所识别,因此所产生的免疫应答较弱。H37Ra具有完整的抗原性,可充分激活巨噬细胞,同时显著上调IL-12、TNF-α的表达;巨噬细胞吞噬H37Ra后经MHC分子途径激活CD4+T淋巴细胞进而激活细胞免疫;而活化的CD4+T细胞所分泌的INF-γ则可进一步激活巨噬细胞[11]。H37Ra可通过诱导巨噬细胞和CD4+T相互作用而刺激和放大免疫反应[12]。如前文所述R97-116肽段免疫原性较弱,接种大鼠后可能难以刺激机体产生明显的特异性免疫应答,这可能是对照组不能成功建模的原因。而实验组中使用H37Ra后有效地激活了大鼠的免疫系统,使其对免疫原性较弱的肽段产生免疫应答,进而产生AChR抗体并建立EAMG模型。
笔者观察到对照组中少量动物出现较轻微的无力症状,AChR抗体可疑阳性。这可能与本研究所使用的CFA有关,该试剂中含有少量H37Ra,但由于含量少,不能充分激活大鼠免疫系统,因此对照组仅有少量大鼠对R97-116产生免疫应答并出现轻微肌无力症状。仅使用R97-116和CFA并不能成功构建稳定、符合实验标准的EAMG动物模型。
本研究提示H37Ra在以R97-116肽段为免疫原建立EAMG动物模型的实验中有关键意义,在缺少H37Ra的情况下不能成功建模。H37Ra在该EAMG模型中的具体作用机制仍需从细胞学和分子生物学等多角度进一步研究。

