p53调控信号转导子和转录激活子3对肺癌细胞增殖及凋亡的影响
赵振山, 李海洋,赵振兴,代 岱,郝孟辉
目前,肺癌已成为中国发病率最高的癌症,病死率位居恶性肿瘤第一位[1]。肺癌大多发生于中老年人,但随着烟草暴露、空气污染、职业暴露、肺部疾病史、家族史等情况,逐年呈低龄化趋势发展[2,3]。目前,肺癌5年生存率依旧较低,预后较差[4,5],临床缺乏较高灵敏度和特异度的早期筛查手段。肿瘤蛋白53(protein 53,p53)作为肿瘤抑癌基因之一,可调节一系列靶基因的活性,影响细胞生物学特性,参与众多肿瘤发展进程[6- 8]。信号转导子和转录激活子(signal transducer and activator of transcription,STAT)家族是一组介导细胞信号转导的转录因子[9]。临床已有研究,STAT3过度激活或表达介导多种恶性肿瘤,具有抑制其增殖和凋亡能力[10]。本研究旨在探讨p53调控信号转导子和转录激活子3(STAT3)信号通路在肺癌中的表达及其对肺癌增殖及凋亡的影响,从而验证p53作为肺癌治疗的候选靶点的可行性。
1 材料与方法
1.1 材料与试剂 人肺癌细胞系A549(购自美国模式菌种收集中心);洛斯维·帕克纪念研究所(RPMI)-1640培养液(invitrogen,gaitherburg,MD,USA);CO2培养箱(美国Forma公司);p53 siRNA(上海吉玛公司,中国);Opti-MEM、lipo2000试剂(Invitrogen公司,USA);蛋白酶抑制剂混合物(Roche公司,瑞典);聚偏二氟乙烯膜(polyvinylidene difluoride,PVDF)购自(Amersham pharmacia biotech公司);鼠抗人p53、STAT3(购自艾博抗贸易有限公司);细胞计数试剂盒-8(CCK-8)试剂盒(Dojindo 研究所,日本);自动酶联免疫检测仪(上海酶联生物科技有限公司);FACS Calibur流式细胞仪分析(BD公司,USA)。
1.2 方法
1.2.1 细胞培养 人肺癌细胞系培养于37 ℃、5%CO2、湿度95%的CO2培养箱。细胞传代贴壁率应达90%。磷酸缓冲盐溶液(phosphate buffer solution,PBS)冲洗2次,0.25%胰酶消化,吹打成单细胞悬液。
1.2.2 细胞分组及转染 细胞分组:空白对照组(不转染任何序列)、阴性对照组[转染无义小干扰RNA(small interference RNA,siRNA)对照,用于做p53的对照]、p53 siRNA组(转染p53 siRNA)、p53 siRNA+STAT3 siRNA组(同时转染p53 siRNA和STAT3 siRNA)。吸取15 μl(50 μmol/L)siRNA,加入100 μl Opti-MEM中,加入lipo2000试剂进行稀释并混匀,静置5 min,siRNA与lipo2000混合,室温20 min。加入800 μl无血清培养液,将混合物加到细胞中。细胞培养6 h,更换全新培养液,转染48 h,收获细胞。
1.2.3 Western Blot检测p53、STAT3表达 取细胞,加蛋白裂解液,静置冰上30 min。4 ℃,1200 r/min,离心10 min,取上清液分装于离心管,-20 ℃保存。电泳80 V转120 V,电泳至溴酚蓝达凝胶底边。湿转转移到PVDF膜。取PVDF膜,5%脱脂牛奶封闭。加入一抗(鼠抗人p53,STAT3),4 ℃过夜,Tris缓冲盐水-Tween(TBST)缓冲液洗3次,每次10 min,加入二抗,室温旋转孵育1 h,TBST洗3次;以β-actin为对照,进行化学发光,X线片压片、显影、定影,数据分析。
1.2.4 细胞增殖试验 新鲜完全培养液中重悬,接种于 96 孔板中,每组 5 个重复孔。使用 CCK-8 试剂盒,按说明书操作实验流程。于转染后 0、24、48、72 和 96 h 时,选择波长为450 nm处测定各孔的吸光度(D)值。
1.2.5 流式细胞术AV-PI双染法检测A549细胞凋亡水平 利用siRNA对A549细胞中p53和STAT3进行敲减,于48 h获待测细胞,制成单个细胞悬液,收集细胞沉淀,加入200 μl染液[1 ml 结合缓冲液 + 50 μl 膜联蛋白Ⅴ(Annexin V)];将样品置于冰上染色30 min,后采用FACS Calibur流式细胞仪分析。
1.2.6 细胞划痕试验 待细胞融合度为 80%~90% 时,于培养板各孔底部使用 200 μl 微量移液器滴头划横线伤口。随后使用PBS 清洗1次,更换无血清培养液,使用倒置显微镜观察不同时间(0、12、24、36 h )划痕情况并拍照。
1.2.7 Transwell小室迁移实验 备置单细胞悬液,调整细胞浓度(1×105/ml)。上室滴入100 μl细胞悬液,下室加入500 μl含10%胎牛血清完全培养液, 37 ℃,5% CO2饱和湿度进行细胞培养。20~22 h后终止培养取出,洗涤上室未穿透膜细胞(×3),甲醇固定15 min。苏木精(HE)染色10 min,风干,中性树胶封片。正置荧光显微镜观察细胞穿膜数(5个高倍视野)。
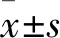
2 结 果
2.1 Western blot检测p53,STAT3蛋白的表达 p53蛋白表达在p53 siRNA组、p53 siRNA+STAT3 siRNA组明显上升,差异有统计学意义(P<0.05);空白对照组和阴性对照组比较,差异无统计学意义(P=0.340)。p53siRNA组、p53siRNA+STAT3 siRNA组均明显抑制了 STAT3的表达,与空白对照组和阴性对照组比较,差异有统计学意义(P<0.05,图1)。空白对照组和阴性对照组STAT3蛋白表达差异无统计学意义(P=0.364)。

图1 p53和STAT3电泳条带
2.2 p53靶向STAT3对A549生长的影响 CCK8检测结果表明,与空白对照组和阴性对照组比较, p53 siRNA组,48、72、96 h细胞生长速度增长明显,差异均具有统计学意义(P<0.05);与p53 siRNA组相比,p53 siRNA+STAT3 siRNA组利用siRNA敲减STAT3后,48、72、96 h细胞生长速度显著受到抑制,差异具有统计学意义(P<0.05,表1)。
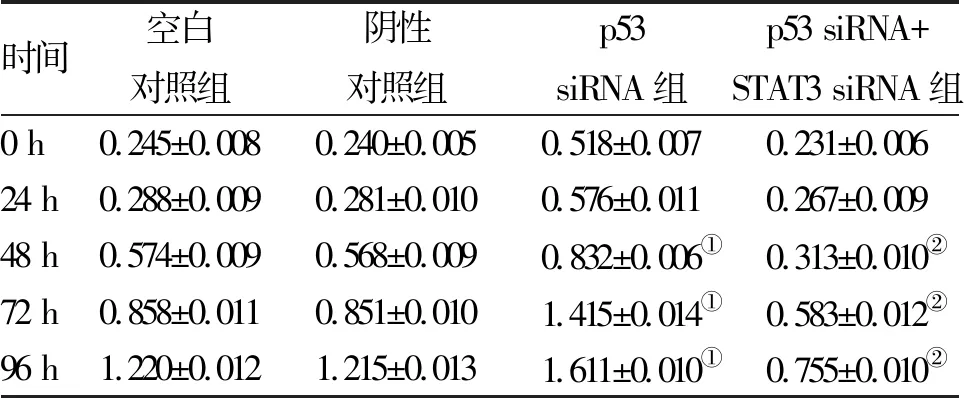
时间空白对照组阴性对照组p53siRNA组p53 siRNA+STAT3 siRNA组0 h0.245±0.0080.240±0.0050.518±0.0070.231±0.00624 h0.288±0.0090.281±0.0100.576±0.0110.267±0.00948 h0.574±0.0090.568±0.0090.832±0.006①0.313±0.010②72 h0.858±0.0110.851±0.0101.415±0.014①0.583±0.012②96 h1.220±0.0121.215±0.0131.611±0.010①0.755±0.010②
注:与空白对照组和阴性对照组比较,①P<0.05;与p53 siRNA组比较,②P<0.05
2.3 p53表达水平改变后细胞各项能力的对比
2.3.1 流式细胞术AV-PI双染法检测p53对A549细胞的影响 流式细胞术AV-PI双染法检测结果表明,转染p53的siRNA 48 h后, p53 siRNA组、p53 siRNA+STAT3 siRNA组A549细胞的凋亡率明显高于空白对照组和阴性对照组,差异均有统计学意义(P<0.05,表2)。
2.3.2 p53表达水平改变后细胞迁移能力的影响 细胞划痕实验结果显示:与空白对照组和阴性对照组比较,p53 siRNA组和p53 siRNA+STAT3 siRNA组p53过表达后A549细胞的迁移速度均呈显著上升,差异有统计学意义(P<0.05,表2);空白对照组和阴性对照组细胞迁移速度相比差异无统计学意义(P=0.770)。
2.3.3 p53表达水平改变后细胞侵袭能力的影响 Transwell实验结果显示:p53过表达后,空白对照组和阴性对照组比较,组间穿膜细胞数差异无统计学意义(P=0.517),p53 siRNA组和p53 siRNA+STAT3 siRNA组A549细胞的穿膜细胞数较空白对照组和阴性对照组明显增多,差异均有统计学意义(P<0.05,表2)。
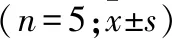
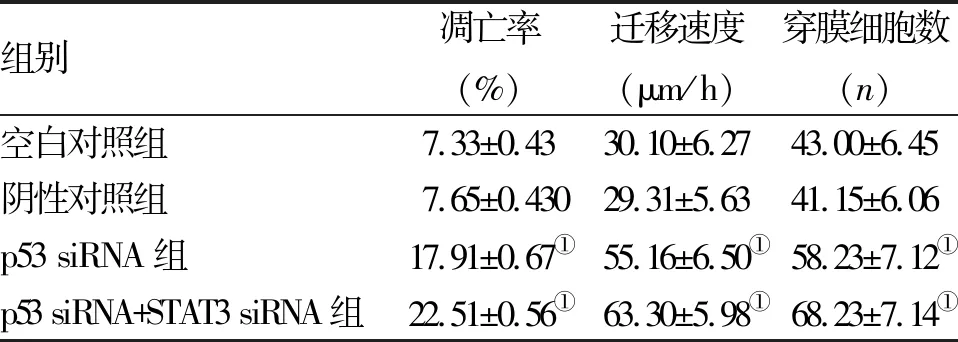
组别凋亡率(%)迁移速度(μm/h)穿膜细胞数(n)空白对照组7.33±0.4330.10±6.2743.00±6.45阴性对照组7.65±0.43029.31±5.6341.15±6.06p53 siRNA组17.91±0.67①55.16±6.50①58.23±7.12①p53 siRNA+STAT3 siRNA组22.51±0.56①63.30±5.98①68.23±7.14①
注:与空白对照组和阴性对照组比较,①P<0.055
3 讨 论
目前,国内外对肺癌的治疗研究逐渐向研发新的治疗靶点与利用多种免疫靶向治疗结合多种小分子靶向治疗等模式发展[11]。已有研究人员从各个角度研究影响A549细胞的增殖、迁移、凋亡及侵袭的复杂机制[12],并发现许多种基因与A549细胞有密切关系。其中p53就是一种真正的原癌基因,在刺激性环境下,p53表达的上调可促进肿瘤细胞的生长。
p53基因的表达一般受转录和转录后两种水平调控,其表达一般较低,而经刺激后水平显著上升。异常p53表达导致细胞周期失控,促进某些癌基因激活,使细胞无限增长,进而导致肿瘤侵袭能力增加。同时,在多种肿瘤细胞中,STAT3在缺氧条件下活化,刺激多种促肿瘤血管生成因子的形成,例如血管内皮生长因子(vascular endothelial growth factor,VEGF),从而促进肿瘤血管的生长,导致癌细胞的生长[13,14]。STAT3的活化能够增强免疫逃逸,提示我们抑制STAT3活性(表达)可抑制免疫逃逸,增强机体抗肿瘤的免疫功能。下调STAT3的表达可显著抑制肿瘤细胞的生长[15]。
本研究设计构建了STAT3 siRNA片段和p53 siRNA片段,通过流式细胞术AV-PI双染法、细胞划痕实验、Transwell实验结果显示,p53 siRNA组和p53 siRNA+STAT3 siRNA组A549细胞各项能力与空白对照组和阴性对照组比较,差异均有统计学意义,说明肺癌中p53呈高表达,且与STAT3表达呈负相关, p53通过靶向STAT3,下调其表达,可促进A549细胞生长与侵袭,抑制其凋亡。推测STAT3可在某种机制下对肿瘤生长产生干预效应,可作用于肺癌的变化发展上。文献[6]在研究中指出,STAT3能够激活抗凋亡基因[如B淋巴细胞瘤-2基因(B-cell lymphoma,Bcl-2)]和细胞周期控制基因[如G1/S-特异性周期蛋白-D1(cyclinD1)]等基因的表达,进而影响肿瘤细胞周期变化,创造利于肿瘤生长的环境[16]。
国外研究证实,STAT3在胆管癌的发生发展中可成为p53的直接靶点,p53功能的丧失可激活JAK2-STAT3信号传导,从而促进肿瘤基质的改变和肿瘤生长及对吉西他滨的抵抗[17],可进一步推测p53通过靶向调控STAT3表达产生相关协同效应而导致肺癌细胞的增殖、迁移及凋亡。结果提示,通过探究p53靶向STAT3的机制及潜在作用,可有助于我们寻找减缓肿瘤生长、改变细胞浸润的治疗方案。
综上所述,p53在肺癌中高表达,与STAT3蛋白表达呈负相关,从而促进A549细胞生长与侵袭,抑制其凋亡。因此,p53可能作为一种新的肺癌治疗靶向分子,为恶性肿瘤的诊断及预后提供了一个新的渠道。但本研究只进行了体外细胞系的验证,下一步需增加体内实验的验证。另外p53是否还会通过其他途径影响肺癌的增殖、迁移和凋亡,还需进行深入地研究。

