模拟正畸静压力刺激牙周膜干细胞增殖的TGFβ/STAT信号通路探讨
刘 黎,赵新华,秦志勇
随着人们生活水平的提高和对生活品质的重视,牙齿正畸在临床上得到越来越广泛的应用[1-2]。牙齿正畸是通过牙齿在机械力的作用下使之沿牙槽骨移动达到牙周组织的适应性改建的目的[3]。牙周膜干细胞是牙周组织再生的关键细胞,具有广泛增殖和分化成基质细胞的潜能[4]。细胞凋亡是细胞的自主过程,但是目前尚未见到关于牙齿正畸过程中对牙周膜干细胞影响的报道[5]。TGFβ/STAT信号通路参与了细胞内的多种生理及病理过程,且与牙周疾病的发病和治疗密切相关[6]。本研究旨在分析模拟正畸静压力刺激牙周膜干细胞增殖的TGFβ/STAT信号通路参与机制,为相关研究提供参考。
1 材料与方法
1.1 细胞及试剂 牙周膜干细胞采用全牙消化法原代培养(材料来自我院颌面外科正畸拔除的前磨牙),经低密度接种法筛选培养至第4代并经成骨诱导和成脂诱导后检测相关蛋白确认后作为研究材料(培养条件37 ℃、5%二氧化碳)。细胞总蛋白提取试剂盒购自碧云天公司;α-MEM培养液购自Gibco公司;胎牛血清购自杭州四季青公司;PPARγ及lpl第一抗体购自R&D公司;ALP及sp7第一抗体购自美国Abcam公司;二抗及显色试剂盒购自武汉博士德生物工程有限公司;Bax及Bcl2一抗购自Santa Cruz公司;酶标仪购自累杜公司;超净工作台购自赛默飞世尔公司;倒置显微镜购自日本奥林巴斯公司;二氧化碳细胞培养箱购自赛默飞世尔公司;高速冷冻离心机购自Eppendorf公司;垂直电泳仪及转膜仪购自伯乐公司。
1.2 分组及处理方法 成骨诱导和成脂诱导后确认的牙周膜干细胞培养至状态良好后进行处理:加压至100 kPa分别处理1、6、12 h,检测细胞的增殖及相关蛋白的表达情况。注意确认加压过程中加压舱的密闭性和恒定性。将同类型牙周膜干细胞置于相同的加压舱内但不进行加压作为对照组。
1.3 Western blotting法 将加压处理组和对照组细胞提取总蛋白并定量后,以相同量总蛋白进行SDS-PAGE垂直电泳。电泳结束后进行半干法转膜(30 min,330 mA)。转膜后将硝酸纤维素膜进行BSA的封闭。然后将封闭后的纤维素膜与待检测分子的一抗(1∶200)进行孵育90 min,冲洗3次后将冲洗后的纤维素膜与二抗(1∶600)进行杂交90 min。PBS冲洗后进行显色,拍照。
2 结 果
2.1 多向分化能力鉴定牙周膜干细胞 牙周膜干细胞经成脂诱导后PPARγ蛋白和lpl蛋白的表达水平明显升高(P<0.05,表1),牙周膜干细胞经成骨诱导后ALP蛋白和sp7蛋白的表达也明显升高(P<0.05,图1)。

图1 多向分化能力鉴定牙周膜干细胞
2.2 加压处理对牙周膜干细胞细胞增殖影响 与对照组相比,牙周膜干细胞经加压处理1 h和6 h后增殖被显著抑制(P<0.05),且Bax的表达明显升高(P<0.05)而Bcl2的表达明显降低(P<0.05),而处理12 h细胞的增殖情况及上述蛋白表达比较差异无统计学意义(P>0.05,图2、3,表2)。

图2 加压处理对牙周膜干细胞细胞增殖影响

图3 加压处理对牙周膜干细胞细胞凋亡蛋白表达的影响
1.对照组处理1 h;2.加压处理1 h;3.对照组处理6 h;4.加压处理6 h;5.对照组处理12 h;6.加压处理12 h
2.3 加压处理对牙周膜干细胞TGFβ及STAT蛋白表达的影响 与对照组相比,牙周膜干细胞经加压处理1h和6h后TGFβ及STAT2的表达明显升高(P<0.05),而处理12 h的细胞增殖情况及上述蛋白表达无统计学差异(P>0.05,图4,表3)。
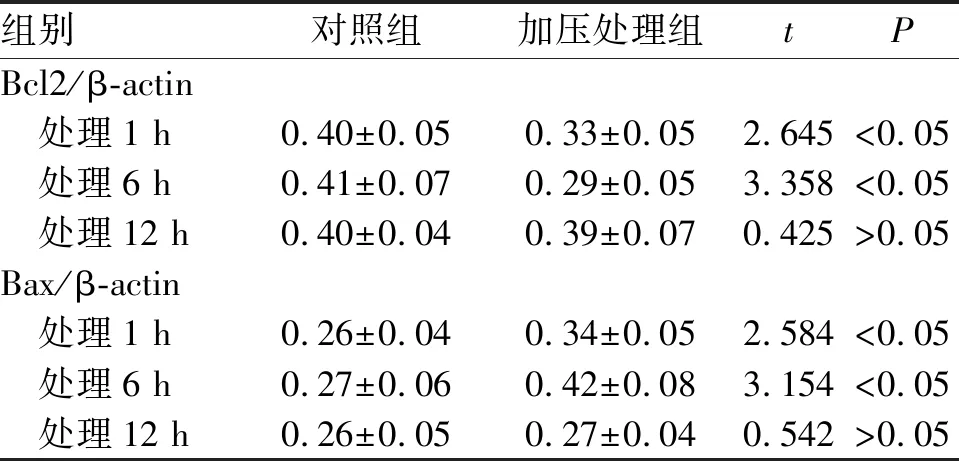
组别对照组加压处理组tPBcl2/β-actin 处理1 h0.40±0.050.33±0.052.645<0.05 处理6 h0.41±0.070.29±0.053.358<0.05 处理12 h0.40±0.040.39±0.070.425>0.05Bax/β-actin 处理1 h0.26±0.040.34±0.052.584<0.05 处理6 h0.27±0.060.42±0.083.154<0.05 处理12 h0.26±0.050.27±0.040.542>0.05

图4 加压处理对牙周膜干细胞细胞TGFβ及STAT蛋白表达的影响
1.对照组处理1 h;2.加压处理1 h;3.对照组处理6 h;4.加压处理6 h;5.对照组处理12 h;6.加压处理12 h
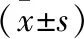

组别对照组加压处理组tPTGFβ/β-actin 处理1 h0.30±0.050.34±0.062.365<0.05 处理6 h0.31±0.080.39±0.072.854<0.05 处理12 h0.30±0.060.30±0.080.441>0.05STAT2/β-actin 处理1 h0.28±0.080.32±0.063.147<0.05 处理6 h0.28±0.070.43±0.082.548<0.05 处理12 h0.28±0.050.29±0.070.228>0.05
3 讨 论
以往的研究也证实正畸过程涉及多种信号转导通路的参与,其中集中在MAPK信号通路,Wnt/β-catenin信号通路,PI3K/AKt/m TOR信号通路,BMP-2信号通路,Caspase-3介导的凋亡通路较多[7]。在分析玻璃离子水门汀对青少年正畸后局部组织炎性反应、细胞凋亡及胶原代谢影响的研究中也发现玻璃离子水门汀用于青少年正畸能够较牙釉质黏合剂更为有效地抑制炎性反应、细胞凋亡,并改善胶原代谢[8]。在分析增龄性因素对正畸牙齿移动过程中牙周组织细胞凋亡时也证实细胞凋亡可能参与了正畸牙齿移动,但是增龄性因素使得成年组牙周组织细胞凋亡增加,进而影响各类细胞比例,改变牙周组织改建的速度和效果,使得牙齿移动速度减慢[9]。本研究也发现加压处理1 h和6 h后细胞Bax明显增强而Bcl2水平明显减弱,表明模拟正畸静压力刺激可明显抑制体外培养的牙周膜干细胞的增殖过程。
TGFβ/STAT信号通路相关蛋白可能参与了牙齿的正畸过程。在分析骨膜蛋白在正畸牙周膜改建中的表达及调控机制时发现TGFβ-B1-PN-FAK可能通过激活下游的Akt磷酸化信号通路,对正畸力牙周膜改建中进行调控[10]。在分析正畸驱动的骨皮质切开术对巨噬细胞的作用及机制进行研究时也证实正畸驱动的骨皮质切开术通过活化并促进巨噬细胞的分型进而影响牙槽骨密度并促进牙齿的移动,其中NF-κB及JAKSTAT信号通路的激活可能发挥重要作用[11]。以往的研究也发现正畸力作用下大鼠前扣带皮质层中STAT1表达水平一过性降低,p-STAT1表达水平一过性升高,推测正畸疼痛的产生可能与前扣带皮质层STAT1活化为p-STAT1有关[12],且25 g/cm2静压力作用下HGFs中的TGF-β1的表达有关[13]。在分析信号转导和转录活化因子3在正畸力介导的骨改建中的表达时也发现正畸力可增强牙槽骨改建,张力区STAT3的表达改变可能与正畸牙移动的骨改建相关[14]。但上述研究均未对牙周膜干细胞的凋亡情况及相关分子机制进行研究。本研究发现加压处理1h和6h后细胞Bax明显增强而Bcl2水平明显减弱,TGFβ/STAT信号通路蛋白TGFβ及STAT2表达明显增强,而处理12时干细胞的上述蛋白表达无明显差异,表明模拟正畸静压力刺激可明显抑制体外培养的牙周膜干细胞的增殖过程,其可能与TGFβ/STAT信号通路异常有关。
因此,模拟正畸静压力刺激可明显抑制体外培养的牙周膜干细胞的增殖过程,其可能与TGFβ/STAT信号通路异常有关。

