4种多环芳烃对仿刺参(Apostichopus japonicus)原肠胚发育的急性毒性研究
董雪纯,魏海峰,*,刘长发
1. 辽宁省近岸海洋环境科学与技术重点实验室,大连 116023 2. 大连海洋大学,大连 116023
多环芳烃(PAHs)作为环境中一种常见的有机污染物,广泛分布于我国从南到北的海水和海洋沉积物中[1-3],具有难降解、持久性、半挥发性及生物富集等特点,具有生物毒性和致畸、致癌、致突变作用[4],其中16种PAHs被美国环保局(USEPA)列为优先控制污染物[5]。环境中的PAHs来源于有机物质不完全燃烧的过程、工业过程和溢油[6]。PAHs类污染物不仅易在水生生物体内蓄积[7],产生从分子水平到组织器官、个体水平的负面效应[8-9],还通过食物链进行传递和迁移,破坏生态系统,进而威胁人类健康[10]。关于水环境中多环芳烃的毒性效应研究主要集中于鱼类和无脊椎动物[11-12],且多选择最敏感的早期生命阶段进行暴露试验[13-16]。急性毒性试验是一种常用于快速评估化学品对水生生物潜在危害的生态毒理学方法,积累的大量数据可以用于确定大量化学品对生物的相对毒性[17],也用于确定水体中污染物的安全浓度[18]。
仿刺参(Apostichopusjaponicus),属海参纲,棘皮动物门。全身长满肉刺,以海底藻类和浮游生物为食,广泛分布于世界各大海洋中,是我国重要的海水养殖经济品种,具有提高记忆力、延缓衰老,预防动脉硬化以及抗肿瘤等作用[19-20],而成为我国重要的人工养殖海洋经济动物。因此,环境污染物对其幼体和成体的毒性效应及其体内积累残留污染物研究受到关注,这些污染物有:重金属[21-22]、有机污染物[23-25]、农药等[26-28]。动物胚胎发育过程中,原肠胚是是细胞核开始起主导作用,组织器官发生开始的发育阶段,研究污染物对原肠胚发育期的毒性效应具有更为重要的意义。但PAHs对刺参原肠胚发育的毒性研究尚未见报道。为此,开展PAHs对仿刺参原肠胚发育的毒性研究,探究仿刺参原肠胚对PAHs污染的耐受能力,对提高仿刺参品质,加强海洋环境的资源利用与保护也具有重要意义。本实验以仿刺参原肠胚为研究对象,进行半静水式急性毒性实验,对不同浓度的苯并[a]芘、3-甲基菲、惹烯、2-甲基蒽分别在24、48、72、96 h观察仿刺参存活率的差异,求出各条件下仿刺参原肠胚的半致死浓度、安全浓度,旨在为评估PAHs对海洋环境和水生生物质量安全浓度提供基础数据和理论依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验仿刺参原肠胚购自大连海宝渔业有限公司,为受精24 h后的原肠期胚胎,体长约280 μm。实验海水为大连黑石礁海域的砂滤海水,定期换水,每24 h投喂1 mL密度为1×104cells·mL-1的盐藻,24 h持续微充气。多环芳烃苯并[a]芘、3-甲基菲、惹烯和2-甲基蒽均购自Sigma公司,纯度大于96%。
储存液配制:称取一定量的苯并[a]芘、3-甲基菲、惹烯和2-甲基蒽固体,用丙酮作助溶剂溶解,配制成高浓度的储备液,实验时根据需要,向实验海水中添加不同体积的储备液稀释至实验所设定的不同药物浓度。
1.2 实验方法
本实验在10 mL的试管中进行,每个试管中胚胎的密度为2~3 个·mL-1,为满足实验仿刺参原肠胚对溶解氧的需求,实验海水在实验期间采用持续微充气的方法,保证实验水体中溶解氧大于6 mg·L-1。实验方式为半静态实验方法,实验过程中每24 h更换一次水,水体控制在水温20~21 ℃,盐度30~31,pH 8.1~8.2的条件下。根据预实验,在此浓度范围内分别设置苯并[a]芘、3-甲基菲、2-甲基蒽及惹烯浓度为10、50、100、200 μg·L-1的4个浓度梯度组,一个空白对照组和一个0.1%丙酮溶剂对照组,每组设置3个平行实验,并分别在24、48、72、96 h观察记录其存活数,计算存活率,安全浓度和半致死浓度,及时清除死亡个体。
1.3 数据统计与分析
采用Excel 2010软件对实验数据进行处理,求出存活率和4种多环芳烃浓度对数的回归方程,分别计算每组的半致死浓度和安全浓度。
半致死浓度计算方法采用概率单位法计算,以寇氏法(Karber)求半数致死浓度(LC50)。根据24 h和48 h的半致死浓度计算出安全浓度(SC)[29]。
LC50=lg-1[Xm-i(ΣP-0.5)]
LogLC50的95%置信限=LogLC50±1.96×d[Σ(P×g/n)]0.5
SC=48 h-LC50×0.3/(24 h-LC50/48 h-LC50)2
公式中:Xm为最大剂量组剂量的对数值,i为相邻两组剂量对数值之差,P为各组动物的死亡率,d为相邻剂量组比值的对数;g为存活率;n为每组受试刺参原肠胚数。
利用SPSS 19.0分析软件对实验数据进行单因素方差分析,分析多环芳烃组和对照组之间的差异,P<0.05表示差异显著。
2 结果(Results)
2.1 4种PAHs对仿刺参原肠胚发育的急性毒性影响
图1表示各组实验的存活率以及显著性差异。由图1可知,在实验进行24,48 h时,4组仿刺参原肠胚存活率均较高。实验72 h时,苯并[a]芘50 μg·L-1浓度组的存活率显著下降,100、200 μg·L-1浓度组存活率为0;3-甲基菲、惹烯50、100 μg·L-1浓度组存活率显著下降,200 μg·L-1浓度组存活率均为0;2-甲基蒽10、50、100 μg·L-1浓度组存活率均显著下降。实验96 h时,苯并[a]芘10 μg·L-1浓度组存活率显著下降,50、100、200 μg·L-1浓度组存活率为0;3-甲基菲10、50 μg·L-1浓度组存活率显著下降,100、200 μg·L-1浓度组存活率为0;惹烯50、100 μg·L-1浓度组存活率显著下降,200 μg·L-1浓度组存活率为0;2-甲基蒽100、200 μg·L-1浓度组存活率均显著下降。在急性毒性实验过程中,2个对照组存活率高,4组PAHs不同浓度下仿刺参原肠胚的个体存活率随着暴露时间的延长和PAHs浓度的升高而降低,呈现出明显的剂量-效应关系。
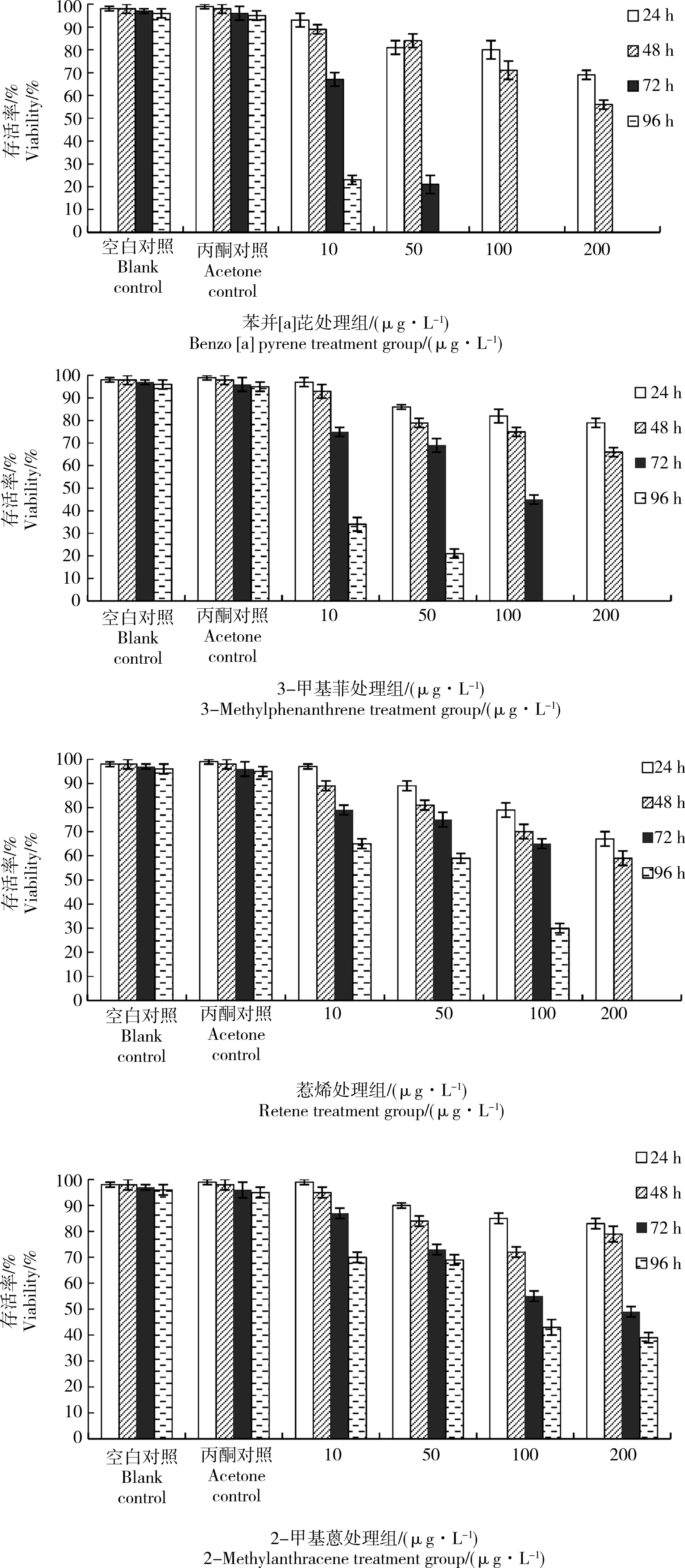
图1 4种多环芳烃对仿刺参早期发育的急性毒性实验结果Fig. 1 Results of acute toxicity test of four polycyclic aromatic hydrocarbons (PAHs) on early development of Apostichopus japonicus
2.2 4种PAHs对仿刺参原肠胚的半致死浓度和安全浓度
4种PAHs对仿刺参原肠胚在24、48、72、96 h的表观半致死浓度及安全浓度结果详见表1。苯并[a]芘对仿刺参原肠胚在24、48 h的半致死浓度分别为294.4、225.64 mg·L-1,3-甲基菲对仿刺参原肠胚在24、48、72、96 h的半致死浓度分别为404.5、300.7、81.4、17.6 mg·L-1,惹烯对仿刺参原肠胚在24、48、72 h的半致死浓度分别为243.1、230、186 mg·L-1,2-甲基蒽对仿刺参原肠胚在24、48、72、96 h的半致死浓度分别244、231.6、152.6、142.9 mg·L-1。PAHs的安全浓度顺序为2-甲基蒽(62.6 mg·L-1)>惹烯(61.8 mg·L-1)>3-甲基菲(49.8 mg·L-1)>苯并[a]芘(39.76 mg·L-1)。
3 讨论(Discussion)
多环芳烃(PAHs)有机污染物在环境中,主要来源于有机物和化石燃料的不完全燃烧,已被联合国环境规划署(UNEP)列入持久性有毒化学污染物(PTS)名录[30]。根据国家环保局1986制订的《生物技术检测规范(水环境部分)》标准(剧毒:LC50≤0.1 mg·L-1;高毒:0.1 mg·L-1﹤LC50≤ 1.0 mg·L-1;中毒:1.0 mg·L-1﹤LC50≤ 10.0 mg·L-1;低毒:LC50>10.0 mg·L-1),苯并[a]芘、3-甲基菲、惹烯、2-甲基蒽4种PAHs均具有毒性作用,毒性大小排序为:苯并[a]芘>3-甲基菲>惹烯>2-甲基蒽。本实验研究表明苯并[a]芘和3-甲基菲对仿刺参原肠胚的毒性作用较大,在高浓度、长时间胁迫下,超过仿刺参原肠胚对PAHs毒性的耐受范围将引起大量死亡,符合上述标准。4种PAHs在100、200 μg·L-1浓度组,72、96 h后存活率显著下降,与空白对照组和丙酮对照组相比,具有显著性差异(P<0.05)。同时以丙酮作为助溶剂与对照组相比,没有显著差异,说明丙酮作为助溶剂是可行的。采用定量构效关系(QSAR)模型研究芳烃化合物对小球藻的抑制作用的结果表明,不同多环芳烃的毒性程度各不相同,取代基基团的种类多、苯环数量多的化合物毒性高[31]。由于电性是控制其反应性毒性的参数之一,氢键成键能力是决定其毒性的参数之一,所以芳烃中能够形成氢键的取代基对其毒性影响较大。在酚类化合物对水生生物的毒性研究实验中发现取代基数量越多,化合物的毒性作用越大;取代基的种类不同,毒性也不同[32]。
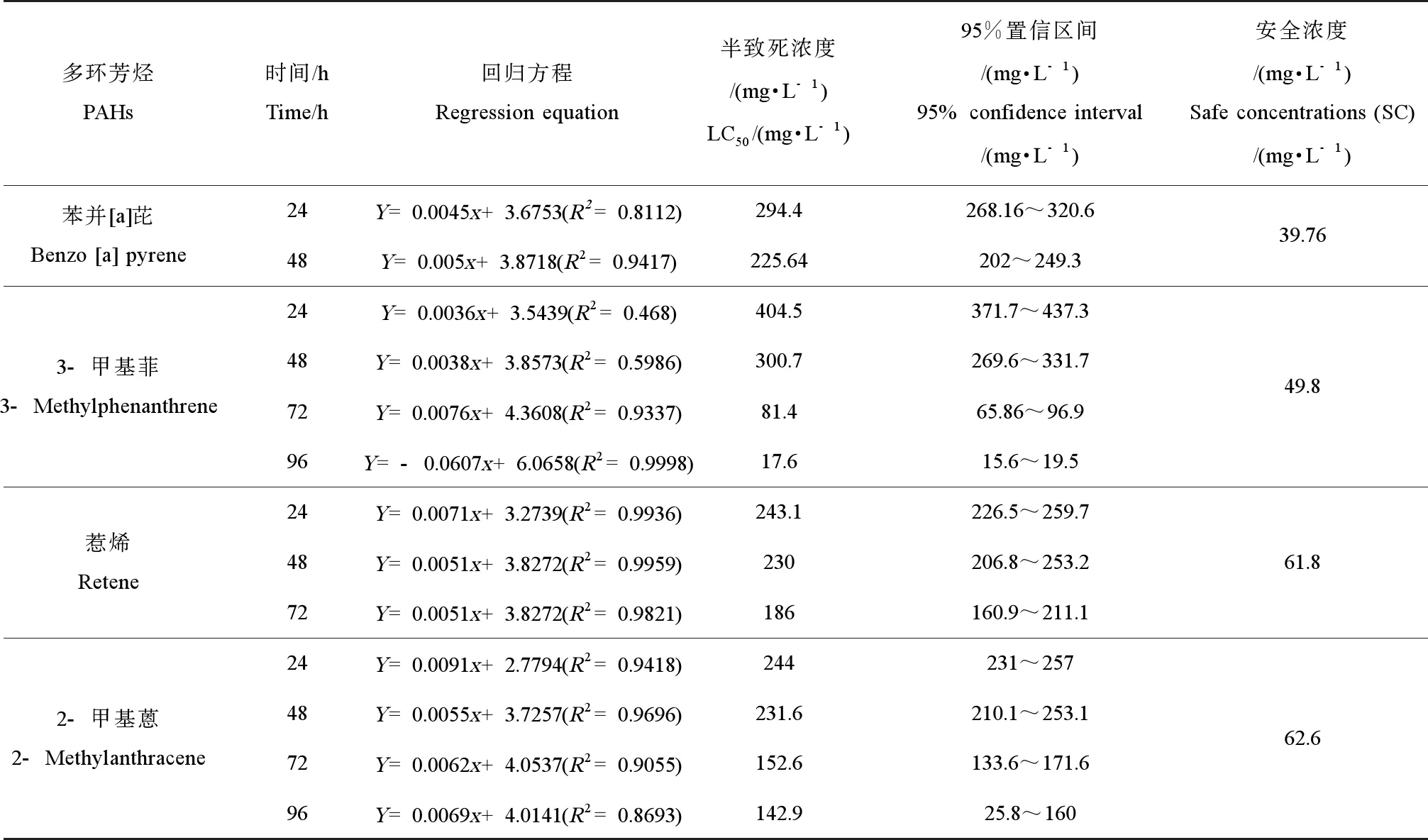
表1 4种多环芳烃对仿刺参早期发育的回归方程、半致死浓度和安全浓度Table 1 Regression equation, semi-lethal concentration and safe concentration of four PAHs on the early development of Apostichopus japonicus
注:Y为存活率;x为PAHs浓度对数。
Note:Yis the survival rate;xis the logarithm of the PAHs concentration.
对PAHs致毒机理研究发现,PAHs对鱼类胚胎发育的影响包括:卵黄囊和心包水肿、出血、心脏功能紊乱、结合芳基烃受体(AHR)和诱导CYP1A、后代突变和遗传性变化、颅面和脊柱畸形、神经细胞死亡、贫血、生长抑制和游泳障碍等[33]。其中,干扰心脏功能被认为通过2种途径导致胚胎心力衰竭[34-35]:(1)抑制心内驱动心脏动作电位复极化的钾通道整流作用;(2)通过阻断ryanodine受体或肌浆网钙泵干扰心肌细胞内钙循环;间接破坏鱼类胚胎骨细胞和成骨细胞导致骨骼畸形;呈现内分泌干扰活性;肝脏、脑和肌肉组织的DNA甲基化水平升高[36]。
仿刺参原肠胚在暴露于PAHs后其存活率随暴露时间的延长和暴露浓度的升高而显著下降,存在明显的剂量-效应关系,暴露时间越长,PAHs浓度越高对仿刺参原肠胚的毒害作用越大。而PAHs对仿刺参原肠胚产生毒性作用的机理是否与鱼类胚胎发育或者其他海洋无脊椎动物的致毒机理一致,有必要进一步深入研究。

