多环芳烃对海洋贝类多生物水平毒性效应的研究进展
张翼飞,曲梦杰,丁家玮,陈思雨,王忆,邸雅楠,*
1. 浙江大学海洋学院,舟山 316000 2. 东部战区海军海洋水文气象中心,宁波 315122
多环芳烃类化合物(polycyclic aromatic hydrocarbons, PAHs)是一类在环境中广泛存在,具有至少1个苯环结构的持久性有机物,也是最早被确认具有潜在致癌性的一类环境污染物[1]。环境中的PAHs通过陆源性输入、大气沉降、海上事故泄漏等途径汇入海洋,以溶解态、乳化态和悬浮颗粒态等存在。海洋生物通过呼吸、摄食等方式获得PAHs,并进一步在Ⅰ相、Ⅱ相的多种生物酶催化下发生转化、代谢[2],其中大部分非极性和脂溶性的PAHs会形成水溶性更强的代谢产物,经过生物解毒排出体外[3];少部分PAHs则通过代谢活化产生活性氧自由基(ROS)[4]。生物体内蓄积的PAHs及其代谢产物的总量一旦超出机体正常的承载水平,或者机体发生功能紊乱造成代谢所产生的ROS无法及时清除,机体防御体系失效,便会导致生物体内的DNA损伤、基因突变、细胞死亡、癌变等一系列生物毒性效应。相关的毒理学研究,尤其是PAHs的致癌效应,在哺乳动物体内开展的相对较多,对其致毒效应及产毒机制也有较为深入的了解。现有研究表明,海洋生物体内存在与高等生物代谢酶及信号传递活性分子序列高度保守的蛋白质与基因。如盘鲍(Haliotisdiscusdiscus)中谷胱甘肽还原酶(GR)的氨基酸序列与人类(Homosapiens)的相似度达到70.4%[5];厚壳贻贝(Mytiluscoruscus)中谷胱甘肽S转移酶(GST)的氨基酸序列与6种脊椎动物(如褐鼠、人类等)相比的相似度达42.79%[6];生物体内应激响应的主要参与者热激蛋白(HSP)家族的蛋白质和核酸序列在海洋双壳类生物及高等生物体内也高度相似[7],揭示在进化过程中高等生物保留了与海洋生物相似的生物转化、信号传导途径与防御体系来进行PAHs的代谢及胁迫调控。
纷繁的海洋生物中,海洋双壳类生物,尤其是海洋贝类,因其独特的生理、生态特性,其健康程度可以指征当地水体环境状况,如海洋贻贝可通过体内分泌的附着丝成簇固着在岩石等硬质表面,通过鳃组织的过滤功能滤食饵料,同时摄取水体中的其他颗粒物质,对脂溶性污染物具有很强的生物富集作用[8];处于食物链的中间环节,能够通过食物网将体内蓄积的物质向更高能级生物传递,威胁较高等生物甚至人类的健康等,成为公认的海洋环境监测的模式生物之一。美国国家海洋和大气管理局(NOAA)自1986年制定了贻贝监测计划,将海洋贻贝(Mytilussp.)、牡蛎(Crassostreavirginica)和斑马贻贝(Dreissenasp.)作为模型物种,监测易被生物体吸收、贮存、产生毒性效应并对人类健康具有潜在威胁的化学污染物的危害;其他各国及国际组织也利用海洋贝类作为典型海洋生物代表,在全球范围内开展污染物迁移、转化及消亡过程的研究[9]。
已有针对海洋贝类开展的体内、体外毒理学研究表明,PAHs可导致贝体内不同组织、不同生物水平的一系列毒性效应。其中一些亚致死毒性效应以及与其关联的PAHs的种类和浓度,由于低于检测标准,在常规的环境监测中往往容易被忽视。此类PAHs不但会在海洋生物体内产生浓度的蓄积,也会引起生物损伤的蓄积,这些蓄积最终可通过食物链传递进一步威胁高等生物的生存安全,导致生态平衡失调。鉴于PAHs在海洋环境中大量存在的现状,以及海洋贝类在海洋生态毒理学研究中的重要地位,本文综述目前PAHs在海洋贝类多种生物水平产生的生物毒性效应及其检测方法的研究进展,重点从个体生理特征、组织结构、细胞毒性和基因毒性4个层次展开,为进一步更有效地利用海洋贝类这一模型生物,针对不同研究目标筛选并组合海洋贝类不同的生物毒性检测指标,深入开展PAHs对海洋生物的致毒效应与机制研究提供思路与检测方法,为制定切实可行的环境监测标准,保护海洋生物安全提供依据。
1 PAHs对海洋贝类个体生理的影响(Effects of PAHs on individual physiology of marine bivalve)
个体生理状况是贝类的重要健康指标,PAHs通过改变生存环境而影响贝类的日常生理,如摄食行为、心脏压力、生长速率、耗氧率、外壳开合频率等。目前贝类的个体生理指标,如滤水率、心率、生长余力等指标已经建立了比较成熟的检测体系[10-12],被广泛地应用于PAHs所造成的生物毒性效应研究中。对成体贝类而言,当环境PAHs浓度发生较大改变并维持一段时间,贝类的个体生理特征会发生可测的改变,这种改变能够帮助平衡个体的能量与物质代谢以应对PAHs造成的胁迫,通常表现为个体心率加速、耗氧率增加、滤水率和生长余力降低[13-16]。同一种个体生理参数对于不同种类PAHs的响应有所不同,Bayne等[17]发现海洋贻贝(Mytilusedulis)的滤水率会随着水体中悬浮有机物质的增多而增加;Gonzalez-Fernandez等[18]的研究却表明,贻贝的滤水率会因为荧蒽的存在而显著下降。看似矛盾的研究结果是因为海洋贝类滤水率的变化,除了受污染物胁迫的影响外,还会受到生物本身种属差异、营养状况、健康水平、生命周期等个体生理状况的影响。有学者提出,海洋贝类的滤食行为与水体中的饵料浓度直接相关,贝类的滤水率存在上限,当环境中的饵料量过高或者过低时,贝类根据正常生理机能的需要,通过改变滤水速率来适应食物匮乏、过剩以及其他环境因素的改变[19]。海洋贝类成体的个体生理状况是否能够及时、准确地反映生物体对PAHs等污染物的胁迫响应仍然存在争议,在实际应用中通常会与其他生物毒性效应指标结合使用,或者仅用于PAHs毒性检测上限阈值的确定。相比较而言,海洋贝类的胚胎与幼体发育过程中的生理变化更容易受到环境中PAHs的影响。在双壳类胚胎发育的关键时期,如D形期,往往会因为环境中PAHs的存在而引起胚胎死亡、变态失败、幼体存活率降低等改变,并呈现出显著的剂量-效应相关性。其机制可能因为PAHs可作为内分泌干扰物而影响控制胚胎、幼体发育的关键激素类分子合成或竞争性抑制该类分子的活性[20-21]。因此,贝类胚胎或幼体发育阶段的个体生理特征可以作为PAHs毒性效应,尤其是发育毒性效应研究中的敏感性指标。
2 PAHs对海洋贝类组织健康的影响(Effects of PAHs on histopathological health of marine bivalve)
PAHs污染海域的贝类,其滤食的生活习性使得身体组织长期浸没在污染物中,组织结构会发生病理性损伤,无法发挥正常组织功能。这些组织中,鳃作为水体中污染物进入贝类的第一吸收位点,是包括贝类在内的多数水生生物的呼吸器官,也是滤食性贝类最重要的摄食器官,通过鳃丝及纤毛的组合运动参与水体中颗粒物质的生物转运与代谢产物的排泄。贝类鳃组织的受损程度在一定程度上反映其栖息水环境的污染状况[22]。贝类的消化腺具有与人体内的肝、肾等脏器相似的生物功能,富含多种生物转化酶和抗氧化活性分子,是许多内源性和外源性化合物代谢、解毒的场所,也是大多数外源性化合物及其中间代谢产物毒作用的靶器官[23-24];加之贝类消化腺的脂肪含量相对较高,可作为脂溶性PAHs的贮存库,更容易发生组织损伤[25]。海洋贝类的外套膜也因含有较高的脂肪组织而更容易蓄积脂溶性的污染物,是PAHs的另一个重要靶器官与贮存库;在牡蛎和贻贝等海洋贝类中,外套膜与其性腺组织紧密相连,其结构、功能的损伤会影响性细胞的成熟并进而导致贝类生殖、发育缺陷甚至生物种群的失衡[25]。因此,海洋贝类不同组织功能的正常是维系贝类生命健康及发育繁殖的基础。目前,针对海洋贻贝组织水平上的生物毒性效应以形态定性观察为主。经过PAHs暴露的贝类组织会产生形态学上的改变甚至出现炎症或坏死等组织病理损伤(图1)[26-27]。同时,研究者根据组织损伤程度设定了评分标准,如Bignell等[28-29]提出了贻贝外套膜、消化腺及肾脏组织的评分等级(表1)。通过综合得分的高低来判断贻贝的整体健康水平,该评价系统已被广泛应用于野外贻贝样品生理健康的评价研究。然而,组织损伤的定性分析方法观察耗时较长,对研究人员经验要求较高,分析数据因个人主观认识的差异,导致研究结果难以进行相互对照;而且定性的组织病理损伤检测无法将PAHs的暴露浓度与贝类组织水平的毒性效应进行关联,促使海洋贝类组织病理检测的半定量和定量分析方法快速发展起来。

图1 正常与损伤组织对比图注:A~E为正常组织;a~e为苯并芘(BaP)处理后组织。A和a为消化腺;B和b为鳃;C和c为闭壳肌;D和d为外套膜(雄性);E和e为外套膜(雌性)[30]。Fig. 1 Light micrographs of normal and damaged tissuesNote: A-E, normal tissues; a-e, tissues exposed to benzo(a)pyrene (BaP); A and a, digestive gland; B and b, gill; C and c, adductor muscle; D and d, mantle (male); E and e, mantle (female) [30].
半定量分析方法适用于所有组织,根据受损伤组织在所有采样组织中所占的比例计算损伤指数,并分析组织受损情况[32],受测样品量越大,通过半定量分析方法所得的结果越准确。针对贝类组织改变的定量分析才初步建立,目前较为成熟的是测定贝类的消化腺管腔壁厚度,将形态学观察转换为直观数据进行统计分析。当贝类受到PAHs的胁迫后,其消化腺组织会发生组织结构改变,主要表现在上皮细胞厚度降低、消化管腔内腔扩大、内腔细胞脱落等病理性变化[33-34],可以通过计算管腔平均厚度和管腔形状的改变作为污染物胁迫下组织损伤的定量分析标准(图2)[35]。由于消化管腔结构不规则,选择合适的几何模型进行计算会影响最终的定量分析结果。本实验室研究表明单个消化腺管腔的结构可以按照近似圆形、椭圆形或梯形进行几何变换来计算管腔壁环形区域的平均厚度,所得的平均管腔厚度有所不同。其中,通过几何转化为梯形计算时,得出的平均厚度数据的标准误差最小,与其他毒性检测指标的拟合度最高,相对比较准确。针对消化管腔壁的定性分析不受实验人员的主观与经验限制,可以确定PAHs在贝体组织水平所造成的剂量-损伤效应关系,具有较广的应用价值。然而,目前仅适用于贝类的消化腺组织,其他组织在受到PAHs暴露后所展现出的组织病理学变化还难以确定一个准确的参数进行定量数据转换,对于贝类组织损伤的定量方法还存在很大的条件优化与方法建立的空间。
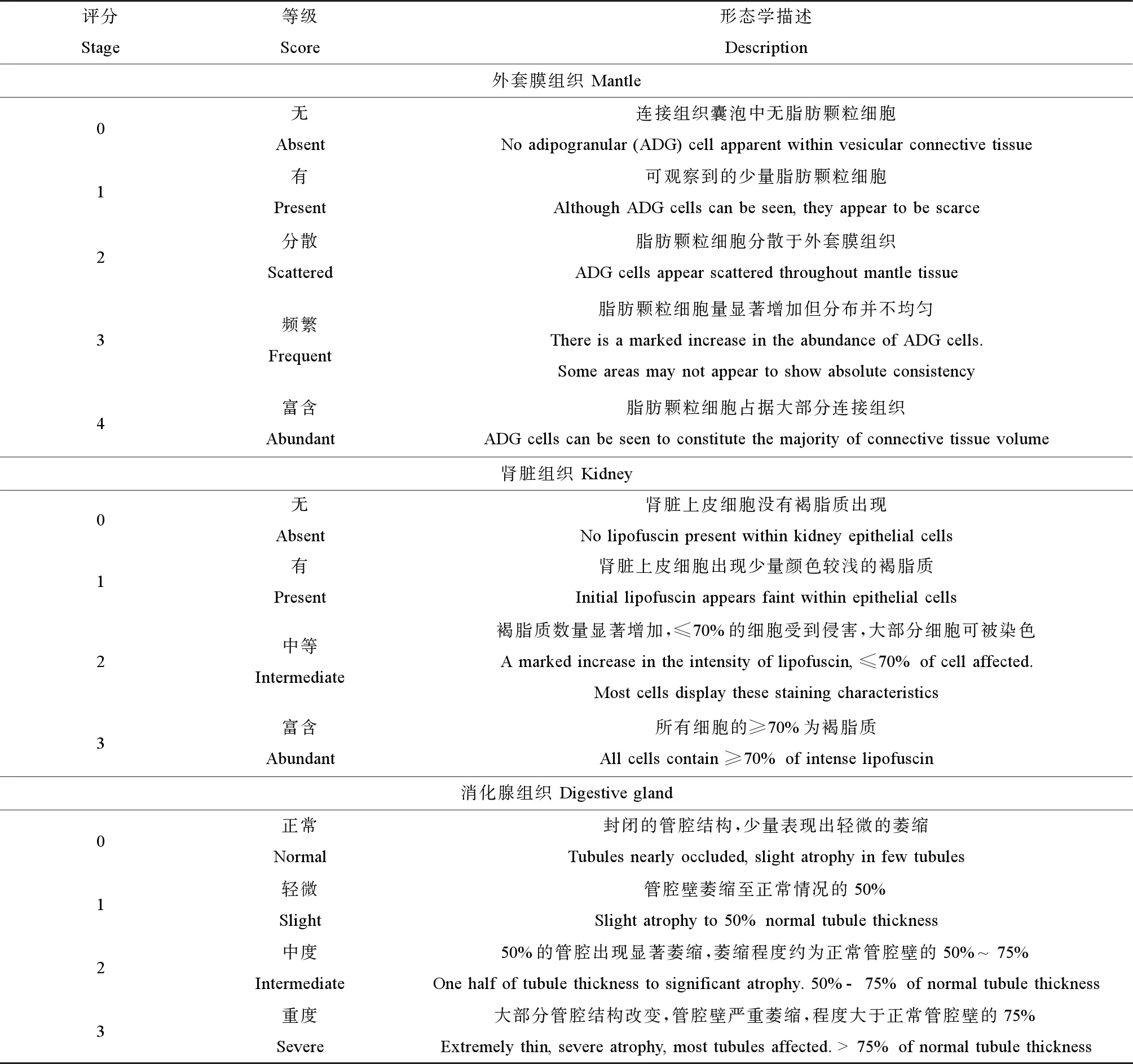
表1 海洋贻贝的组织病理学损伤分级评定标准[29,31]Table 1 Grading indices used for the assessment of histopathological abnormality in marine mussels[29,31]
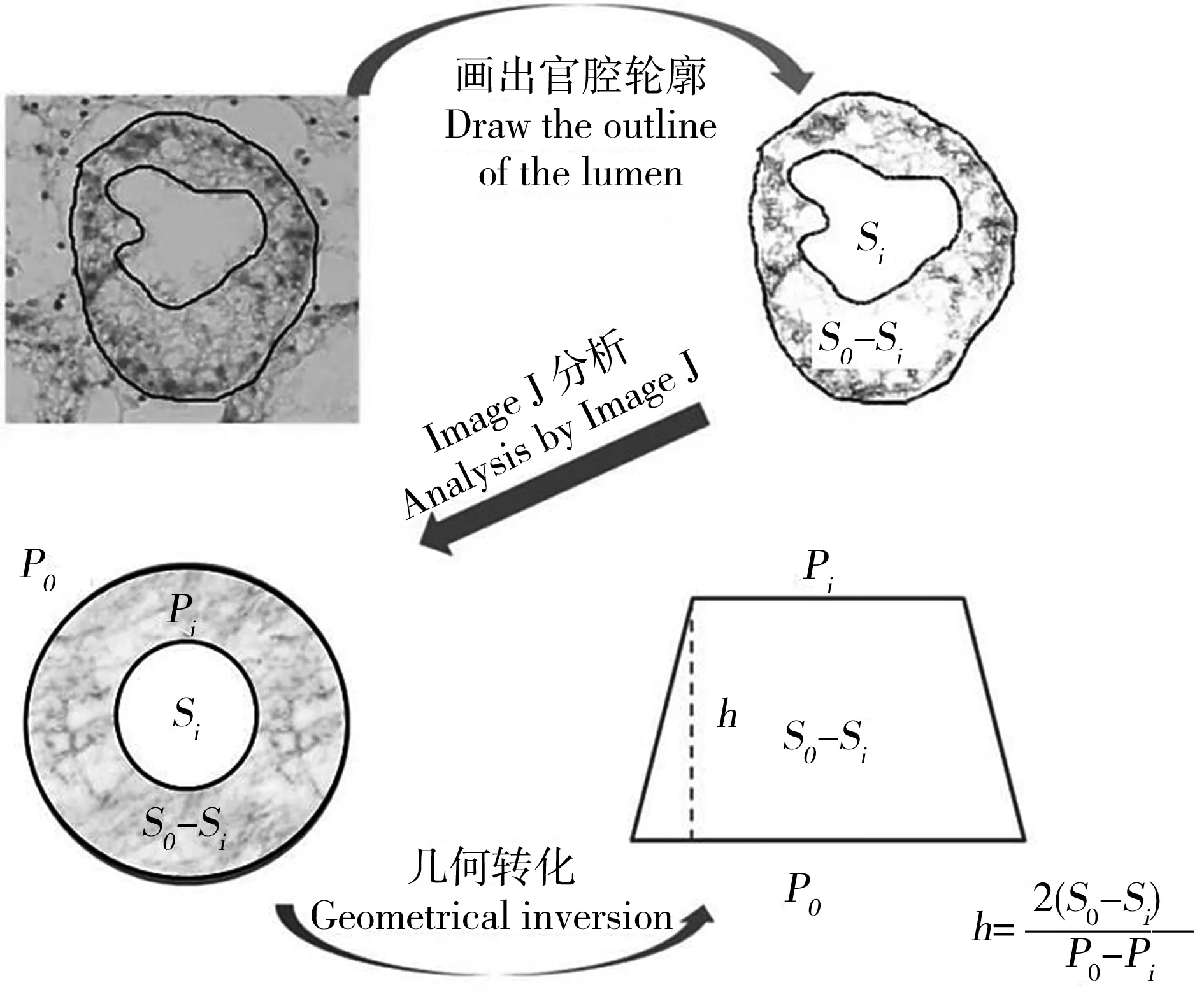
图2 贻贝消化腺组织病理损伤定量分析方法注:S0表示消化腺上皮细胞层区域,Si表示内腔区域,P0为管的周长,Pi为内腔周长。Fig. 2 Quantitative analysis of histopathological lesion in mussel digestive glandNote: S0, Si, P0 and Pi represent epithelial layer area, digestive tubule lumen area, tubule perimeter and lumen perimeter respectively.
3 PAHs对海洋贝类细胞功能的影响(Effects of PAHs on cellular function of marine bivalve)
随着单细胞分离和细胞培养技术的迅速发展,应用海洋贝类的不同组织细胞,在体内和体外条件下开展生态毒理学相关研究成为可能。海洋贝类的鳃和消化腺细胞不但在毒物代谢转化过程中具有重要的生理功能,而且具有较为简单的细胞组成类型(主要为粒细胞和嗜碱性白细胞),研究结果受细胞种类差异影响较小,被广泛地应用于PAHs所引起的细胞毒性效应研究中。海洋贝类的血细胞是另一类广泛应用的细胞类型。贝类的开放循环系统,决定其血细胞参与机体内气体交换、渗透调节、营养消化分配、废弃物排泄等一系列生理活动;它还是污染物的传递和代谢媒介,参与贝类的体液免疫,通过血细胞中的调节因子和一些非特异性酶的活性变化,触发生物体一系列免疫、防御机制[36]。相较而言,贝类的血细胞提取制备简单、快捷、用量小的情况下,可以在海洋贝类体内反复多次提取而不影响生物整体的健康,使用的最为广泛。
目前针对海洋贻贝细胞因PAHs所造成的生物毒性开展的研究主要集中在3个方面:1)细胞本身的健康及活性水平检测,包括细胞形态观察、细胞存活率检测、细胞活性如细胞吞噬、细胞凋亡、脂膜完整性、溶酶体膜稳定性等的测定[37]。Hannam等[38]及Choi等[39]研究发现,低浓度的PAHs(≤1 μg·L-1)便会引起扇贝(Chlamysislandica)及牡蛎(Crassostreagigas)血细胞的吞噬活性显著降低,说明PAHs会引起贝类细胞生物膜的损伤,改变正常的物质转运过程。而芘、燃油、天然气等单一或复合的PAHs可以导致海洋贻贝(Mytilusspp.)不同组织细胞中溶酶体膜稳定性的显著下降,通过改变细胞的免疫应答而影响对PAHs胁迫的防御[40-41]。在受到PAHs污染海域采集到的海洋贝类的血细胞及消化腺细胞中,观察到细胞坏死的现象,这类坏死细胞的形态与人类癌细胞初期的形态非常相似,说明PAHs也具有在贝体内引发细胞癌变的潜在可能,相关的致癌机制也许具有一定的保守性[42-43]。2)细胞内生理、生化酶活性的检测。PAHs在生物体内所产生的生物毒性效应,主要因生物转化所产生的ROS来激活机体的氧化应激防御体系而导致,应激系统与修复系统的存在使得生物体对外源污染物的胁迫具有一定程度的耐受性[3,44],与氧化胁迫相关的生理生化酶,如过氧化氢酶(CAT)、谷胱甘肽S转移酶(GST)、谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)等的含量及活性变化便成为指示生物体内的受到PAHs的胁迫压力大小、体内应激水平、抗氧化防御水平及健康程度的有效检测指标。大多数研究表明,受到PAHs暴露的贝类,如缢蛏、扇贝、贻贝等都会表现出显著增加的氧化应激酶或PAHs代谢酶活性的增加[24,45],通过抗氧化系统的激活或者代谢反应的增加来减少或消除体内的ROS。3)细胞内代谢相关酶的检测,如参与I相、II相反应的芳烃羟化酶(AHH)、7-乙氧基-3-异吩恶唑酮-脱乙基酶(EROD)、环氧化物水解酶(EH)、硫酸转移酶(SULT)等代谢酶的活性会在低浓度的苯并芘(BaP)胁迫下表现出浓度依赖性的增加。当BaP浓度达到一定水平时,这些代谢相关酶的活性会维持在一个稳定的水平,揭示此时已经达到生物体对于BaP的最大代谢能力[46]。不仅如此,采用分子动力学模型对包括海洋贝类在内的软体动物的胞质苹果酸脱氢酶的研究表明,细胞内该代谢酶的结构会随着外界环境的改变而发生相应的变化,从而因起酶活性的改变[47]。值得说明的是不同种类的酶在PAHs胁迫下的活性会显示出显著的组织/细胞特异性及酶反应特异性,这些特异性与生物组织功能、酶所参与的生化反应、酶的表达调控过程紧密关联[48],也与PAHs的结构与性质,如芳环数量、排列方式、水溶性等显著相关[45]。因此,贝类体内的生理、生化及代谢酶活测定不仅可以指示不同组织、不同生化反应与不同类型PAHs之间的相互作用及其内在关联,还可以作为研究生物体毒性效应机制的有效工具之一。
4 PAHs导致的贝类基因毒性(Genotoxicity of PAHs to marine bivalve)
生物体在个体、组织及细胞水平上产生的损伤,其根源是特定基因的表达或基因结构发生改变。PAHs,以BaP为例,在生物体内的代谢产物环氧化苯并芘(BPDE)能够直接与核酸结合,生成DNA加合物,引起DNA链的断裂或者碱基序列的改变,激活或抑制一系列具有重要功能基因(如原癌基因与抑癌基因)的表达,导致一系列基因毒性,甚至致癌、致死等毒性效应(图3)。
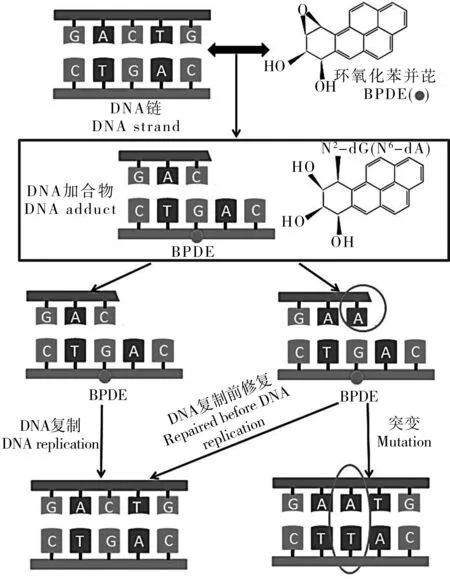
图3 BaP及其代谢产物引起基因毒性的潜在机制Fig. 3 The potential mechanisms of BaP and its metabolites induced genotoxicity
海洋贝类的基因毒性因PAHs、贝类组织细胞的不同而显示出较强的特异性和敏感性,被越来越多地应用在海洋生态毒理学,尤其是毒效机制的研究中。目前比较常见的基因毒性检测方法可以分为两类,一类是检测基因结构的变化,主要包括用于测定DNA加合物的32P后标记法[49];用于检测生物DNA单链/双链断裂、DNA-DNA和DNA-蛋白质交联等基因结构改变的碱洗脱法[50];用于检测单细胞内DNA损伤的彗星实验以及检测有丝分裂过程中染色体断裂或染色体错配所造成的染色体损伤的微核实验等。其中,彗星实验和微核试验已经作为经济合作与发展组织(OECD)所规定的用于检测生物基因毒性的标准方法[51],对2种检测的条件控制、参数选择、结果分析都有明确的标准化规定。因此这2种检测方法的结果可以很方便地在全球范围内进行对比,通过不同海域贝体内的基因损伤程度就能够说明某一海域的水体质量优劣或某种外源化合物的生物毒性效应[52]。大量研究表明,经过PAHs处理过的海洋贝类,其不同组织细胞都会表现出显著增加的DNA损伤,其损伤程度与接触的PAHs浓度具有显著的正相关性,验证了检测基因结构改变在研究PAHs的基因毒性效应方面的准确性[8,10]。此外,当水体中或贝体内的PAHs含量小于仪器(如GC-MS)检测限时,依旧可以检测出贝体细胞的基因损伤[30],说明了基因结构改变检测的灵敏度。另一类常用的基因毒性指标是特定基因的表达水平变化,这类基因通常是编码参与外源化合物代谢的基因(cyp4y1,cat),或者是参与细胞应激响应与防御(hsp70,mt10,gst)、细胞生长与凋亡(p53,ras)、DNA损伤与修复(rad51,aadd45a),以及细胞信号转导的转录与调控因子(p38,casp3)等[53-54]。研究显示,不同类型的PAHs胁迫下的贝类细胞的上述基因通常会在转录水平表现出显著的表达变化,暗示生物体会通过增加或减少相关代谢酶的合成、激活或抑制生物体的应激防御体系关键调控因子等途径来应对PAHs所造成的胁迫。这种基因表达水平的变化往往具有生物种属特异性及组织特异性,与贝类的生存环境、生理功能状况以及PAH的生物转运与转化过程直接相关。通过对这些关键基因表达水平变化的研究,可以帮助了解特定PAHs在贝体内引起生物响应的具体机制及关键靶分子,同时为进一步将研究结果外推至高等生物,开展进化学的相关研究提供宝贵的科学依据。值得注意的是,由于正常情况下基因的表达水平也会因为生物体的不同生理状态而进行适应性的调整,确定基因表达水平的显著变化与PAHs胁迫之间的相关性,需要大量实验数据的支持与验证。因此,目前关于海洋贝类基因毒性的检测,通常以基因结构改变为主,结合基因表达水平的变化,以便能够同时诠释基因水平上的毒性效应及其机制。

表2 PAHs在海洋贝类的不同生物水平所造成生物毒性效应及常用评价方法Table 2 The common used testing techniques to assess the biological toxicological effects in marine bivalve induced by PAHs
注: *详细信息已在所引用参考文献中进行综述;# IR表示吸收率,AE表示吸收效率,R表示呼吸作用消耗的能量。
Note: *The detailed information has been reviewed in the cited reference; # IR indicating absorption rate, AE indicating absorption efficiency,Rindicating energy consumed by respiration.
5 PAHs导致贝类的其他毒性(Other toxic effects of PAHs on marine bivalve)
除了前文中所总结的常用海洋贝类毒性检测指标与检测方法以外(表2),近年来基因表达检测技术、组学技术的迅速发展,使得与胁迫相关的生物体基因组、蛋白质组、代谢组的变化,即基因、蛋白质或代谢物表达的改变,逐渐成为反映外源污染物对生物体毒性效应的生物学指标[55-56]。Avio等[40]采用DNA微阵列研究吸收了PAHs的聚乙烯微塑料对紫贻贝基因表达的影响,发现经过处理后出现2 143个差异基因表达;其中大多数上调表达的基因都属于日本京都基因与基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)标记信号通路中与溶酶体活性、生物体免疫应答相关的基因。Jurgen等[57]采用BaP处理鸡帘蛤12 d,双向电泳后看到3个质量在62~98 kD之间,属于热激蛋白的差异蛋白质点,验证了蛤中的外源污染物应激通路也是通过激活HSP及其辅助的一系列蛋白质的合成而进行。Chen等[58]代谢组学的方法研究了马氏珠母贝(Pinctadamartensii)对10 μg·L-1BaP暴露的响应,发现BaP的存在干扰了贝的渗透调节和能量代谢的过程。应用组学技术开展PAHs所引起的海洋贝类的生物毒性效应的研究正逐渐兴起,研究结果在解释PAHs导致的生物毒性效应机制方面具有巨大优势,但是由于相关研究处于起步阶段,相关历史数据资料较少,同时受到分析仪器专有性的限制,目前未能在贝类研究广泛使用,具有广阔的研究前景。
6 展望(Prospect)
海洋中PAHs的存在可以造成海洋贝类从个体到基因不同生物水平的毒性效应,并通过一系列相关的生物标记物进行检测。在生态毒理学的研究中,生物个体水平上的检测通常属于生态毒性测试,用于说明环境中的外源物质,如PAHs,及其代谢产物对物种个体及种群的影响;而在细胞、分子等水平的毒性检测则可以反映机体面对外界刺激所具有的复杂应答和调控过程,是对生物学过程的内在发生机制进行阐释。不论是毒效的检测还是致毒机制的研究,毒理学研究都必须采用一系列生物标志(biomarker)来客观地测定和评价生物体系与环境因子相互作用所产生的变化。与之相关的具体检测手段(Bioassay)及其检测终点(endpoint)则可作为外源化合物对生物体不良健康效应的定性与定量评价指标。在实际生产生活中,为了对化合物的生产、排放、接触过程等做出相关限制的规定,常常将能使某种生物学效应增加到一个特定反应水平的临界参数作为该化合物在该生物水平的基准量(Benchmark),以此为基础选用的剂量-反应关系研究中发现的不致产生有害效应或不能测得有害效应的化合物剂量作为该化合物的阈值(Threshold)或安全剂量,以保护生物体安全及生态平衡[71]。本文所综述的内容亦旨在能够更好地应用海洋贝类这一模型生物开展相关的生态毒理学研究,确定真实有效的PAHs安全阈值。目前,国内外有关PAHs对海洋贝类生物毒性检验方法及毒性效应研究已取得较大进展,但仍然有一些热点问题需要进一步深入研究。
首先,需要对不同类型的测定方法进行标准化。针对同一标记物的测定方法多样,亟需针对一种模式生物建立起标准化的测定方法,为毒性效应数据对比分析提供数据支持。另外,国家有关部门应制定针对污染物的生物毒性效应评价标准,规范评价过程,保证生态环境预警的可操作性和风险评估理论的准确性。
其次,采用多生物水平的毒性效应来全面阐释PAHs所造成的生物损伤。目前对PAHs胁迫下海洋贝类的应激响应主要着眼于单一水平的生物标记物,但不同生物水平标记物作用靶器官的不同以及检测方法敏感性的差异,造成了研究结果的差异性和不准确性,因此,今后的研究中应着眼于多种标记物、常规技术与新技术等的结合使用,全面评价污染物的毒性效应。
再次,需要将研究重点从生物毒性效应转移到PAHs对海洋贝类的致毒机制。针对PAHs胁迫下海洋贝类毒性效应的研究已有较大的进展,但对PAHs致毒机制的研究仍有欠缺,尤其是海洋生物与高等生物体内致毒效应与机制的对比性研究鲜有开展。PAHs生物转化过程的复杂性、PAHs种类的繁杂、海洋贝类相关分子信息的缺乏、以及机制研究中对仪器要求较高、测定价格昂贵等给相关的研究带来难度。随着研究的进一步深入,如何进一步利用好海洋贝类这一生物模型,筛选敏感性的,具有代表性的生物毒性效应来指示特定PAHs所引起的生物健康威胁,并应用于原位监测,实现通过生物响应快速检测海洋生态环境安全将成为未来研究的一个巨大挑战。

