海洋生物体内砷含量及其形态研究进展
张伟,黄良民
1. 广州大学,大湾区环境研究院,珠江三角洲水质安全与保护教育部重点实验室,广州 510006 2. 中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广州 510301 3. 中国科学院大学,北京 100049
砷(As)是一种典型的有毒类金属,是危害最严重的环境污染物之一。砷作为常见有毒有害元素,一直备受人们关注,由于砷及其化合物具有较高的生物毒性,1973年砷被联合国粮农组织-世界卫生组织(FAO-WHO)确定为优先研究的食品污染物之一[1],1981年又被该组织划分为人类致癌物质(WHO,1981)[2]之一。砷在天然水体中的污染已成为世界性问题,同时对科学家也是一种挑战。美国国家环保局已将砷列为环境的首要污染源之一[3]。目前世界范围内亚洲国家砷污染最为严重,特别是孟加拉国、印度、中国等发展中国家[4-7]。在自然环境中砷以无机和有机形态存在,其毒性和生物可利用性不仅取决于总砷含量而且与其存在形态密切相关[8-11]。无机砷化合物亚砷酸盐和砷酸盐有剧毒,一甲基砷(MMA)和二甲基砷(DMA)具有中等毒性,而砷甜菜碱(AsB)、三甲基砷(TMAO)、砷胆碱(AsC)和四甲基砷(TEMA)无毒。因此,生物体内砷的形态分析引起了科学家们的广泛关注。分析生物体不同形态砷的浓度对评价砷的毒性水平,具有重要科学意义和应用价值。
海洋环境是砷全球循环的重要场所,因为海水中砷的含量可高达24 μg·L-1,比淡水中的含量(0.15~0.45 μg·L-1)高很多[12-13]。相对于海水来说,海洋生物含有更高浓度的砷(<10~100 μg·g-1干重),而且无机砷通过海洋食物链被生物体转化为有机砷[14]。在海洋藻类砷糖是主要的形式[15],在海洋鱼类和甲壳类中AsB是主要的形式[16],在海洋双壳类体内砷糖和AsB都是主要的形式[17-18]。科研工作者们以往对稻米[19-20]、竹子[21-22]、地下水[23]、污染的土壤[24]和淡水生物[25-27]都进行过砷含量的研究。而近年来的大量研究主要集中于海藻、牡蛎、鱼类等海洋生物,主要是因为这些生物是人类食物中砷的重要来源[28-34]。
砷在海洋生物中的不同存在形态在国内外已有大量报道,开展相关研究对揭示砷对人类的毒理作用意义重大[35]。在中国,由于工农业生产使用各种含砷物质等因素,使土壤、地下水、饮用水中砷含量不断升高[36],也使海水中砷的浓度和形态发生了变化,使得富集能力较强的海洋生物含有较高的砷,进而影响人类健康。目前,国内外已经将海洋生物中不同形态砷的浓度,特别是无机砷的浓度作为食品卫生监督检验中的重要检测内容。由于海洋环境污染,且海洋生物尤其海洋甲壳类和鱼类对砷具有较强的富集能力,因此,海洋生物样品中有毒元素砷的含量能有效地反映人类的生存环境和生态安全,也关系到人类自身的健康。
本文在查阅大量文献的基础上,对国内外海洋生物体内砷及其形态分析研究概况(表1)和进展作一简要综述,为深入研究各类生物砷的存在形态及其转化机制提供参考。
1 海洋生物体内砷及其形态(The arsenic content and species in marine organisms)
1.1 海洋植物——海藻
海藻主要包括海带、紫菜、裙带菜等,是深受消费者喜爱的海洋健康食品,具有独特的风味和营养价值,海藻中含有许多营养成分和生理活性物质,包括海藻多糖、多酚、活性碘、维生素、氨基酸、膳食纤维等,素有“天然微量元素宝库”之称[37]。但是海藻具有富集海水中砷元素的特性,也是海洋生态系统中的“砷库”[38],随着海藻摄入量日益增多,海藻中有毒砷可能导致的潜在危害已成为人们广泛关注的焦点。
在中国,海藻砷形态方面的研究取得了显著进展。吴烨飞等[39]测定了福建省内60个不同产地紫菜样品中总砷和无机砷含量,结果表明,主要生产区紫菜中总砷含量变化范围为24.6~31.4 μg·g-1,无机砷含量很低,仅占总砷含量的0%~1.96%。吴成业等[40]对海藻中无机砷超标问题进行了研究,结果表明,无机砷的超标率达100%,其中紫菜无机砷含量为9.36~29.7 μg·g-1,平均为17.3 μg·g-1;海带无机砷含量为7.22~20.1 μg·g-1,平均为11.0 μg·g-1。李卫华等[33]以阴、阳离子交换色谱与电感耦合等离子体质谱联用检测砷的形态,测定了我国不同海域海藻(海带和紫菜)10种样品中的砷含量,样品总砷的浓度为1.7~38.7 μg·g-1(干重);在大多数紫菜样品中砷糖PO4为主要化合物(0.4~12.7 μg·g-1,干重),其次为砷糖OH(1.0~7.8 μg·g-1,干重);海带样品除含以上2种砷糖外,还含有砷糖SO3(8.9~17.6 μg·g-1,干重),及DMA(1.7~3.2 μg·g-1,干重),无机砷在所有样品中未检出。朱亚尔等[41]对我国不同产地的几种海藻砷形态和含量进行了分析,结果表明,4种褐藻的总砷和无机砷含量分别在16.6 μg·g-1和5.10 μg·g-1以上,其中羊栖菜的总砷和无机砷含量最高。
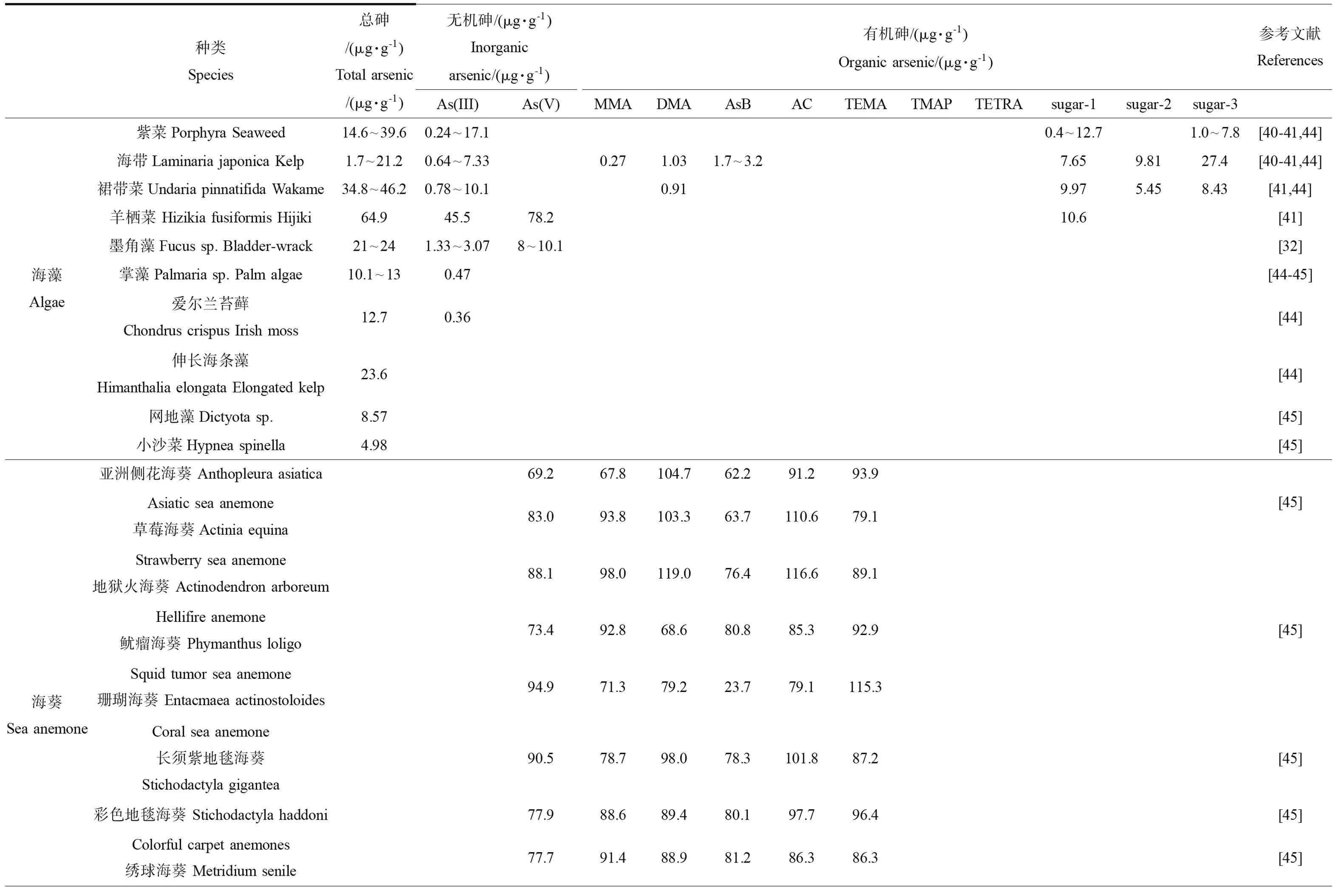
表1 不同海洋生物体内总砷及不同形态砷含量Table 1 The concentrations of total arsenic and different species in different marine organisms
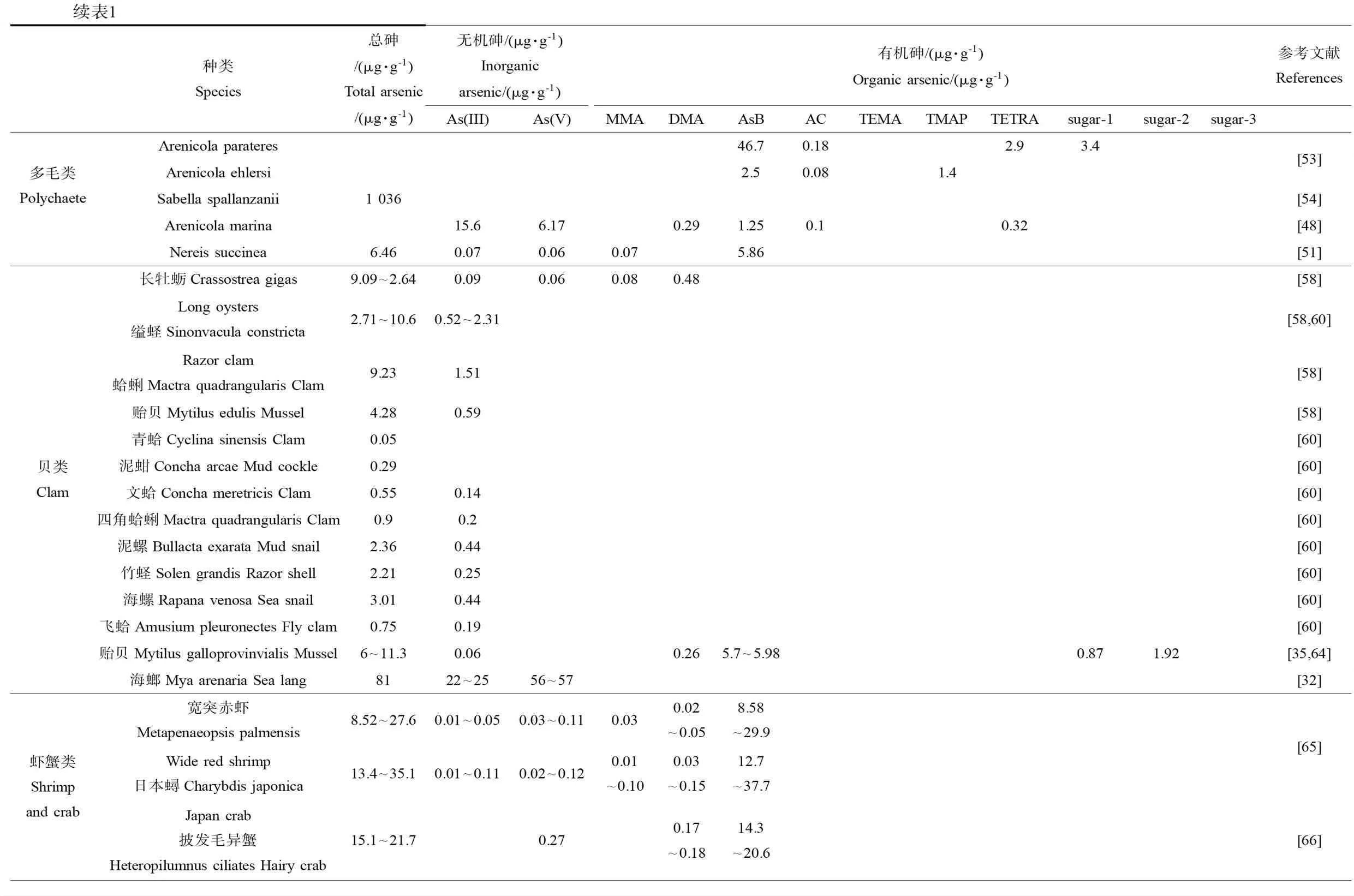
续表1种类Species总砷/(μg·g-1)Total arsenic/(μg·g-1)无机砷/(μg·g-1)Inorganic arsenic/(μg·g-1)有机砷/(μg·g-1) Organic arsenic/(μg·g-1)参考文献ReferencesAs(III)As(V)MMADMAAsBACTEMATMAPTETRAsugar-1sugar-2sugar-3贝类Clam长牡蛎Crassostrea gigas9.09~2.640.090.060.080.48[58]Long oysters缢蛏Sinonvacula constricta2.71~10.60.52~2.31[58,60]Razor clam蛤蜊Mactra quadrangularis Clam 9.231.51[58]贻贝Mytilus edulis Mussel 4.280.59[58]青蛤Cyclina sinensis Clam 0.05[60]泥蚶Concha arcae Mud cockle 0.29[60]文蛤Concha meretricis Clam 0.550.14[60]四角蛤蜊Mactra quadrangularis Clam 0.90.2[60]泥螺Bullacta exarata Mud snail 2.360.44[60]竹蛏Solen grandis Razor shell 2.210.25[60]海螺Rapana venosa Sea snail 3.010.44[60]飞蛤Amusium pleuronectes Fly clam 0.750.19[60]贻贝Mytilus galloprovinvialis Mussel 6~11.30.060.265.7~5.980.871.92[35,64]海螂Mya arenaria Sea lang8122~2556~57[32]虾蟹类Shrimp and crab宽突赤虾Metapenaeopsis palmensis8.52~27.60.01~0.050.03~0.110.030.02~0.058.58~29.9Wide red shrimp日本蟳Charybdis japonica13.4~35.10.01~0.110.02~0.120.01~0.100.03~0.1512.7~37.7Japan crab披发毛异蟹Heteropilumnus ciliates Hairy crab15.1~21.70.270.17~0.1814.3~20.6[65][66]

续表1种类Species总砷/(μg·g-1)Total arsenic/(μg·g-1)无机砷/(μg·g-1)Inorganic arsenic/(μg·g-1)有机砷/(μg·g-1) Organic arsenic/(μg·g-1)参考文献ReferencesAs(III)As(V)MMADMAAsBACTEMATMAPTETRAsugar-1sugar-2sugar-3海洋鱼类 Marine fish金枪鱼Thunnus thynnus Tuna 2.13~6.420.060.02~0.861.07~5.21[35]小鳕鱼Merluccius merluccious Small cod 4.54.1[34]沙丁鱼Sardina pilchardus Sardine 5.6~13.50.415.3~10.6[34]鳕Gadus marhua Cod 8.60.8~1.37.3~210.2~1.7[34]欧洲鮟鱇Lophius budegassa European anglerfish16.012.82.7[34]蓝鳕Micromesistius poutassou Blue cod 8.76.91.5[34]鸟鲂Brama brama Carp bream 10.39.01.2[34]鳎鱼Solea vulgaris Sole 4.22.81.1[34]凤尾鱼Coilia mystus anchovy25.423.10.55[34]加州鲈鱼Micropterus salmonidesCalifornia sea bass2.751.24[34]庸鲽Hippoglossus hippoglossus Hablibut 2.80.1[34]露珠盔鱼Coris gaimard Dew helmet fish22.00.562.362.108.56[74]波纹钩鳞鲀Balistapus undulatusCorrugated filefish24.00.433.012.929.23[74]尾纹九棘鲈Cephalopholis urodelusTail perch25.00.212.221.9910.0[74]黑斑副绯鲤Parupeneus pleurostigmaBlack spotted goatfish27.40.113.232.599.65[74]拟态革鲀Aluterus scriptusMimicry leather filefish30.50.010.301.972.46[74]黑边角鳞鲀Melichthys viduaBlack-edged fish31.80.020.412.012.24[74]海龟类Turtle海龟Chelonia mydas Turtle0.15~1650.02~0.180.13~0.412.10~58.4<0.14<0.29[82,89-91]玳瑁Eretmochelys imbricate Hawksbill22~480.07~2.83<0.080.17~0.87.71~139<1.33<0.14[91]
注:MMA表示一甲基砷;DMA表示二甲基砷;AsB表示砷甜菜碱;AC表示砷胆碱;TEMA表示四甲基砷;TMAP表示三甲砷丙内酯;TETRA表示四甲基碘化砷。
Note: MMA stands for monomethylarsonic acid; DMA stands for dimethylarsinic acid; AsB stands for arsenobetaine; AC stands for arsenocholine; TEMA stands for tetramethyl arsenic; TMAP stands for trimethylarsoniopropionate; TETRA stands for tetramethylarsonium.
在国外,对海藻砷形态进行了大量研究。Ma等[42]综述了海藻(92种红藻、154种褐藻和36种绿藻)中总砷和无机砷的含量。在这些海藻中总砷和无机砷的浓度与种类密切相关,褐藻中砷浓度最高,而绿藻门种类砷浓度最低。在排名前10种褐藻中总砷浓度均超过100 μg·g-1(干重)。Taylor和Jackson[43]研究了新英格兰使用商业收割机收割的10种海藻中总砷和不同形态砷的含量,总砷含量变化范围为4~106 μg·g-1,其中大部分为砷糖;掌状海带(Laminariadigitata)含有高水平的无机砷(2.8~20 μg·g-1)。Koch等[30]研究了加拿大新斯科舍海港的海藻——墨角藻(Fucussp.)砷形态及其生物有效的浓度,海藻总砷浓度范围为27~43 μg·g-1(湿重),无机砷占主要部分,生物可利用部分占63%~81%。Almela等[44]分析了西班牙巴伦西亚商店中产自西班牙、智利、中国、韩国和日本的112个海藻样本体内的总砷和无机砷,结果表明,总砷含量变化范围为0.03~149 μg·g-1(干重),无机砷含量<0.01~117 μg·g-1(干重)。Fattorini等[45]对从古巴辛菲歌斯湾采集的海洋藻类进行不同形态砷的分析,结果表明,网地藻(Dictyotasp.)总砷含量为(8.57±0.75) μg·g-1;乳头凹顶藻(Laurenciapapillosa)总砷含量为(10.1±0.68) μg·g-1;小沙菜(Hypneaspinella)总砷含量为(4.98±0.51) μg·g-1,而其他形态砷均未检测出。综合中国和国外海藻中总砷和不同形态砷分析发现,不同种属的藻类富集砷能力不同,其中,褐藻对砷的累积能力强于其他门类的藻类。同时发现国外采集的海藻体内砷含量普遍高于国内的海藻,海藻体内砷形态主要包含无机砷和砷糖。
1.2 海洋动物
(1)海葵
对不可食用的海洋动物体内砷及其化合物累积的研究,有利于深入了解海洋生态系统中砷循环。从材料选择来说,海葵是模式动物,因为它处于比较低的分类地位,而且它主要的砷形态可能是不常见形态。
目前,国内外关于不可食用海洋动物的砷形态分析很有限,只有少量文献报道了一些不可食用海洋动物(海葵)体内不常见的砷化合物结构形式。有学者在海葵Entacmaeaactinostoloides体内发现TEMA为主要的砷存在形态,而在红海葵Actiniaequine中发现AsB和尚未确定的砷形态[46]。Ninh等[47]对日本9种海葵(Anthopleuraasiatica、Actiniaequina、Actinodendronarboreum、Phymanthusloligo、E.actinostoloides、Stichodactylagigantea、S.haddoni、S.mertensii和Metridiumsenile)体内的砷形态进行了分析检测,结果表明,砷含量的变化范围为1.6~7.0 μg·g-1(湿重),不考虑砷的形态,水溶性砷化合物占总砷含量的80%以上。由于海洋腔肠动物体内含有尚未确定的砷形态,海洋腔肠动物体内砷的形态研究有待于进一步深入开展。
(2)多毛类
人们发现一个非同寻常的现象,在多毛类环节动物特殊的组织中积累了高含量的有毒砷形态。因此,它成了一种潜在的生物指示种。多毛类环节动物具有忍受极高化学压力的能力,有非同寻常的高砷含量和生物累积能力,然而对多毛类环节动物砷化合物含量研究却很少。多毛类环节动物在新陈代谢方面与其他海洋生物差异很大。在多毛类环节动物Arenicolamarina中,无机砷占总砷含量的70%[48]。另一种多毛类环节动物Sabellaspallanzanii的主要砷化合物是DMA,占总砷含量的85%[49]。Nereisdiversicolor和Nereisvirens显示了很强的甲基化能力[50]。
在中国对多毛类体内砷形态的研究较少,Zhang和Wang[51]研究了多毛类N.succinea对砷的生物动力学和生物可利用性,结果发现沉积物是多毛类砷生物累积的主要来源,当喂食多毛类含有砷的沉积物后,无机砷(75.6%)首先是主要的砷形态,在净化过程中AsB(>90%)成为主要的砷形态,表明无机砷发生了生物转化。Zhang等[11]对多毛类N.succinea进行1 mg·L-1As(III)暴露后,发现无机砷(56.9%)是主要的砷形态,其次是AsB(36.4%)。
在国外,对多毛类的砷形态研究已有较多报道。Carlo等[52]对东太平洋热液口生态系统采集的多毛类进行砷形态的分析研究,结果发现,3种多毛类体内主要砷存在形态为DMA,MMA和TMAO含量较少。Foster等[53]对澳大利亚新威尔士南部东南海岸的多毛类环节动物(A.parateres和A.ehlersi)进行砷含量分析,结果表明,A.parateres和A.ehlersi总砷含量分别为(60±5) μg·g-1和(11±5) μg·g-1。Fattorini等[54]研究了亚得里亚海和伊特鲁利亚海的多毛类环节动物S.spallanzanii不同组织中砷的含量,结果表明,鳃状冠中砷的含量最高,达到(1 036±136) μg·g-1(干重)。Geiszinger等[50]应用HPLC-ICP-MS对丹麦欧登塞海湾的海洋多毛类环节动物A.marina体内的砷化合物进行了研究,结果表明,A.marina包含的大部分水溶性砷为无机形式,其中As(III)和As(V)各占58%和16%,而AsB仅占6%,DMA、2种砷糖和TEMA分别占4%、1~3%和1.5%,砷胆碱<1%。综合现有的国内外研究,发现多毛类具有高砷生物累积能力,且对无机砷具有高的耐受力。
(3)贝类
有许多双壳类软体动物种类是环境污染的重要指示生物,因为它们累积各种类型的痕量金属。贝类中污染物含量比其他海洋生物高,因而海洋贝类中的某些污染物常用作海洋污染监测的指标,通过检测它的组织污染程度能反映水体环境的化学污染状况。贝类在中国是很受欢迎的海鲜品,而且在沿海有大量的贝类养殖基地,所以贝类体内的砷及其形态含量受到人们广泛关注。贝类中砷的形态多种多样,包括无机砷和有机砷,有机砷包括MMA、DMA、AsB和AsC等,通常是低毒或者无毒的。据报道,海洋贝类对海水中砷的累积系数高达1.2×103~1.9×103[55],因而海洋贝类砷污染的问题引起了国内外有关学者的重视。
国内学者在海洋贝类砷研究方面开展了大量的工作,何依娜等[56]对舟山地区60批次贝类样品开展调查,覆盖舟山主要养殖品种和外地在舟山市场销售的品种,包括贻贝、缢蛏、扇贝、泥蚶、毛蚶、杂色蛤和文蛤,结果发现,无机砷含量变化范围为0.1~0.47 μg·g-1。黄强等[57]分析了产于莱州附近海域6种常见贝类中无机砷的残留水平,结果显示,无机砷含量的变化范围为0.11~0.35 μg·g-1。唐健和李士敏[58]等对浙江省沿海地区贻贝、蛏子、牡蛎和蛤蜊中砷的形态及含量分布进行了分析,结果表明,总砷含量变化范围为7.49~9.13 μg·g-1,无机砷含量变化范围为0.88~1.38 μg·g-1。Liu等[28]研究了台湾西南沿海4个镇区采集到的245个长牡蛎(Crassostreagigas)样本体内无机砷对人体健康的危害,结果显示,在4个镇区牡蛎体内As(III)和As(V)的平均浓度变化范围分别为0.07~0.15 μg·g-1和0.03~0.06 μg·g-1。崔昆燕和谢美琪[59]采用氢化物发生-原子荧光光谱法测定贻贝中的砷,贻贝样品中总砷含量为5.71 μg·g-1。王咸钢等[60]对南通沿海滩涂23个贝类样品中的总砷和无机砷进行了调查分析,发现总砷含量平均为1.36 μg·g-1,无机砷含量平均为0.28 μg·g-1,无机砷含量全部符合我国《农产品安全质量无公害水产品安全要求》。
国外学者在海洋贝类研究方面也同样开展了大量的工作,Bonsignore等[61]从意大利托斯卡纳几个地区收集的软体动物进行砷含量的检测,结果发现总砷含量变化范围为0.39~78.1 μg·g-1。Krishnakumar等[62]从阿拉伯海湾西部9个近海区域采集的双壳类,分析其总砷和不同形态砷,结果发现总砷浓度变化范围为16~118 μg·g-1,无机砷占比低于0.8%,AsB约占58%。Kucuksezgin等[63]从爱琴海东部地区采集海洋生物,分析发现无机砷的含量很低,仅占0.11%~11.8%。Mato-Fernández等[34]对西班牙采集到的贻贝,检测其体内的砷形态含量,结果显示,总砷的含量为(6.0±0.3) μg·g-1,AsB是贻贝内砷的主要存在形态,含量为(5.7±0.2) μg·g-1,AsC、DMA和As(V)未检测到。Koch等[30]研究了加拿大新斯科舍海港的一种底栖贝类砂海螂(Myaarenaria)体内砷形态以及其生物有效的浓度,软蛤中总砷含量变化范围为218~228 μg·g-1(干重),生物可利用部分占34%~46%,砷的主要形态为无机砷。Schaeffer等[64]研究了从爱琴海采集的紫贻贝(Mytulisgalloprovincialis)体内的砷化合物的含量,在贻贝体内AsB是主要的砷化合物,同时也发现了少量的As(III)、DMA和AsC,砷糖浓度变化范围为0.9~3.6 μg·g-1(干重)。综合现有的国内外调查结果,发现海洋贝类具有高砷富集能力,且其体内主要砷存在形态为AsB。
(4)虾蟹类
随着人们生活水平的提高,海洋虾蟹类具有味道鲜美、低脂肪、高蛋白等优点,深受消费者喜爱,但同时作为一种营养剂较高的甲壳类海产生物,其富集砷元素能力较强。已有的文献中,有关不同品种海洋虾蟹类砷的分布特征的研究报道较少。
在国内,Zhang等[65]从大亚湾12个站位采集19种野生海洋生物,分析其体内总砷和不同形态砷含量,螃蟹(13.4~35.1 μg·g-1)体内砷浓度最高,紧接着是虾(8.52~27.6 μg·g-1),底栖鱼类(3.45~28.6 μg·g-1)和浮游鱼类(1.22~5.23 μg·g-1)。在所有的海洋生物体内AsB(87.3%~99.8%)是最主要的砷形态。Zhang等[66]从南海湛江河口潮间带12个站位采集甲壳类动物,分析其总砷和不同形态砷含量,总砷含量变化范围为3.88~49.2 μg·g-1,AsB占总砷含量的80.6%~98.8%,DMA占总砷含量的0.47%~3.44%。
在国外,Simon等[67]对法国超市中小虾应用高效液相色谱-紫外-氢化物发生-原子荧光联用(LC-UV-HG-AFS)检测其体内12种砷化合物,在所有样品中AsB是主要的砷形态,浓度变化范围为0.06~1.95 μg·g-1(湿重)。Brisbin等[68]应用一种梯度阴离子交换色析法分析了美国餐厅中新鲜龙虾肌肉内的不同形态砷的含量,结果表明,AsB是主要的砷形态,同时AsC、DMA、MMA和As(V)也被检测出。目前相对于其他海洋生物来说,国内外关于虾蟹类体内砷含量研究尚少,应增强在这方面的研究工作。
(5)鱼类
海洋中鱼类种类多经济价值高,鱼肉是极受人类喜爱的高蛋白、低脂肪食品。鱼肉的化学组成,蛋白质的氨基酸组成等与人体肌肉组成极为相近,故易被人体吸收,其吸收率高达96%。鱼类通常从水环境中累积污染物,已经被广泛用于食品安全性方面研究。在海洋生态系统中,污染物潜在累积于海洋生物体内和沉积物中,而且通过食物链逐渐转移到人体内[69]。由此我们可以认为,水生生物的化学性质尤其是鱼类中重金属的含量对人类健康的影响起着至关重要的作用[70]。许多研究表明,鱼类体内的砷主要从食物中累积[71],鱼体内砷累积量比水体高[72-73],有些鱼类砷含量高达100 μg·g-1;可见鱼类砷含量对人类食物中砷来源具有重要的贡献。砷在海洋食物链中的生物累积过程中,鱼类比其他大部分海洋生物的累积能力要高;同时,由于环境污染加重,鱼类又易将对人类毒害作用极大的砷等物质传到人体。因此,对海洋鱼类体内砷累积状况的研究至关重要。
在国内,Li等[74]从中国的南沙群岛采集38种热带海洋鱼类,检测其体内的总砷和不同形态砷,结果表明总砷的平均含量为20.9 μg·g-1,AsB的含量变化范围为8.56~31.0 μg·g-1,占总砷的31.5%~47.2%。Zhang和Wang[75]调查了中国沿海29种海洋野生鱼类砷的富集状况,不同海洋鱼类体内砷的浓度变化范围为2.09~134 μg·g-1,发现砷浓度存在较大空间差异,湛江海洋底栖鱼类孔虾虎鱼(Trypauchenvagina)体内砷含量达到134 μg·g-1,超过了中国制定安全标准30倍,如果长期摄食,会对人类健康造成潜在危害。
在国外,Bentley和Soebandrio[76]对印尼布雅湾受尾矿污染的216条鱼类体内砷含量进行分析,发现其总砷含量的变化范围为1.71~2.12 μg·g-1。Choi等[77]从韩国3个沿海城市采集36种海洋鱼类,检测其体内总砷和6种砷的形态,结果发现,总砷浓度变化范围为0.02~9.65 μg·g-1,AsB(90.6%)是6种砷形态中主要的存在形态,表明无机砷的生物甲基化以及AsB的累积。Shah等[31]应用(ETAAS)方法检测了巴基斯坦的野鲮和印度鲮等10种鱼类体内总砷和无机砷含量变化,在所有鱼类样品肌肉组织中As(III)和As(V)浓度变化范围分别为1.19~2.05 μg·g-1和0.17~0.46 μg·g-1。Nam等[35]分别应用电感耦合等离子体质谱仪(ICP-MS)和离子色谱-电感耦合等离子体质谱联用仪(IC-ICP-MS)测定了金枪鱼、黄鳍金枪鱼、大眼金枪鱼和旗鱼体内总砷和不同形态砷的含量,总砷、AsB和DMA含量变化范围分别为0.74~6.87 μg·g-1、1.48~5.70 μg·g-1和0.09~0.21 μg·g-1。Mato-Fernández等[34]应用高效液相色谱-紫外-氢化物发生-原子荧光联用仪(HPLC-UV-HG-AFS)检测了小鳕鱼、沙丁鱼和鳕体内的有机砷和无机砷的含量,总砷和AsB含量变化范围分别为4.1~8.6 μg·g-1和4.1~7.3 μg·g-1。Schaeffer等[64]研究了从爱琴海采集的凤尾鱼、海鲷、黑鲈、沙丁鱼体内的砷化合物的含量,在所有样品中AsB是主要的砷化合物,浓度变化范围为2.7~23.1 μg·g-1(干重),同时也发现少量的As(III)、DMA和AsC。结合现有的国内外调查结果,发现海洋鱼类具有高砷富集能力,其体内砷主要存在形态为无毒的AsB,其次为甲基砷,无机砷含量最低,人们可以放心的吃海洋鱼类。
(6)其他海洋动物
其他海洋动物主要指海洋哺乳动物、海鸟和海龟等处于海洋食物链的高营养级动物。在这些海洋动物中,AsB是主要的存在形态,而且在高营养级海洋动物中能达到很高的生物累积量[14]。以往的研究表明,AsB在海洋哺乳动物[78-83]、海鸟[79,81-82,84-85]和海龟[79,81-82,84]肝脏中是主要的砷化合物。
对高营养级海洋动物体内砷含量的研究,国内鲜有报道,而国外则进行了较多的砷形态研究。Perrault等[86]分析了从佛罗里达采集的蠵龟(Carettacaretta)体内的砷含量,结果发现不同个体的蠵龟体内砷含量的变化范围为0.2~11.2 μg·g-1(湿重)。Nicolau等[87]从葡萄牙采集38只海龟——蠵龟(C.caretta),检测不同组织中总砷的含量,结果发现,肌肉组织中砷浓度比肝脏或肾脏中的高,在肌肉组织中砷浓度达到14.8 μg·g-1(湿重)。Fujihara等[84]分析了海洋哺乳动物鳍足类、海鸟和海龟肝脏内砷的累积情况,结果表明,在所有研究的高营养级的海洋动物肝脏中AsB是最主要的砷形态,信天翁在肝脏中砷含量最高,达到(5.8±3.7) μg·g-1(湿重)。Agusa等[88]对日本冲绳石狩湾海龟体内肝脏、肾脏、肌肉和胃中的总砷及其砷化合物的含量变化进行分析,结果表明,肌肉组织中总砷含量比肾脏和肝脏中的高,在所有组织中AsB是主要的砷化合物而且其含量与总砷含量密切相关,与前人研究相符[89]。Agusa等[90]还对日本冲绳Ishigaki岛的11只玳瑁(Eretmochelysimbricate)和20只海龟(Cheloniamydas)体内各脏器器官的总砷、有机砷和无机砷的含量变化进行了分析,发现总砷含量在肌肉组织中最高,AsB在2种海龟中大多数组织中是最主要的砷化合物,在玳瑁体内检测出TMAO含量很高。Kubota等[91]研究了日本热带海洋动物鲸、鳍足类、海牛类、海龟肝脏内的总砷以及各种形态砷的含量,结果表明在所有的砷形态中,AsB是其分析的所有动物肝脏内主要的砷存在形态。Kubota等[92]研究了16种不同的海洋哺乳动物、226个个体随着年龄、性别和栖息地的不同其肝脏组织中砷含量变化,发现不同种类和个体间砷含量变化很大,变化范围为<0.10~7.68 μg·g-1(干重),喂食头足类和甲壳类动物的海洋哺乳类比喂食鱼类的海洋哺乳类含砷量更高。对大多数种类来说,砷含量没有随着性别、年龄和体长的变化而变化。因此,高营养级海洋动物与海洋鱼类一样,其体内砷存在形态主要为AsB,与海洋鱼类不同之处在于,海洋鱼类体内AsB主要存在于肌肉组织中,而高营养级海洋动物体内AsB主要存在于肝脏组织中。
2 结语和展望(Conclusions and prospects)
综上所述,国内外对砷元素在海洋生物包括海藻、腔肠动物、环节动物、甲壳动物和鱼类等体内的累积和形态变化开展了系列分析研究,并取得了一定进展,为深入揭示海洋环境和生物体内砷的分布特征和转化规律积累了基础资料。但就目前发表的文献来看,一方面,由于地域性和生活习惯的差异,许多常见的海洋生物尤其大宗资源生物和经济种类还未被分析,缺乏资料的系统性,不能满足对海洋生物体砷形态和含量变化作出全面的定性和定量评估;另一方面,样品处理和检测技术方法还需要进一步优化和提高精度,以便获取更加有效和充足的数据资料,为海洋生物和食品安全标准制订提供基础。
针对目前研究工作的不足和发展的需要,提出以下几点建议:
(1)加强检测技术的研究,以使砷不同形态的检测结果更加准确可靠。
(2)对海洋生物的样品前处理技术进行更加深入的研究,以期提高不同形态砷的检测精度和回收率。
(3)加强砷标准品的研制和制备,为更多不同形态砷的定性检测提供标准。
(4)对可食用海洋生物和不可食用海洋生物体内砷含量及砷形态均需进一步开展深入研究,以使整个海洋生物体系砷形态分析更加全面系统;深入研究砷从海洋环境到生物体内、在海洋食物链或生态系统中不同营养级之间的传递过程、累积和形态变化特征,以期揭示砷的迁移转化规律和机制。
(5)针对人类暴露砷影响健康的问题,从模拟口服暴露的人类细胞组合出发,系统研究砷进入人类细胞组合的吸收通路、产生的毒性效应和致毒机理以及解毒策略,深入挖掘砷暴露诱导产生毒性效应的分子证据,为深入了解砷沿食物链传递以及在人体内的代谢过程,减低海洋生物食品砷污染以及造成的人类健康危害问题提供理论支持和控制方案。

