双酚A诱导下双齿围沙蚕实时荧光定量PCR内参基因的筛选
薛圣伦,黄艺,孙嘉,杨大佐,周一兵,赵欢,*
1. 大连海洋大学,辽宁省海洋生物资源恢复与生境修复重点实验室,大连 116023 2. 大连海洋大学,农业农村部北方海水增养殖重点实验室,大连 116023
双酚A(bisphenol A, BPA)又称为二苯酚丙烷,是一种重要的有机化工原料。塑料中添加BPA可以提升原料的透明度、耐用性和韧性,特别是可以防止酸对金属内壁的腐蚀,因此BPA作为添加剂广泛应用于金属罐头的树脂内膜,牙套塑封剂和婴儿奶瓶等塑料产品。每年全世界约有2 700万吨含BPA的塑料生产,而我国BPA的消耗量为206 000 t·a-1[1]。BPA在高温条件下极易从塑料制品中溢出,这使得环境中BPA污染相当普遍。邓旭修和黄会[2]的研究表明我国渤海海域的BPA含量最高可达到20.1 μg·L-1,而在黄浦江水体中BPA浓度为170~3.52×103ng·L-1[3]。国外水体中的BPA污染也有报道,Belfroid等[4]调查显示荷兰河口中的BPA浓度为11.0~330 ng·L-1,韩国西瓦湖表层水中的BPA浓度为13.0~50.4 ng·L-1[5]。早在1936年,Dodds和Lawson[6]就已发现BPA具有雌激素活性,可通过与雌激素受体结合或影响细胞信号传导途径等其他方式模仿或干扰内源性雌激素作用,发挥雌激素样效应。任文娟等[7]研究发现BPA及其类似物可以使斑马鱼(Brachydaniorerio)卵的孵化率显著降低,并造成胚胎发育畸形。同时郭依晨等[8]研究发现,双酚A不仅会导致斑马鱼发育过程中畸形率的上升,还会造成幼体运动量减少,趋光性减弱,推测双酚A在幼体发育阶段具有发育毒性。此外,Gentil等[9]发现10-9mol·L-1浓度BPA诱导可以抑制斑马鱼甲状腺激素受体的转录,干扰斑马鱼甲状腺一些特定基因的表达。已经有研究均表明BPA可以干扰机体内源性激素作用,引起动物生殖器官畸变,神经系统和免疫系统功能出现紊乱,因此关于BPA对生物体的毒性效应机制备受关注。
在研究毒性效应时,目前常用实时荧光定量PCR技术(Real-time quantitative reverse transcription polymerase chain reaction, qRT-PCR)对目的基因的表达进行定量分析。实时荧光定量PCR技术通过荧光信号对PCR过程中DNA的累积速率进行检测,从而减小检测最终产物浓度时有较大变异系数的问题[10]。实时荧光定量PCR分为相对定量和绝对定量2种方法,虽然绝对定量法可以更为准确地测定反应过程中DNA含量,但是由于实验操作较为复杂且较容易污染,因此目前应用比较普遍的是相对定量法。在进行相对实时荧光定量PCR时,需要选择表达相对稳定的基因作为内参基因,对目的基因的表达进行矫正和标准化。但是越来越多的研究发现,稳定表达的内参基因几乎不存在,在实验过程中操作差异或是物种差异等因素会引起内参基因表达发生变化,从而影响目标基因表达的准确性[11-13]。牟政强等[14]在菲律宾蛤仔(Ruditapesphilippinarum)内参基因的筛选中发现,在发育过程中Actin的表达不稳定,而在成体不同组织中Tub的稳定性最差,表明在同一物种的不同发育时期或不同组织器官中其内参基因的表达会存在差异。张丽莉等[15]发现杂色鲍(Haliotisdiversicolor)在甲状腺激素受体(TR)干扰下不同内参基因表达存在较大差异,其中Actin和RPS9的表达最为稳定。Xu等[16]研究表明急性氨盐诱导下,中国沿海长蛸(Octopusminor)不同组织内内参基因的表达也存在较大差异,其中Actin在诱导前后表达差异较大。上述报道说明同一物种在外界环境变化和内在生长过程中不同内参基因的表达稳定性存在明显差异,因此为了保证反应目标基因表达的准确性,在利用相对实时荧光定量PCR开展实验之前,进行内参基因的筛选非常有必要。
双齿围沙蚕(Perinereisaibuhitensis)是一类广泛分布在我国海岸带的底栖无脊椎动物,该物种的沉积食性使得其极易接触沉积物中的污染物。近年来对多毛类的研究表明,部分多毛类包括双齿围沙蚕在内对污染物具有很强的耐受性[17]。对于沙蚕通过何种机理降低有害污染物在其体内的毒性这一科学问题目前已引起学者的广泛关注。Chen等[18]利用实时荧光定量PCR证明双齿围沙蚕体内CYP4基因表达的变化与石油烃污染浓度存在明显的剂量诱导效应,Yang等[19]发现重金属Cd和Cu单一及复合诱导下沙蚕体内金属蛋白II(metalloprotein II, MPII)基因表达会明显升高。鉴于内参基因在不同污染物胁迫下表达的稳定性存在差异,本研究开展BPA诱导下双齿围沙蚕内参基因的筛选,为了进一步开展BPA对双齿围沙蚕的分子毒性效应研究提供重要的数据支撑。
1 材料与方法(Materials and methods)
1.1 实验材料
实验动物双齿围沙蚕(P.aibuhitensis)采自大连金州养殖场,筛选出其中活力较好、大小适中(3±0.5) g的完整个体运回实验室,在实验室条件下先暂养14 d,每24 h更换一次海水。暂养的海水为大连黑石礁海域的沙滤海水,水温(16±0.5) ℃,盐度31~32,pH 8.25±0.1,并且其中投喂海泥等饵料。
实验所用的BPA和二甲基亚砜(dimethyl sulfoxide, DMSO)均购于北京索莱宝公司,属分析纯。
1.2 毒性实验
参照中华人民共和国国家海水水质标准(GB 3097—1997)及已有黄渤海BPA浓度文献报道[2,20],实验共设2个BPA浓度组,分别为10 μg·L-1和50 μg·L-1,另设置一个海水空白对照组。先称取0.1 g BPA粉末,定容于100 mL DMSO中,制备储备溶液(1 g·L-1),在进行实验前,添加不同体积储备液至海水中,配制成设置浓度。在进行实验前3天沙蚕停止投喂饵料。实验在2.5 L的烧杯中进行,选择活跃和中等大小的沙蚕放入烧杯中,每个烧杯放置20尾沙蚕,每个浓度设置3个重复。在毒性实验期间,不进行饵料投喂,水温和注氧与暂养期保持一致,并每隔24 h更换一次毒液。分别在12 h、24 h、48 h、72 h、96 h时取样。在每个烧杯中随机选取3尾沙蚕,剪取体壁后迅速置于-80 ℃冷冻保存备用。
1.3 RNA提取及cDNA合成
称取0.1 mg组织样品按照Trizol(TaKaRa, 大连)试剂盒说明书提取样品的总RNA,利用1%的琼脂糖凝胶电泳检测其完整性,利用NanoDrop 2000(Thermo Scientific, 美国)测定RNA的浓度。
RNA反转录成cDNA采用EraserPrimeScriptTMRT reagent Kit (TaKaRa, 大连)试剂盒,反应分为去除基因组DNA和反转录两步,反应体系总共20 μL,包括PrimeScript RT Enzyme Mix I 1.0 μL;RT Primer Mix 1.0 μL;5 × PrimeScript Buffer2 4.0 μL;RNase Free ddH2O 3.0 μL;总RNA 1 μL;去除gDNA的反应液10 μL。反转录条件为37 ℃反应15 min,85 ℃反应5 s,产物于-20 ℃保存备用。
1.4 引物设计
根据实验室前期构建的双齿围沙蚕转录组库,筛选肌动蛋白(beta-actin, Actin)、微管蛋白(beta-tubulin, Tub)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、核糖体蛋白5(ribosomal protein L5, RPL5)、琥珀酸脱氢酶(succinate dehydrogenase complex flavoprotein subunit, ASDHA),组蛋白(Histone Cluster 1 H2A Family Member A, HH2A)6个表达量较为稳定且常用的内参基因作为备选管家基因。利用Primer5.0设计引物并交由大连宝生物技术有限公司合成,引物信息见表1。
1.5 实时荧光定量PCR
实验采用TB®Premix Ex TaqTMII(Tli RNaseH Plus)试剂盒(TaKaRa, 大连)进行实时荧光定量PCR,实时荧光定量PCR反应体系共20 μL,包括模板cDNA 2 μL,正、反向引物(浓度为1 μmol)各0.8 μL,TB®Premix Ex TaqTMII(Tli RNaseH Plus)10 μL,ROX Reference Dye II 0.4 μL,ddH2O 6.0 μL。反应在ABI 7500 PCR仪上进行,PCR反应包括40个循环,反应条件以Actin为例:95 ℃、预变性30 s,然后95 ℃、5 s,退火温度为60 ℃,30 s进行40个循环。其他内参基因的退火温度参见表1。反应结束后观察溶解曲线,发现每个内参基因产物均为单一峰值,表明产物单一,将PCR产物送去宝生物公司进行测序验证。
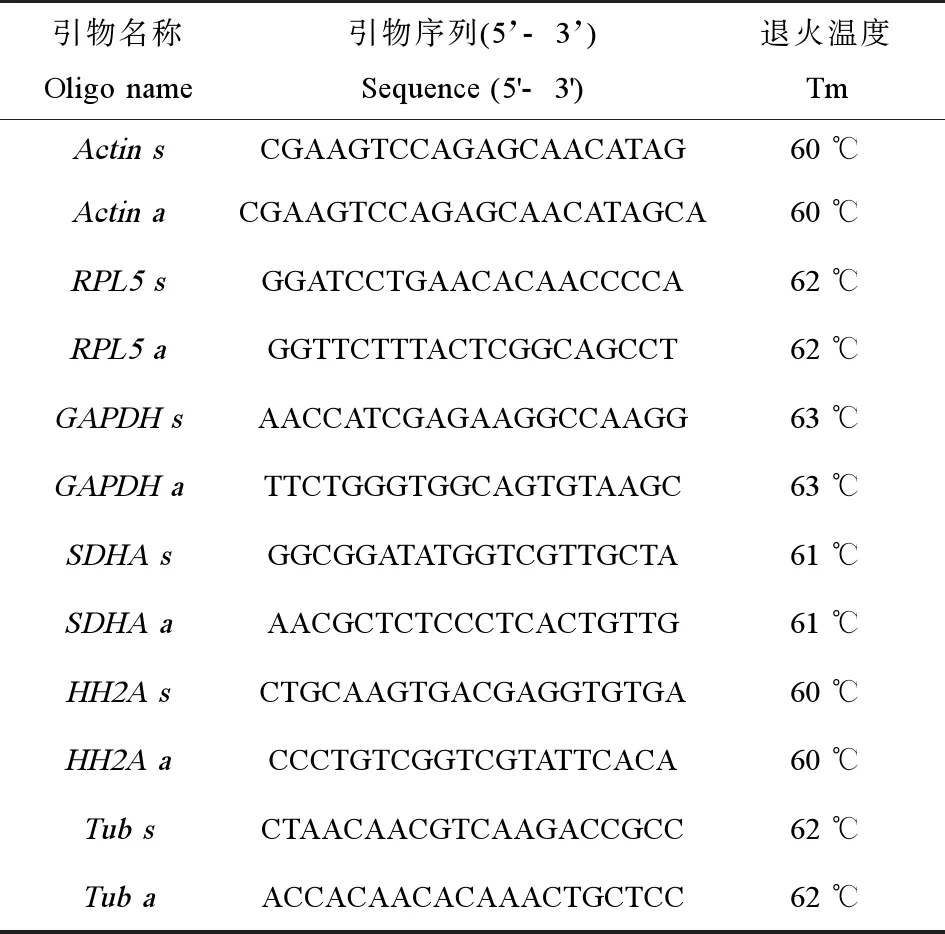
表1 内参基因的引物序列信息Table 1 Primer sequences for reference gene
1.6 数据分析
利用2ΔCt进行数值计算[21-22],用GeNorm、Normfinder和Bestkeeper软件分别来分析基因的表达稳定性。最后采用平均加权赋值法,综合分值越小的基因判定为越稳定。
2 结果(Results)
2.1 RNA质量检测
1%琼脂糖凝胶电泳检测结果表明提取的RNA具有5S、18S、28S三条条带,其中28S与18S的条带亮度比大约为2:1,且条带清晰(图1),总RNA样品经过微量核酸定量仪检测,结果显示OD260/OD280值均在1.8~2.0之间,说明提取的总RNA质量良好,可以用于后续实时荧光定量实验。
2.2 内参基因的表达水平分析
荧光定量PCR中,Ct值的大小表示基因表达的丰度,Ct值越小,代表该基因的表达水平越高。图2显示6对内参基因Ct值,对比本实验不同浓度BPA诱导下沙蚕6对内参基因Ct值的大小,从大到小依次为RPL5>Tub>HH2A>SDHA>GAPDH>Actin。其中的Actin的Ct平均值最小,且波动最小,在14.58至18.58之间波动,表明该基因表达水平最高;而RPL5 Ct平均值最大,在24.96至28.07之间波动,表明该基因表达水平最低。Ct值波动范围最大的为GAPDH,在16.24至18.89之间波动。
2.3 内参基因的稳定性分析
2.3.1 Bestkeeper软件分析结果
Bestkeeper软件直接对基因表达的Ct进行分析,以标准差(SD)和调节系数(±x-fold)为衡量标准,评判基因表达的稳定性。将BPA诱导后的双齿围沙蚕体内6对内参基因Ct值带入Bestkeeper软件进行分析,结果如表2所示,可以看出除GADPH的SD(±Cq)值大于1,其余5个候选内参基因的值均小于1。SD数值越小表示基因表达越稳定,如若大于1,则说明该基因不能稳定表达。根据软件默认标准可知,除GADPH外其他基因均符合作为内参基因的标准,其中表达最稳定的是Actin和RPL5。
2.3.2 GeNorm软件分析结果
GeNorm软件对内参基因的2ΔCt值进行分析,计算出基因表达量的平均稳定值M,M值越小越稳定,M值若大于1.5,则说明该基因不能稳定表达。

图1 双齿围沙蚕总RNA注:M为DL2000 DNA Marker;1~15为海水对照组RNA提取结果。Fig. 1 Total RNA of P. aibuhitensisNote: M, DL2000 DNA Marker; 1-15, The results of extraction of total RNA in control group.
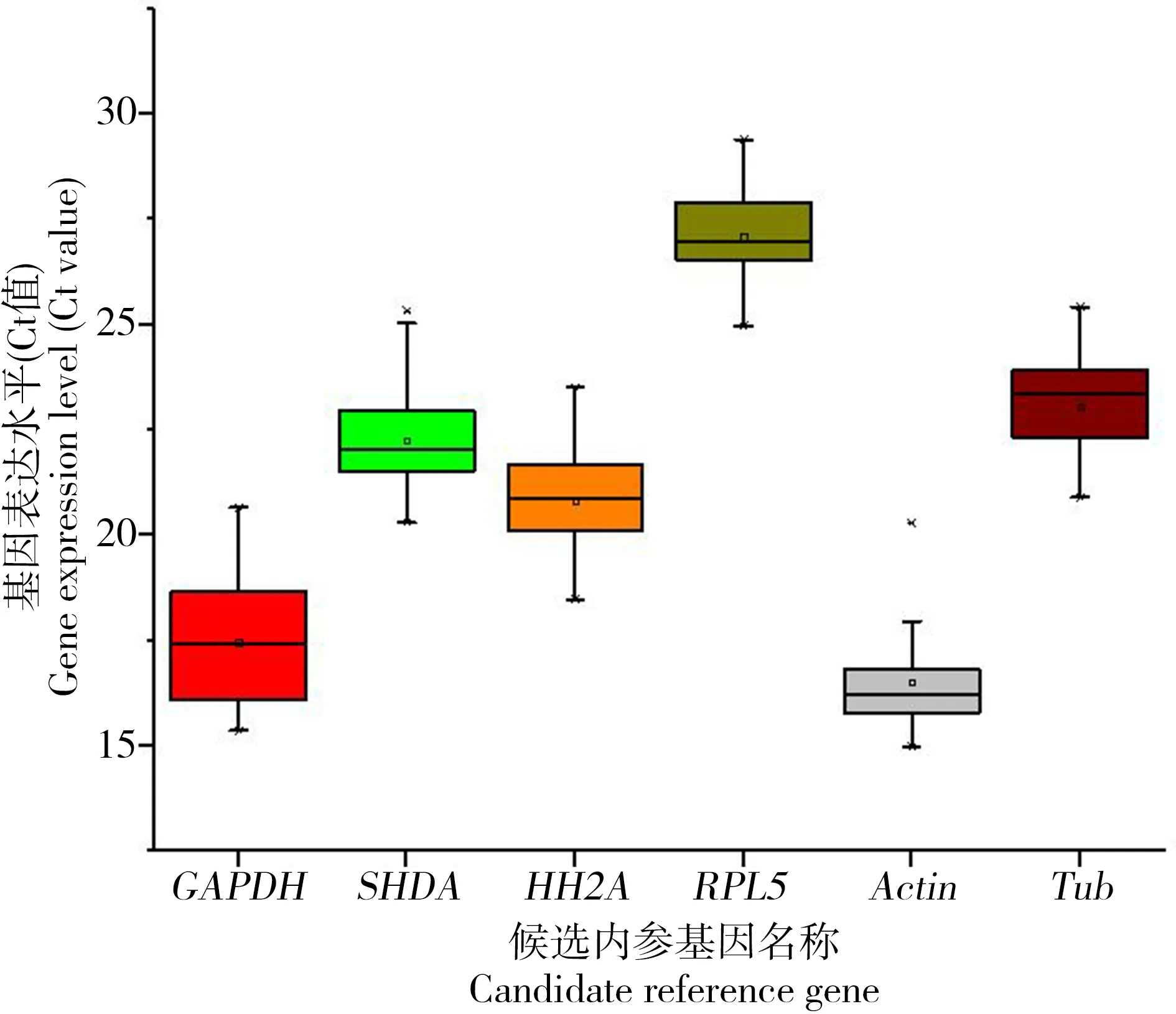
图2 双齿围沙蚕实时定量PCR分析中各候选基因的表达水平注:图中数据为平均值±标准误。Fig. 2 Expression levels of candidate reference genes in P. aibuhitensisNote: Data in the figure are mean ± SE.
如图3中所示,本实验中6对内参基因的M值从大到小分别为GAPDH(1.24)>HH2A(1.17)>Tub(1.01)>Actin(0.94)>RPL5(0.87)>SDHA(0.86),均小于1.5,表明6个内参基因都可以稳定表达,其中RPL5和SDHA是较为稳定的2组内参基因。除此之外,GeNorm软件还可通过计算候选内参基因的配对差异值(pairwise variations)Vn/n+1分析最适内参基因数。在本实验中Vn/n+1都大于0.15,但是V5/6最小为0.193(图4),表明6个内参基因数可以筛选出较为稳定的内参基因。
2.3.3 Normfinder软件分析
Normfinder主要利用组内方差和组间方差对内参基因表达的稳定值(stability value)进行分析。基因表达稳定值越大,说明基因的稳定性越差。本实验分析结果如图5所示,可以看出6个内参基因表达稳定性数值从大到小依次为Actin>SDHA>RPL5>Tub>HH2A>GAPDH,表明Actin的稳定性最好,GAPDH的稳定性最差。

图3 GeNorm软件分析下双酚A(BPA)诱导下双齿围沙蚕各内参基因的表达稳定值(M)Fig. 3 Expression stability values (M) of reference genes exposed to bisphenol A (BPA) in P. aibuhitensis analyzed by GeNorm software

图5 Normfinder软件分析BPA诱导下双齿围沙蚕各内参基因的表达稳定值Fig. 5 Expression stability values of reference genes in P. aibuhitensis after exposure to BPA analyzed by Normfinder software
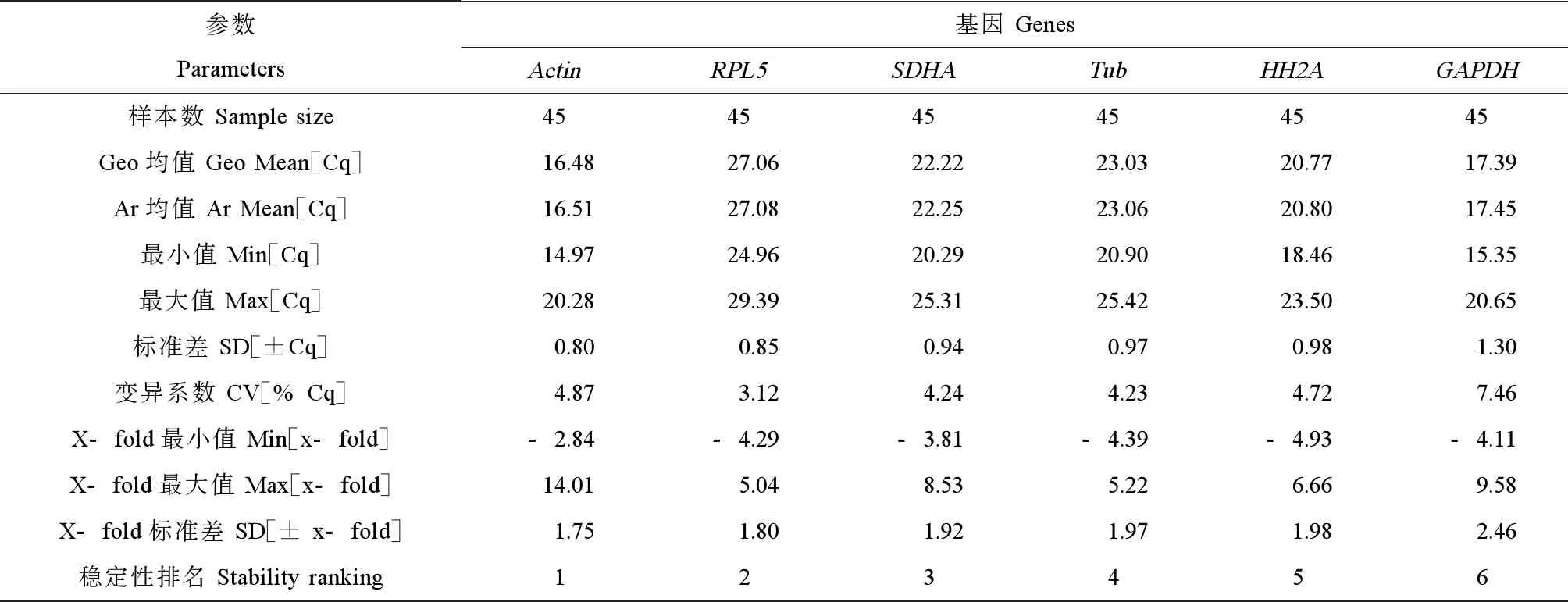
表2 Bestkeeper分析BPA诱导下双齿围沙蚕内参基因表达稳定性Table 2 The expression stability of reference genes under BPA exposure in P. aibuhitensis by Bestkeeper software
2.3.4 综合分析
根据3种软件给出的排名计算几何平均数,将所选6个基因进行综合排名,结果如表3所示。可以看出Actin、SDHA和RPL5虽在不同软件中排名各有不同,但稳定性都较好。而Tub、HH2A和GAPDH的稳定性较差。经过计算平均值可以得出这6种候选内参基因的稳定性由高到低排名是Actin>SDHA>RPL5>Tub>HH2A>GAPDH。
3 讨论(Discussion)
随着分子生物学技术的发展,实时荧光定量PCR(qRT-PCR)凭借其较好的精确性和灵敏性在研究基因表达方面得到广泛的应用。在进行qRT-PCR的时候,为了获得更为可靠的结果,不仅要控制实验设计和操作过程中的误差,更要选择合适的内参基因[23]。理想条件下的内参基因需要有以下特点:1)在同一物种的不同发育阶段和不同的组织器官中的表达量不存在显著差异[24];2)不受内源或者外源性因素的影响,在诱导条件下表达稳定;3)所选取的内参基因与目的基因的表达水平相近;4)选择的内参基因不存在假基因(pseudo gene),从而避免基因组DNA的扩增[25]。但是在实际实验过程中,符合以上所有条件的内参基因基本不存在,在选取内参基因的时候仅根据文献来筛选是远远不够,还应该在特定的测试条件下仔细分析和评估选定内参基因的稳定性。目前常用的内参基因包括Actin、Tub、EF1α、GADPH以及HH2A等,其中Actin是最为常用的内参基因。曹滕飞等[26]在对氨态氮诱导下的成体菲律宾蛤仔鳃组织中内参基因的研究时发现,在18SrRNA、Actin、Tub、EF1α、Ub和CyPA6个候选内参基因中,表达最稳定基因是EF1α,Actin的表达也比较稳定,没有出现较大的差异,说明在同一组织器官中,Actin在诱导前后的表达量差异不大。张丽莉等[15]的研究显示,杂色鲍在变态过程及幼虫甲状腺激素受体(TR)干扰下,Actin的表达量均有较高和稳定的水平,因此Actin可以作为研究杂色鲍发育和甲状腺激素受体干扰时的内参基因。徐建波等[27]亦对杂色鲍的变态过程中3个阶段的幼虫进行内参基因的分析,发现Actin的表达十分稳定,在RNAi条件下,Actin的稳定性仅次于RPS9,更进一步的验证了Actin在杂色鲍变态过程中可以当作内参基因使用。除此之外,Zheng等[28]在对牙鲆(Paralichthysolivaceu)的内参基因研究也证明了Actin作为通用内参基因的稳定性很高。本实验室之前的研究发现,无论在铜、镉等无机重金属,还是在石油烃和溴氰菊酯等有机污染物的胁迫下,双齿围沙蚕Actin的表达都相对稳定[18-19]。在本实验结果,Bestkeeper和Normfinder软件分析发现,Actin是最稳定的内参基因,而在GeNorm软件中获得的最稳定的内参基因是SDHA,Actin仅排在第3位。虽然不同软件算法存在少许差异,从表3可以看到Actin的稳定性排名在3种软件的分析结果中均为位于前三,说明Actin不论是在表达丰度上还是表达的稳定性上都是最好的。虽然SDHA的稳定性排名也较高,但是其在双齿围沙蚕体内的表达量没有Actin高,因此推荐Actin作为双齿围沙蚕的通用内参基因。
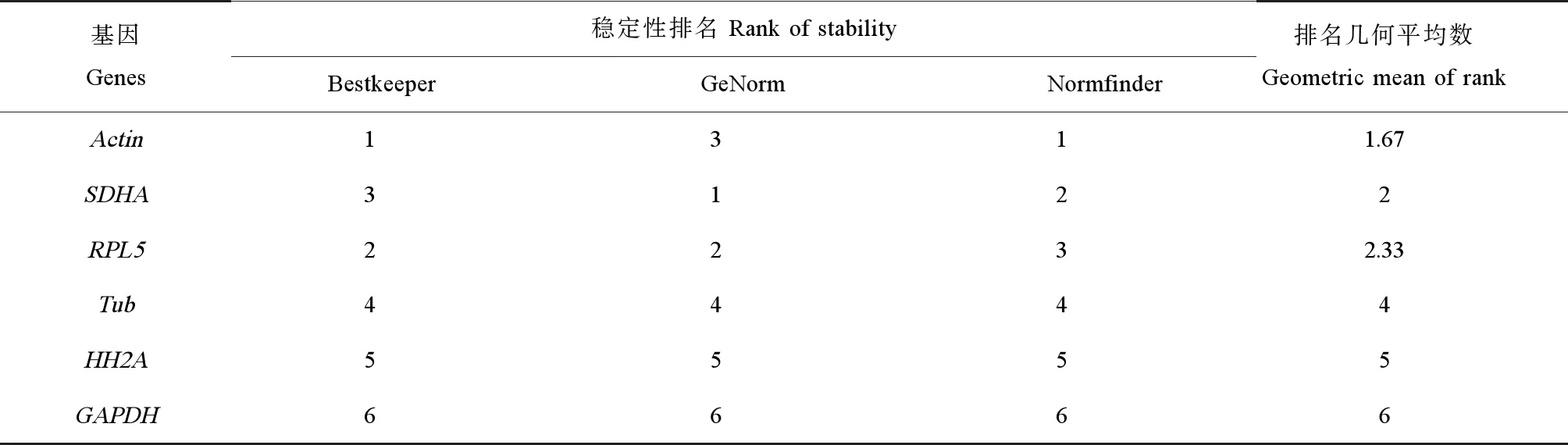
表3 BPA诱导下双齿围沙蚕候选内参基因表达稳定性排名Table 3 Ranks of the candidate reference genes for qRT-PCR in P. aibuhitensis under BPA exposure
然而在一些特定的条件下,Actin的表达量同样不稳定。如Xu等[16]证实在急性氨胁迫下,中国沿海长蛸中Actin的表达稳定性较差,同时其表达量也存在较大差异。Zhong等[29]发现,Actin的表达量在缺氧条件下波动很大,同时还指出GAPDH亦不适合在缺氧条件作为内参基因使用。徐安定等[30]研究发现在缺氧条件下脑星形胶质细胞中Actin的表达量明显下降,而GAPDH表达却是明显升高的;由于Actin为肌动蛋白,在低氧的条件下其表达会受到一定程度的抑制,而GAPDH作为糖酵解的关键酶,在缺氧条件下表达量会显著升高。因此在缺氧以及影响机体氧代谢的条件下这2个内参基因不适合作为内参基因。在本实验中,GAPDH表达量很高仅次于Actin,但其表达稳定性在3个软件评估时均为最不稳定,特别在Bestkeeper软件分析时,其SD值大于1,故不推荐其作为内参基因使用。
本实验同时利用GeNorm软件进行最适内参基因数Vn/n+1的分析。当Vn/n+1<0.15时说明无需引入更多对内参。在本实验中,虽然可以看到V5/6值最小,但是三组Vn/n+1值均大于0.15,这表明继续引入更多的内参基因有可能会降低标准化因子的配对差异值,还需要进一步实验验证。
综上所述,本研究使用了目前最常见的3种内参基因稳定性评价软件Bestkeeper、GeNorm和Normfinder对BPA诱导下双齿围沙蚕的6个候选内参基因进行稳定性分析。通过综合表达的稳定性和表达量的差异分析来看,Actin不仅在表达丰度还是稳定性上都较好,推荐作为内参基因使用。本研究将为探究双酚A对海洋无脊椎动物沙蚕的分子毒性机制提供一定的数据支持。

