γ射线外照射对大黄鱼幼鱼生长的影响
杨青川,纪建达,王蕾,3,于涛,*
1. 自然资源部第三海洋研究所海洋放射性技术与环境安全评估实验室,厦门 361001 2. 厦门大学海洋与地球学院,厦门 361101 3. 厦门华厦学院环境与公共健康学院,厦门 361024
随着水域生态环境面临的放射性污染压力增大,人们对生物多样性保护意识的增强,非人类物种的电离辐射影响愈加受到重视。国际放射防护委员会(ICRP)于2003年发表的第91号出版物《评价非人类物种电离辐射影响的框架》和2007年的ICRP建议书,都强调了非人类物种辐射防护在环境生态系统的重要性[1-2]。我国在2003年颁布的《放射性污染防治法》和《核安全与放射性污染防治“十二五”规划及2020年远景目标》重点强调了放射性污染防治在生态保护中的特殊性和重要性[3-4]。目前,我国已建成和在建核电站全部位于滨海地区,随着滨海核电液态流出物的持续排放,使我国近海海洋生物面临的放射性污染风险有所增加[5]。2011年3月发生的福岛核事故对于海洋生态环境及非人类物种的长期辐射影响,使得人工放射性核素对于海洋生物的辐射影响愈加受到国内外的密切关注。
20世纪50年代人类开始关注电离辐射的生物效应[6],通常,电离辐射可对生物体生长发育、繁殖、遗传等方面造成影响,其机制主要是电离辐射通过直接或间接方式对生物体发生作用,使细胞受损或死亡,损伤遗传物质,影响生物体的生长与繁殖[7]。20世纪70年代人们开始重点关注对水生生物的辐射生物效应[8],对于水生生物而言,鱼类的辐射敏感性最高,主要表现在半致死剂量比其他水生生物要低得多,而对于同一种生物的不同发育阶段来说,生物的早期发育阶段对辐射的敏感性更高[9],经济合作与发展组织(OECD)认为鱼类的早期发育阶段可以作为研究独立效应的实验模型[10]。相比之下,我国在水生生物辐射效应研究方面起步晚、发展缓慢,至今只在水生模式生物如斑马鱼以及水生无脊椎动物如贝类等方面有研究[11-12],涉及斑马鱼胚胎生长发育、DNA损伤以及贝类辐射生物效应等方面;对于海洋栖息物种开展的电离辐射效应研究就更少[13]。
大黄鱼(Pseudosciaenacrocea)属于硬骨鱼纲(Osteichthyes)鲈形目(Perciformes)石首鱼科(Sciaenidae)黄鱼属(Larimichthys),是我国在黄海中部以南至琼州海峡以东的沿海约60 m等深线以内特有的地方性海水鱼类;作为我国传统的四大海洋经济鱼类之一,也是我国近海养殖的主要经济鱼类,年产量8.6×104t,具有重要的经济地位[14-15]。此前,有学者对大黄鱼在金属毒理以及外界环境胁迫方面进行研究[16-17],结果显示大黄鱼对于水体中重金属、温度、操作胁迫等环境因素具有一定的敏感性。在生物电离辐射影响方面,已有海洋经济鱼类如大西洋鲑辐射生物效应的报道[18],而我国还未见海洋经济鱼类的辐射生物效应方面的研究。因此,本研究通过一定剂量的γ射线外照射,观察大黄鱼幼鱼在死亡率、摄食率、抗辐射氧化损伤、消化等方面的辐射响应,探讨γ射线对大黄鱼幼鱼的辐射影响,为我国海洋鱼类辐射生物效应的研究提供基础数据积累。
1 材料与方法(Materials and methods)
1.1 实验对象
实验用的大黄鱼购自福建省宁德市富发水产有限公司,为人工培育的三月龄幼鱼,体重(15±5) g,体长(12±3) cm。总共6缸大黄鱼以30尾每缸(200 L海水)的密度暂养于实验室养殖池内30 d。养殖用海水为自然海水(取自厦门白城海域,过氯消毒),盐度27‰±1‰,pH 7.8,温度(23±1) ℃。养殖光周期12 h:12 h,按0.04 g每尾喂食大黄鱼复合饲料,每天早晚各一次。实验室采用循环养殖池养殖大黄鱼,养殖池具有过滤颗粒废物、含氮废物,恒温循环,充氧,24 h水温监测等功能。实验过程中,详细记录大黄鱼每日状况,包括病害、活力、摄食等情况。
1.2 主要仪器和试剂
仪器:UV-1800BPC分光光度计(上海,美普达仪器有限公司);H1850R高速台式冷冻离心机(长沙,湘仪离心机仪器有限公司);DW-HL388超低温冷冻储存箱(合肥,中科美菱低温科技有限责任公司);弗鲁克F-10高速匀浆机(上海,弗鲁克公司);HWS12电热恒温水浴锅(上海,一恒科学仪器有限公司);SF 2000三按键电子数显卡尺(桂林,广陆数字测控有限公司);EX 224电子分析天平(上海,奥豪斯国际贸易(上海)有限公司)。
试剂:超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、总抗氧化能力(T-AOC)、丙二醛(MDA)、淀粉酶(AMS)、胰蛋白酶(Trypsin)、考马斯亮蓝检测试剂盒均购自南京建成生物工程研究所。
60Co射线辐射源:泉州万核园发展有限公司。
1.3 实验方法
1.3.1 实验分组
将经过一个月实验室驯养的大黄鱼幼鱼随机分为5组,每组25尾,分别标记为0、4、8、16、32 Gy剂量实验组。大黄鱼辐照采取60Co射线一次性全身的外照射,辐射剂量率为0.8 Gy·min-1。辐照期间采用水族专用鱼类打包袋,装入5 L新鲜海水、5尾每袋的密度置于辐射源场。外照射完成后,立即运回实验室并按组别置于玻璃养殖池中继续养殖、观察,养殖条件与驯养时期保持一致。在实验养殖期间,每日上午10时及下午4时定时投喂大黄鱼饵料,按养殖期间每日摄食情况每池投喂1.2 g,至0.5 h后捞取饵料残渣记数称重。
1.3.2 实验处理及样品采集
辐照后第0、1、4、7天,从各组大黄鱼中分别随机取3尾,进行体表病理等观察;观察后,将其立即投入液氮预先冷冻并于超低温冰箱保存直至样品分析。
冻存的大黄鱼取出后低温解冻,拭干表面水份,测量体长及体重并记录;解剖取其肝脏、肠道等进行准确称量、记录;采集的样品随后进行氧化指标等测定。
1.3.3 样品分析
(1)死亡率及生长情况测定
每天记录大黄鱼死亡尾数,计算其死亡率。样品解剖前通过电子游标卡尺准确测量大黄鱼全长,电子分析天平称量,记录2组数据并计算其生长率。
(2)器官指数(IO)的测定
解剖获取的肝脏和肠道组织经匀浆液漂洗、滤纸擦干后称重、记录。按照以下公式计算大黄鱼肝脏指数及肠道指数[19]。
式中:IO为大黄鱼器官指数,Wo为大黄鱼幼鱼器官质量(g),W为大黄鱼幼鱼体重(g)。
(3)按照以下公式计算大黄鱼摄食率(RF)。
式中:RF为大黄鱼摄食率,C1为喂食前饵料质量(g),C2为喂食后捞出饵料烘干后的质量(g),n为鱼缸中大黄鱼尾数(尾),W0为鱼缸中大黄鱼平均体重(g)。
(4)氧化应激指标及消化指标测定
取大黄鱼肝脏组织和肠道组织各0.1 g左右,精确称重记录;加入配制好的匀浆介质,将组织块低温匀浆成10%组织匀浆,2 000 r·min-1离心10 min,取上清液用于总蛋白、SOD、GSH、MDA、T-AOC、AMS、胰蛋白酶活力等测定。上述指标的检测方法以试剂盒说明书进行操作。
1.3.4 数据分析和统计学处理
实验过程获取的数据及其统计分析由SPSS 25.0软件完成。文中数值均以平均值±标准差表示,两组间数据比较采用双尾t检验,并使用双因素方差分析对剂量、时间、剂量与时间的交互作用对大黄鱼幼鱼体重、体长及酶活的影响进行了比较;P>0.05为差异不显著,P<0.05、P<0.01为差异显著。
2 结果(Results)
2.1 60Co射线照射后大黄鱼幼鱼生理指标的变化
实验养殖期间,通过对60Co射线照射后大黄鱼幼鱼死亡率、体重、体长及器官指数等生理指标观察,发现大黄鱼幼鱼对照组和实验组均有不同程度死亡(图1),主要表现为死亡率随着剂量的增大而升高,对照组明显低于辐照组。辐射当天,0 Gy对照组以及8 Gy、32 Gy辐照组各死亡一尾鱼。辐照后0~7 d,对照组以及各辐照组死亡率随时间都呈上升的趋势,辐照组死亡率上升明显高于对照组。至第7天实验结束,对照组大黄鱼幼鱼死亡率为14.6%,4 Gy、8 Gy辐照组死亡率均为26.7%,16 Gy辐照组死亡率为30.0%,32 Gy辐照组死亡率最高为40.0%。
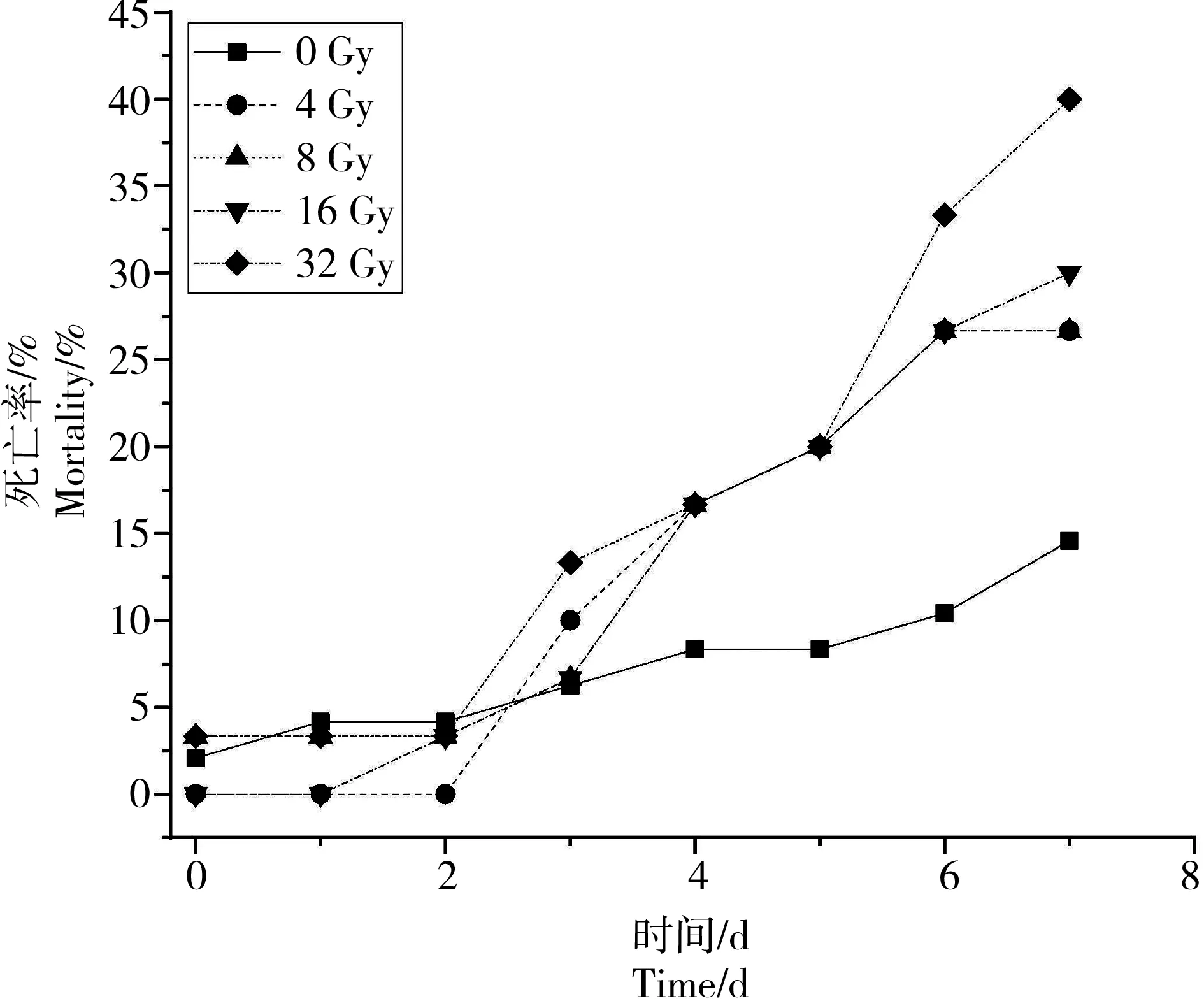
图1 60Co照射后大黄鱼幼鱼死亡率变化Fig. 1 Mortality of juvenile Pseudosciaena crocea after irradiation with different dosages of 60Co
注:P<0.05表示差异显著;P>0.05表示差异不显著。
Note:P<0.05 indicates that the difference is significant;P>0.05 indicates that the difference is not significant.
60Co射线照射后0~7 d,以辐照剂量和时间对各组大黄鱼幼鱼体重和体长进行双因素方差分析(表1),结果显示时间对大黄鱼体重、体长的影响显著(P<0.05),剂量对大黄鱼体重体长的影响不显著,两因素交叉作用均不显著。在肝脏指数及肠道指数方面,60Co射线照射后大黄鱼幼鱼肝脏系数及肠道系数在不同剂量组间无显著差异。
2.2 60Co射线照射对大黄鱼幼鱼抗氧化指标的影响2.2.1 60Co射线照射后大黄鱼幼鱼肝脏组织中SOD活性的变化
60Co射线外照射后的大黄鱼幼鱼肝脏SOD活性变化情况如图2a所示。与对照组相比,照射当天,4 Gy、8 Gy辐照组大黄鱼幼鱼肝脏SOD活性显著高于对照组(P<0.05),其他辐照组无显著差异;到第7天,4 Gy辐照组的肝脏SOD活性与对照组相比已无显著差异,8 Gy、16 Gy、32 Gy辐照组均显著低于对照组(P<0.05)。在大黄鱼幼鱼照射后的养殖期间,对照组无明显变化,4 Gy辐照组的肝脏SOD活性在辐射初期升高,后逐渐降低至近似正常水平,8 Gy辐照组呈先升高后缓慢降低,到第7天显著降低(P<0.05);16 Gy、32 Gy辐照组在辐射初期即显著降低(P<0.05),后缓慢升高但始终低于正常水平。
2.2.260Co射线照射后大黄鱼幼鱼肝脏组织中GSH含量的变化
60Co射线外照射后的大黄鱼幼鱼肝脏中的GSH含量的变化情况如图2b所示。对照组的大黄鱼幼鱼肝脏中的GSH含量在7 d内无明显变化;辐照组在照射后0~4 d与对照组相比除照射后1 d,4 Gy辐照组显著高于对照组(P<0.05)外,其余辐照组均无显著差异;第7天,16 Gy、32 Gy辐照组均显著低于对照组(P<0.05)。对照组大黄鱼幼鱼7 d内无明显变化,4 Gy、8 Gy、16 Gy辐照组的肝脏中GSH水平在辐射初期升高,后逐渐降低,到第7天,4 Gy近似正常水平,8 Gy、16 Gy辐照组则降低至低于正常水平,32 Gy辐照组始终低于正常水平。
2.2.360Co射线照射后大黄鱼幼鱼肝脏组织中T-AOC水平的变化
60Co射线外照射后的大黄鱼幼鱼肝脏中T-AOC水平的变化情况如图2c所示。与对照组相比,照射后1 d的4 Gy辐照组大黄鱼幼鱼肝脏的T-AOC水平显著高于对照组(P<0.05),其余各辐照组在照射后7 d内与对照组无明显差异。对照组大黄鱼幼鱼7 d内无明显变化,4 Gy辐照组的T-AOC水平先显著上升(P<0.05)后降低至近似正常水平,8 Gy、16 Gy辐照组在辐照初期略升高后缓慢降低至略低于正常水平,32 Gy辐照组在辐照初期无显著差异至第7天显著降低。
2.2.460Co射线照射后大黄鱼幼鱼肝脏组织中MDA含量的变化
60Co射线外照射后的大黄鱼幼鱼肝脏中的MDA含量的变化情况如图2d所示。大黄鱼幼鱼照射后7 d内,与对照组相比,照射后0~4 d,除照射后1 d,32 Gy辐照组显著低于对照组(P<0.05)外,4 d内其余辐照组大黄鱼幼鱼肝脏中MDA含量与对照组相比无明显差异(P>0.05),照射后7 d的8 Gy、16 Gy、32 Gy辐照组均显著高于对照组。总体而言,在大黄鱼照射后的养殖期间,对照组大黄鱼幼鱼MDA含量无明显变化,各辐照组均呈先降低后升高的趋势。
2.3 60Co射线照射对大黄鱼幼鱼摄食和消化的影响2.3.1 60Co射线照射后大黄鱼幼鱼摄食率的变化
60Co射线外照射后大黄鱼幼鱼摄食率4 d内的变化如图3所示。第1天16 Gy辐照组摄食率最高,32 Gy辐照组摄食率最低,其他3组差异不大;第2天开始8 Gy和32 Gy辐照组摄食率显著低于其他组;到第4天对照组摄食率最高,其次是16 Gy、4 Gy、8 Gy、32 Gy辐照组。32 Gy辐照组基本不摄食。辐照后1~4 d,对照组摄食率呈上升趋势,辐照组基本呈下降趋势。
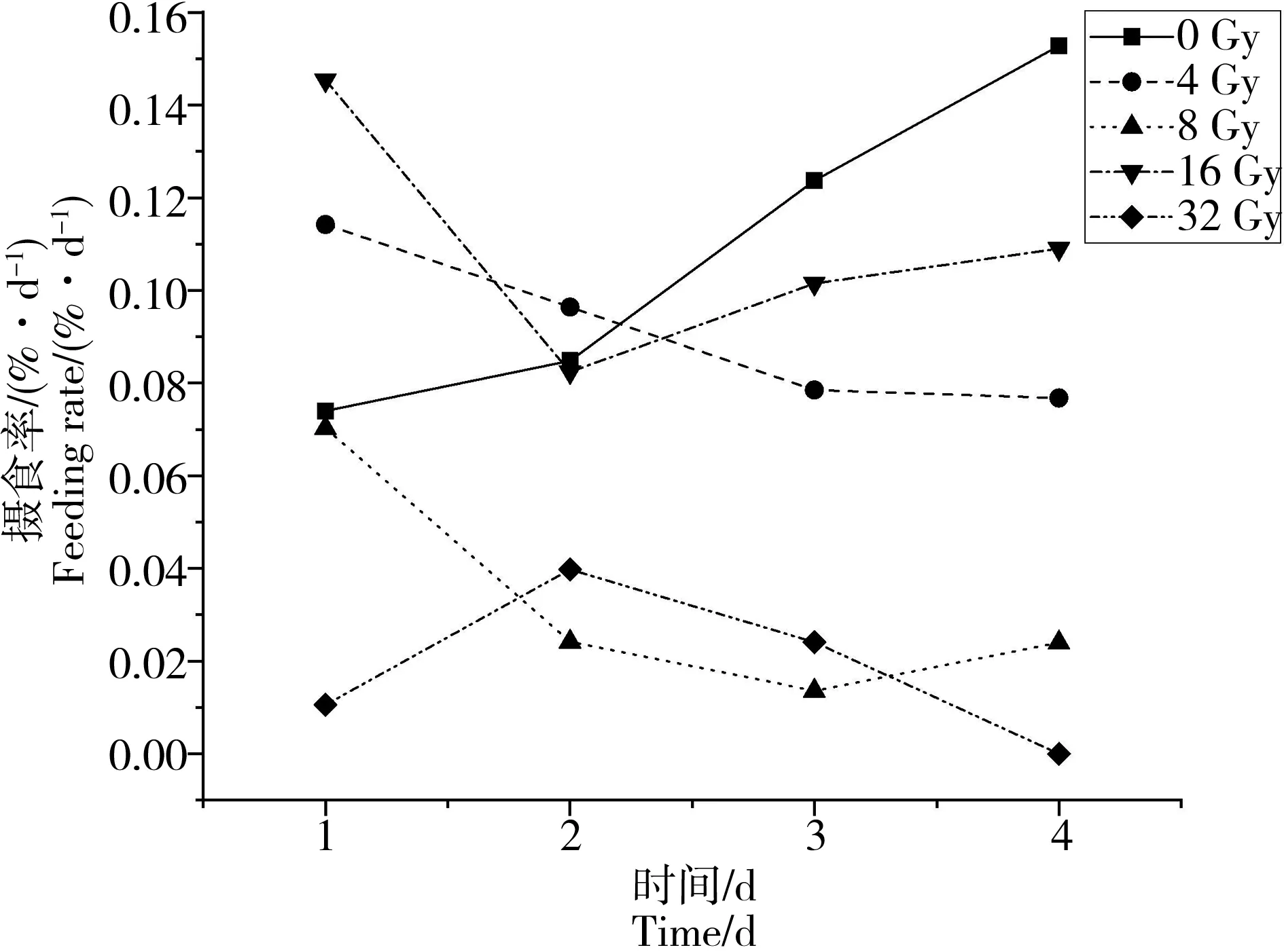
图3 60Co照射后大黄鱼幼鱼摄食率的变化Fig. 3 Feeding rate of juvenile Pseudosciaena crocea after irradiation with different dosages of 60Co
2.3.260Co射线照射后大黄鱼幼鱼肠道淀粉酶活性的变化
60Co射线外照射后的大黄鱼幼鱼肠道组织中淀粉酶活性的变化情况如图4a所示。与对照组相比,照射当天,各组之间差异不显著;照射后第1天和第4天,8 Gy、16 Gy和32 Gy辐照组大黄鱼幼鱼肠道淀粉酶活性略微低于对照组,但差异不显著;第7 天,各辐照组的淀粉酶活性均不同程度低于对照组。大黄鱼幼鱼照射后7 d内,4 Gy辐照组肠道淀粉酶活性基本保持稳定,但略微有所降低;8 Gy辐照组则表现为先缓慢降低,到第7天显著降低(P<0.05);16 Gy、32 Gy辐照组在辐射初期即显著降低(P<0.05),后一直保持较低活性水平。
2.3.360Co射线照射后大黄鱼幼鱼肠道胰蛋白酶活性的变化
60Co射线外照射后的大黄鱼幼鱼肠道组织中的胰蛋白酶活性的变化情况如图4b所示。与对照组相比,照射后7 d,各辐照组大黄鱼幼鱼肠道胰蛋白酶活性无显著差异;照射后第1天,4 Gy辐照组的肠道胰蛋白酶活性显著高于其他辐照组(P<0.05)。实验期间,全部辐照组大黄鱼幼鱼肠道胰蛋白酶活性随时间变化显著升高。
2.4 剂量和时间对大黄鱼幼鱼抗氧化指标以及消化酶的显著性影响
60Co射线照射后,对大黄鱼幼鱼肝脏SOD活性、GSH含量、T-AOC水平、MDA含量以及肠道组织中淀粉酶和胰蛋白酶活性在不同辐照剂量和时间的实验结果进行的双因素方差分析(见表2)。结果显示,剂量、时间因素对大黄鱼幼鱼肝脏SOD活性影响表现为显著(P<0.01、P<0.05),两因素交叉作用不显著(P>0.05);时间因素对大黄鱼幼鱼肝脏GSH含量、T-AOC水平、MDA含量影响显著(P<0.05),剂量、两因素交叉作用均不显著(P>0.05);时间因素对大黄鱼幼鱼肠道组织淀粉酶和胰蛋白酶活性的影响显著(P<0.05),剂量因素影响、两因素交叉作用均不显著(P>0.05)。
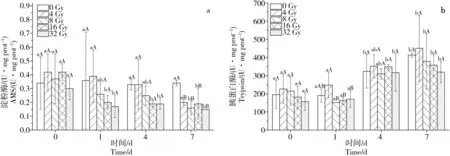
图4 60Co照射后大黄鱼幼鱼肠道组织淀粉酶(AMS)及胰蛋白酶(trypsin)含量变化注:大写字母表示与空白对照组的差异比较;小写字母表示同一组别不同时间的差异比较;P<0.05。Fig. 4 Amylase (AMS) and trypsin activities in juvenile Pseudosciaena crocea intestinal tissues after irradiation with different dosages of 60CoNote: The upper-case letters were compared with the blank control group; the lower-case letters were compared with the same group at different times; P<0.05.

表2 剂量、时间对大黄鱼幼鱼抗氧化指标及消化酶活性的显著性影响Table 2 Effects of time and dose on antioxidant indicators and digestive enzyme activities of juvenile Pseudosciaena crocea
注:P<0.01、P<0.05表示差异显著;P>0.05表示差异不显著。
Note:P<0.01,P<0.05 indicate that the difference is significant;P>0.05 indicates that the difference is not significant.
3 讨论(Discussion)
3.1 60Co射线对大黄鱼生长和存活的影响
电离辐射可以影响鱼类的存活与生长发育。本研究结果显示大黄鱼幼鱼的死亡率随剂量的升高而上升。有研究表明日本青鳉胚胎暴露在低剂量的电离辐射下,孵化后成鱼存活时间没有显著变化,随着剂量率上升,剂量为15 Gy时,孵化的日本青鳉与对照组相比死亡率明显上升[20-21]。本研究与上述研究结果相似,随着剂量的升高,电离辐射对鱼机体造成的损伤增加,鱼的存活时间减少,死亡率上升。另一方面,电离辐射在7 d的实验周期内对大黄鱼的体重体长以及器官指数的影响不显著,可能是由于7 d对于发育周期较长的大黄鱼来说过短,对体重、体长以及器官发育的影响无法显现出来,长时间周期下电离辐射对大黄鱼体重体长及器官指数可能会产生影响。
3.2 60Co射线对大黄鱼幼鱼的氧化损伤
电离辐射可以影响大黄鱼幼鱼肝脏的SOD活性,SOD是一种含金属离子的氧化还原酶,是清除体内有毒氧自由基的关键酶,其活力可在一定程度上反映出机体内氧自由基的代谢情况及抗氧化能力,在机体防御氧化损害过程以及保持机体内自由基代谢平衡中起着重要作用[16]。本研究结果显示低剂量(4 Gy)及中剂量(8 Gy、16 Gy)辐照组大黄鱼幼鱼肝脏的SOD活度都呈先上升后下降的趋势,低剂量辐照组长时间趋于正常,中剂量及高剂量(32 Gy)辐照组长时间都表现为损伤作用。司婧等[22]研究表明在1 Gy、3 Gy的低剂量的12C6+离子束照射下斑马鱼胚胎中SOD活性略微升高,而在7 Gy的高剂量照射下SOD活性显著降低(P<0.05)。周蓉等[23-24]的研究表明,在4 Gy的X射线照射下斑马鱼胚胎中SOD活性相比对照组显著下降(P<0.05);斑马鱼暴露在5 Gy、10 Gy、15 Gy剂量的12C6+离子束下,其眼睛中的SOD活性随时间呈先上升后下降的趋势。本研究与上述研究结果相似,说明低剂量的电离辐射会在短时间内刺激生物机体,激活机体的抗氧化系统,诱导机体合成大量的抗氧化剂,使机体的抗氧化酶活力升高;而大黄鱼幼鱼在高剂量照射后表现为损伤作用,说明高剂量辐照对生物机体产生过量的氧自由基,对机体造成了氧化损伤。
MDA是生物膜中的多种不饱和脂肪酸在氧自由基的攻击下形成的脂质过氧化产物,广泛应用于环境有毒物质的检测[25-26]。电离辐射也会改变大黄鱼幼鱼肝脏中MDA的含量,本研究结果显示电离辐射后所有辐照组大黄鱼幼鱼肝脏中MDA含量都呈先降低后升高的趋势,且这种趋势随剂量的升高而明显。司婧等[22]的研究表明暴露在3 Gy、7 Gy的12C6+离子束下斑马鱼胚胎中MDA含量显著高于对照组(P<0.05)。Gomes等[27]的研究发现一种大型溞(Daphniamagna)在10.7 mGy·h-1、42.9 mGy·h-1、106 mGy·h-1剂量率的60Co γ射线的照射下,其体内的脂质过氧化水平均随着剂量的增大而升高。周蓉等[24]的研究表明斑马鱼暴露在5 Gy、10 Gy、15 Gy的12C6+离子束下,其眼睛中的MDA含量显著升高,5 Gy、10 Gy剂量的照射下,斑马鱼眼睛中MDA含量到第7天时显著下降,而15 Gy没有显著下降。机体细胞受到自由基攻击时,细胞内的脂质会被大量降解产生MDA,其含量变化可反映机体脂质过氧化水平,从而进一步反映细胞受自由基攻击的程度。当机体处于低剂量的电离辐射胁迫时,体内的抗氧化机制被激活,产生了大量相关的酶类保护组织免受自由基攻击,MDA含量会维持在一个相对较低的水平。随着辐射剂量的增大,机体抗氧化机制遭到破坏,抗氧化酶活性降低,过量自由基损伤细胞,大量脂质过氧化,从而MDA含量增加[28]。本研究结果与之类似,辐射后大黄鱼体内氧自由基增加,辐射组大黄鱼体内出现了一定的脂质过氧化物,MDA含量辐照组相较于对照组有所升高;辐射后第1天,辐射诱导大黄鱼体内抗氧化酶清除氧自由基,阻止脂质过氧化,MDA含量减少;随着时间增长,受损伤的抗氧化系统无法清除过量的氧自由基,MDA含量有所增加;所有辐照组大黄鱼幼鱼肝脏内的MDA含量到第7天均表现随剂量的升高而升高,可能是由于高剂量的电离辐射对抗氧化机制的损伤更严重,进而产生更多的氧自由基使得脂质过氧化程度增加。本实验中,从MDA含量来看,机体的脂质过氧化水平随剂量的增加而上升。一般情况下MDA含量会随着SOD活性的升高而降低[29]。
GSH是体内一种重要的非酶性抗氧化物,具有清除自由基、解毒、促进铁质吸收及维持红细胞膜的完整性、维持脱氧核糖核酸的生物合成、维持细胞正常生长发育及细胞免疫等多种重要生理功能,GSH的多少是衡量机体抗氧化能力大小的重要因素[30]。本实验中,不同剂量辐照组GSH含量均呈先上升后下降的趋势,除4 Gy辐照组外其余辐照组长时间都表现为损伤作用。司婧等[22]的研究发现在7 Gy的12C6+照射下斑马鱼胚胎中GSH含量显著低于对照组。Heier等[18]的研究发现大西洋鲑在重金属Cu(10 μg·L-1)和γ电离辐射双重胁迫下,与只暴露在Cu(10 μg·L-1)的重金属下相比,双重压迫组肝脏的GSH要显著低于重金属组。而Olsvik等[31]的研究发现暴露在75 mGy剂量的γ电离辐射下的大西洋鲑肝脏中GSH-Px要显著高于对照组。本研究与上述研究结果类似,4 Gy、8 Gy及16 Gy辐照组短时间内GSH都有所上升,可能是由于一定电离辐射对GSH抗氧化系统有短暂的刺激效应,以消除体内辐射产生的氧自由基,但是高剂量的电离辐射会对机体抗氧化系统造成损伤,因此,8 Gy、16 Gy辐照组大黄鱼幼鱼肝脏内GSH含量在第7天低于对照组,32 Gy组始终低于对照组,可能是由于高剂量辐照后机体内产生过量的氧自由基,对机体造成了实质性的不可逆损伤。
在本实验中,辐照后大黄鱼肝脏的T-AOC表现为4 Gy辐照组初期显著刺激的作用,后缓慢降低至近似正常水平;其余辐照组在初期刺激机体略微高于对照组,长时间表现至略微低于正常水平。T-AOC水平反映机体各抗氧化物之间相互联系、相互协同作用的能力,其含量与机体的抗氧化能力和脂质过氧化间呈一定的相关性[32]。水生生物中对于T-AOC的研究较少,大多数研究都是关于哺乳动物,如小鼠等。邓海平等[28]的研究表明低剂量X射线照射刺激T-AOC水平的升高,高剂量会破坏小鼠的抗氧化系统,小鼠的T-AOC水平降低。本实验的研究结果与之相似,说明辐射在产生活性氧的同时,体内也会合成抗氧化酶进行修复,4 Gy辐射组表现为短时间的刺激作用,8 Gy、16 Gy、32 Gy剂量的辐射可能产生过量的氧自由基,损伤抗氧化系统,这与上述的SOD、MDA、GSH的结果类似,低剂量的电离辐射可短暂刺激机体,高剂量电离辐射可造成过氧化损伤。
3.3 60Co射线对大黄鱼幼鱼消化的影响
电离辐射对发育期的动物的影响是多方面的,高剂量的电离辐射会造成哺乳动物造血系统障碍和胃肠道黏膜紊乱、肠道组织损伤、肠道上皮粘膜脱落,影响其摄食与消化[28]。电离辐射对鱼类也可能造成此类型伤害,本实验同样观察到,在高剂量辐照组大黄鱼肠道壁变白、变薄至透明状,肠道内粘膜脱落、不消化、积水较多等胃肠道系统损伤等现象。Augustine等[33]的研究表明,斑马鱼(Daniorerio)暴露在84 nmol·L-1和420 nmol·L-1的贫铀(depleted uranium, DU)中会增加肠道上皮细胞的空泡化,损伤肠道组织,影响消化功能,高剂量比低剂量损伤更严重。本实验中,4 Gy剂量的照射对大黄鱼幼鱼肠道淀粉酶及肠道胰蛋白酶活性表现出一定的刺激作用,而其他剂量则表现出抑制作用。此外,本实验中大黄鱼白点病在不同辐照组的出现比例也可能是摄食率变化的原因之一。白点病是大黄鱼养殖种常见的一种寄生虫病害,实验养殖过程中虽已做好水体消毒、投喂药物等综合病害防治手段,但各组大黄鱼幼鱼有轻微的白点病症状。60Co照射后0~7 d,16 Gy和32 Gy辐照组大黄鱼白点病症状明显减轻或体表无明显特征,对照组和4 Gy、8 Gy辐照组仍有轻微的白点病症状且感染比例较高。据报道,白点病是大黄鱼养殖种常见的一种病害,会使大黄鱼的摄食量减少[34]。在γ射线照射后,16 Gy、32 Gy组的白点病症状明显减轻,32 Gy辐照组中大黄鱼胰腺组织以及肠道组织可能因剂量过高造成严重损伤,摄食率急剧下降,这与实验中死亡率及其他氧化损伤结果类似。另外,因胰蛋白酶结构与功能关系较为复杂,具有许多除营养消化功能外暂未研究清楚的生理功能,例如作为信号分子等[35],因此本研究中对大黄鱼受辐照后的胰蛋白酶活性的实验结果无显著规律,可能是多种因素共同作用下导致的。
综上所述:电离辐射的生物学效应研究日益受到人们的关注。本文研究结果发现,不同剂量的60Co γ射线外照射可引起大黄鱼幼鱼抗氧化系统及消化系统的显著变化,表现为低剂量外照射下一定程度的促进作用,中高剂量的抑制作用;并出现对大黄鱼幼鱼摄食率、死亡率的影响。因海洋生物电离辐射效应机制及环境影响因素复杂,要准确获得电离辐射水平与海洋生物的辐射剂量效应关系,需要后续更多的生物辐射响应机制的研究。
致谢:感谢自然资源部第三海洋研究所蔡福龙教授在实验过程中给予的帮助。

