海洋酸化与重金属、有机污染物和人工纳米颗粒的联合毒性效应研究进展
王昊,赵信国,陈碧鹃,夏斌,*,孙雪梅,朱琳,曲克明
1. 上海海洋大学海洋科学学院,上海 201306 2. 中国水产科学研究院黄海水产研究所 农业部海洋渔业资源可持续发展重点实验室 山东省渔业资源与生态环境重点实验室,青岛 266071 3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室,青岛 266237
自18世纪工业革命以来,在化石燃料燃烧等人类活动的影响下,大气CO2浓度不断增加,目前已达到409.65 ppm,增长了约45%。由于大气和海洋之间的气体交换作用,人类活动排放的CO2中约有1/3被海洋吸收,从而造成海水酸度的增大和碳酸盐平衡体系的变化,即“海洋酸化”现象(Ocean Acidification)[1-2]。当前表层海水的pH值为8.1~8.2,根据政府间气候变化专门委员会(Intergovernmental Panel on Climate Change, IPCC)的预测,到2100年,表层海水pH值将下降至7.8~7.7;到2300年,表层海水pH值将下降至7.4~7.3[1,3-4]。海洋酸化势必会引起海洋环境的变化,直接影响到海洋生物赖以生存的环境条件,严重威胁海洋生态系统的安全与稳定[5]。
随着全球经济的高速发展,大量的污染物(重金属、有机污染物和人工纳米材料等)不断进入到海洋环境中。重金属作为一类海洋环境中常见的污染物,在沿海、河口以及沉积物中高浓度富集。Cu、Pb等是许多沿海与河口的水体和沉积物中最常见的重金属污染物[6],可以在海洋生物的脂肪组织中发生累积,并通过食物链的营养传递对人类健康产生潜在的危害[7]。溢油事故的频繁爆发及农药化肥的不合理使用,使得大量有机污染物最终汇入海洋,对海洋生态系统造成严重威胁[8]。进入21世纪以来,随着纳米技术的迅猛发展,纳米材料在工业、能源、医疗和消费品中得到了广泛的应用[9],不可避免地导致大量人工纳米颗粒(engineered nanoparticles, NPs)通过地表径流、意外泄露等方式进入到海洋环境中,从而对海洋环境造成潜在的风险[10]。已经有越来越多的研究表明NPs会对浮游植物、浮游动物、游泳动物、底栖生物等产生毒性效应[11]。
海洋酸化与环境污染物(重金属、有机污染物和NPs等)已成为全球海洋生态系统面临的重大环境问题,它们同时存在,共同影响着海洋生态系统(图1)。研究表明海洋酸化会改变污染物的环境行为,如改变重金属离子的存在价态[12],抑制有机污染物的降解[13],改变人工纳米颗粒的悬浮性和离子释放能力[14],从而影响污染物对海洋生物的毒性效应(图2)。本文回顾了海洋酸化的生态效应以及重金属、有机污染物和NPs对海洋生物的毒性效应,重点分析了海洋酸化对污染物环境行为的影响及产生的联合毒性效应,对近年来的相关报道进行了总结归纳(表1),指出了当前研究的特点和不足,并对未来的研究进行了展望。
1 海洋酸化对海洋生物的影响(The impact of ocean acidification on marine life)
海洋酸化引起的海水化学参数变化对从自养生物到顶级捕食者的所有营养水平的生物都有影响,主要有:(1)大型藻:海水中无机碳浓度和形态的变化会影响大型藻光合作用的速率,并改变其群落结构[38]。已有研究表明,在碳酸盐饱和度较低的状态下,夏威夷常见的壳状珊瑚藻的钙化率有所下降[39];(2)浮游植物:海洋酸化会导致钙化浮游植物赫氏颗石藻(Emilianiahuxleyi)的钙化量下降,遭受紫外线辐射的损害增加,威胁钙化浮游植物的生存[40];而对于非钙化浮游植物三角褐指藻(Phaeodactylumtricornutum),海洋酸化可降低其耐受高光胁迫的能力,加大光抑制,且增加其呼吸作用[41];(3)浮游动物:海洋酸化会延迟哲水蚤(Calanusglacialis)的孵化时间,并降低其孵化率[42]。海洋酸化会对日本虎斑猛水蚤(Tigriopusjaponicus)产生氧化胁迫,继而对细胞生物大分子造成氧化损伤,最终影响其发育和繁殖力[43];(4)双壳贝类:海洋酸化会阻碍贝类生物壳体和碳酸钙骨架的生长,还会严重影响壳体和碳酸钙骨架的内部晶体结构,甚至引起壳体和碳酸钙骨架的消融[44-45]。海洋酸化可以降低栉孔扇贝(Chlamysfarreri)的钙化率和呼吸作用[46],显著抑制紫贻贝(Mytilusedulis)碳酸酐酶活性和贝壳的生长速率[47];(5)鱼类:由于鱼类早期阶段鳃等器官发育不完善,pH调节能力差[48],所以海洋酸化会导致鱼类体液的pH值迅速下降,从而对鱼类精子和卵子以及胚胎的发育具有较大的影响[49]。此外,海洋酸化对鱼类的嗅觉、化学感觉和听觉等产生不同程度的影响[50-51],进而会影响鱼类的洄游、摄食和繁殖等生理行为。

表1 海洋酸化与重金属、有机污染物和NPs的联合毒性Table 1 The interactions between ocean acidification and environmental pollutants
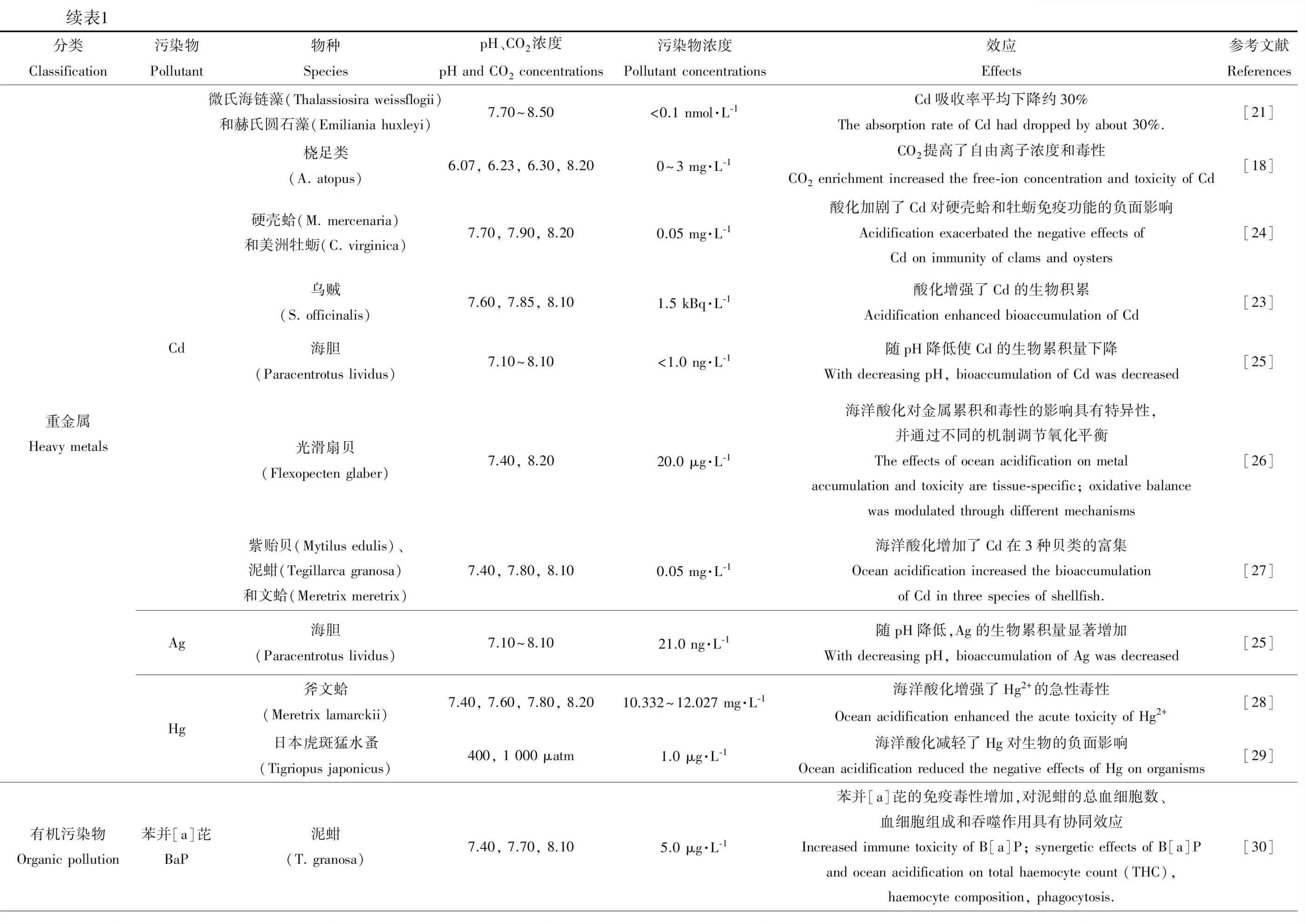
续表1分类Classification污染物Pollutant物种SpeciespH、CO2浓度pH and CO2 concentrations污染物浓度Pollutant concentrations效应Effects参考文献References重金属Heavy metalsCdAgHg微氏海链藻(Thalassiosira weissflogii)和赫氏圆石藻(Emiliania huxleyi)7.70~8.50<0.1 nmol·L-1Cd吸收率平均下降约30%The absorption rate of Cd had dropped by about 30%.[21]桡足类(A. atopus)6.07, 6.23, 6.30, 8.200~3 mg·L-1CO2提高了自由离子浓度和毒性CO2 enrichment increased the free-ion concentration and toxicity of Cd[18]硬壳蛤(M. mercenaria)和美洲牡蛎(C. virginica)7.70, 7.90, 8.200.05 mg·L-1酸化加剧了Cd对硬壳蛤和牡蛎免疫功能的负面影响Acidification exacerbated the negative effects of Cd on immunity of clams and oysters[24]乌贼(S. officinalis)7.60, 7.85, 8.101.5 kBq·L-1酸化增强了Cd的生物积累Acidification enhanced bioaccumulation of Cd[23]海胆(Paracentrotus lividus)7.10~8.10<1.0 ng·L-1随pH降低使Cd的生物累积量下降With decreasing pH, bioaccumulation of Cd was decreased[25]光滑扇贝(Flexopecten glaber)7.40, 8.2020.0 μg·L-1海洋酸化对金属累积和毒性的影响具有特异性,并通过不同的机制调节氧化平衡The effects of ocean acidification on metal accumulation and toxicity are tissue-specific; oxidative balance was modulated through different mechanisms[26]紫贻贝(Mytilus edulis)、泥蚶(Tegillarca granosa)和文蛤(Meretrix meretrix)7.40, 7.80, 8.100.05 mg·L-1海洋酸化增加了Cd在3种贝类的富集Ocean acidification increased the bioaccumulation of Cd in three species of shellfish.[27]海胆(Paracentrotus lividus)7.10~8.1021.0 ng·L-1随pH降低,Ag的生物累积量显著增加With decreasing pH, bioaccumulation of Ag was decreased[25]斧文蛤(Meretrix lamarckii)7.40, 7.60, 7.80, 8.2010.332~12.027 mg·L-1海洋酸化增强了Hg2+的急性毒性Ocean acidification enhanced the acute toxicity of Hg2+[28]日本虎斑猛水蚤(Tigriopus japonicus)400, 1 000 μatm1.0 μg·L-1海洋酸化减轻了Hg对生物的负面影响Ocean acidification reduced the negative effects of Hg on organisms[29]有机污染物Organic pollution苯并[a]芘BaP泥蚶(T. granosa)7.40, 7.70, 8.105.0 μg·L-1苯并[a]芘的免疫毒性增加,对泥蚶的总血细胞数、血细胞组成和吞噬作用具有协同效应Increased immune toxicity of B[a]P; synergetic effects of B[a]P and ocean acidification on total haemocyte count (THC), haemocyte composition, phagocytosis.[30]
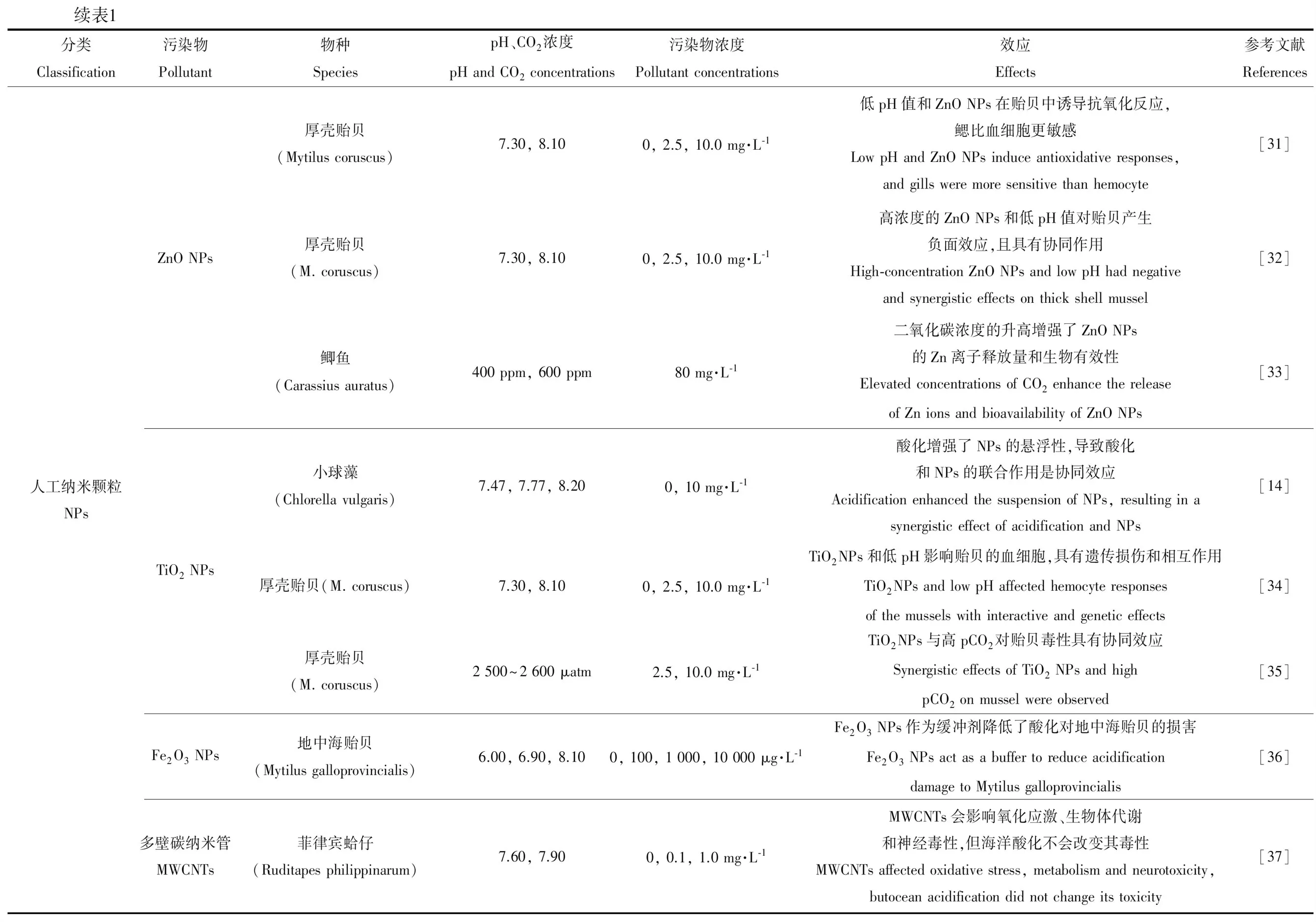
续表1分类Classification污染物Pollutant物种SpeciespH、CO2浓度pH and CO2 concentrations污染物浓度Pollutant concentrations效应Effects参考文献References人工纳米颗粒NPsZnO NPsTiO2 NPsFe2O3 NPs多壁碳纳米管MWCNTs厚壳贻贝(Mytilus coruscus)7.30, 8.100, 2.5, 10.0 mg·L-1低pH值和ZnO NPs在贻贝中诱导抗氧化反应,鳃比血细胞更敏感Low pH and ZnO NPs induce antioxidative responses, and gills were more sensitive than hemocyte[31]厚壳贻贝(M. coruscus)7.30, 8.100, 2.5, 10.0 mg·L-1高浓度的ZnO NPs和低pH值对贻贝产生负面效应,且具有协同作用High-concentration ZnO NPs and low pH had negative and synergistic effects on thick shell mussel[32]鲫鱼(Carassius auratus)400 ppm, 600 ppm80 mg·L-1二氧化碳浓度的升高增强了ZnO NPs的Zn离子释放量和生物有效性Elevated concentrations of CO2 enhance the release of Zn ions and bioavailability of ZnO NPs[33]小球藻(Chlorella vulgaris)7.47, 7.77, 8.200, 10 mg·L-1酸化增强了NPs的悬浮性,导致酸化和NPs的联合作用是协同效应Acidification enhanced the suspension of NPs, resulting in a synergistic effect of acidification and NPs[14]厚壳贻贝(M. coruscus)7.30, 8.100, 2.5, 10.0 mg·L-1TiO2 NPs和低pH影响贻贝的血细胞,具有遗传损伤和相互作用TiO2 NPs and low pH affected hemocyte responses of the mussels with interactive and genetic effects[34]厚壳贻贝(M. coruscus)2 500~2 600 μatm2.5, 10.0 mg·L-1TiO2 NPs与高pCO2对贻贝毒性具有协同效应Synergistic effects of TiO2 NPs and high pCO2 on mussel were observed[35]地中海贻贝(Mytilus galloprovincialis)6.00, 6.90, 8.100, 100, 1 000, 10 000 μg·L-1Fe2O3 NPs作为缓冲剂降低了酸化对地中海贻贝的损害Fe2O3 NPs act as a buffer to reduce acidification damage to Mytilus galloprovincialis[36]菲律宾蛤仔(Ruditapes philippinarum)7.60, 7.900, 0.1, 1.0 mg·L-1MWCNTs会影响氧化应激、生物体代谢和神经毒性,但海洋酸化不会改变其毒性MWCNTs affected oxidative stress, metabolism and neurotoxicity, butocean acidification did not change its toxicity[37]
注:LC50表示半致死浓度;ATP表示三磷酸腺苷;ADP表示二磷酸腺苷;AMP表示一磷酸腺苷。
Note: LC50is median lethal concentration; ATP is adenosine triphosphate; ADP is adenosine diphosphate; AMP is adenosine monophosphate.
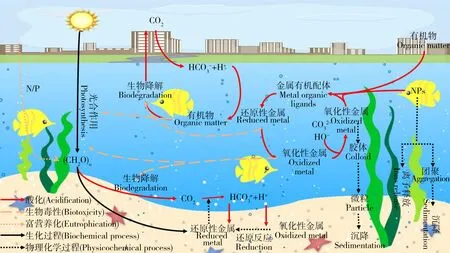
图1 海洋酸化与环境污染物重金属、有机污染物和人工纳米颗粒(NPs)的相互作用注:根据参考文献[15]改编。Fig. 1 Interactions between ocean acidification and heavy metals, organic pollutants and engineered nanoparticles (NPs)Note: Adapt according to reference [15].
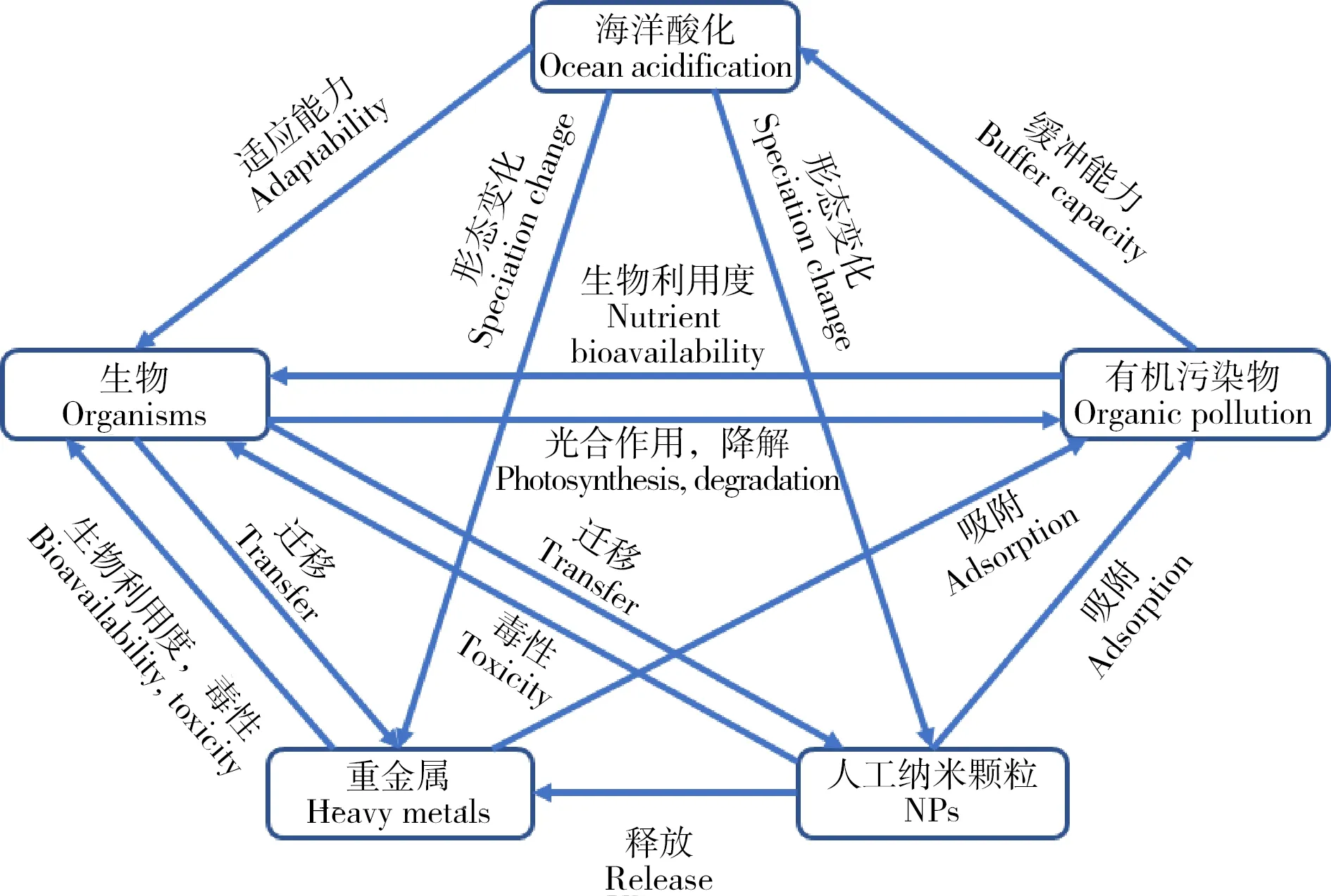
图2 重金属、有机污染物、NPs和海洋酸化的相互作用机制注:根据参考文献[15]改编。Fig. 2 Interactive mechanisms of ocean acidification with heavy metals, organic pollutants and engineered nanoparticlesNote: Adapt according to reference [15].
综上所述,不同营养级的生物个体对海洋酸化表现出不同的生理响应,长此以往会对海洋生态系统的平衡及对人类的服务功能产生影响[52]。
2 海洋酸化与重金属的联合毒性(Combined toxicity of ocean acidification and heavy metals)
2.1 重金属对海洋生物的毒性效应
重金属是海洋环境中最常见的污染物之一,主要是通过大气输入、陆源径流、工业倾倒等方式进入海洋环境中,在许多近岸与河口的水体和沉积物中浓度较高[53-54]。一些金属(如Cu和Zn)是许多生化过程中不可缺少的辅助因子,但是当金属含量累积一定浓度时便会对生物体产生毒害作用:(1)大型藻:Han等[55]报道当Cu2+浓度达到25和100 μg·L-1时能分别抑制绿藻Ulvaarmoricana和Ulvapertusa的生长,当达到250 μg·L-1时2种藻Chl-a和Chl-b的含量均显著降低;李钦等[56]研究发现,坛紫菜(Porphyrahaitanensis)叶状体DNA、RNA含量和过氧化物酶(POD)活性随Cu2+暴露剂量的增加表现出先上升后下降的时间效应关系。所以,重金属主要是通过抑制藻细胞分裂、减少光合色素含量、降低光合放氧率、产生活性氧自由基(ROS)导致细胞氧化损伤和脂质过氧化等方式来影响藻类的生长发育过程[55-56];(2)浮游植物:低浓度的重金属胁迫能刺激浮游植物的生长,表现出明显的毒性兴奋效应[57],高浓度时则能有效抑制其生长[58-59]。有研究表明,Cu2+胁迫能导致浮游植物体内代谢作用受阻,淀粉类物质消失,还可以通过干扰营养盐代谢以及光合作用等对海洋浮游植物的生长产生影响[60];Hadjoudja等[61]研究证实,随着Cu2+浓度的增加,铜绿微囊藻(Microcystisaeruginosa)和小球藻(Chlorellavulgaris)的细胞分裂率和自发荧光均减少,并且暴露时间的不同,其敏感性也有显著差异;(3)浮游动物:浮游动物积累的重金属相当一部分是吸附在甲壳表面的,在冠伪镖水蚤(Pseudodiaptomuscoronatus)甲壳上的吸附量高达40%~50%,当重金属从体表转入体内后才会表现出毒性效应[62];海洋桡足类汤氏纺锤水蚤(Acaritatonsa)和哈氏纺锤水蚤(Acartiahudsonica)在溶解态Ag的作用下有急性致死效应,并且会导致其产卵量下降[63];高浓度的Cu和Cd会使中华哲水蚤(Calanussinicus)氨基酸含量下降,同时也抑制其摄食和排泄[64-65];(4)双壳贝类:蒋国萍等[28]研究了海洋酸化条件下Cd2+和Hg2+对斧文蛤(Meretrixlamarckii)幼贝急性毒性效应的影响,发现单一的海洋酸化对斧文蛤幼贝的存活没有显著性影响,但是海洋酸化显著增强了Cd2+和Hg2+的急性毒性;李玉环等[66]研究了Cd对海湾扇贝(Argopectenirradiams)的急性毒性影响,结果表明Cd2+对海湾扇贝是剧毒性的毒物,随着浓度的升高,海湾扇贝会对Cd2+的毒性更加敏感;Shi等[27]研究发现,海洋酸化增加了Cd在紫贻贝、泥蚶(Tegillarcagranosa)和文蛤(Meretrixmeretrix)中的富集;周一兵等[67]的研究显示,Hg、Cu、Zn这3种重金属及其不同组合的联合作用都会对菲律宾蛤仔(Ruditopesphiliprinatum)的耗氧率、排氨率及氧氮比值产生明显的影响;(5)鱼类:水体中的重金属在鱼类肾脏、肌肉等不同组织中不断蓄积,最终可以使鱼类发育畸形甚至中毒死亡。陈其晨等[68]的研究表明Zn在鱼体中最容易蓄积,其次为Cu、Pb、Cd,从重金属在鱼体内不同组织的分布分析,以肾、肝、脾等部位的含量居高,肌肉、骨骼等部位则较低;同时,重金属还会对鱼类生殖细胞、胚胎、仔鱼等不同生命阶段的发育、存活和生长产生负面影响,从而降低子代的数量和质量[69]。
2.2 海洋酸化对重金属环境行为的影响
海洋酸化对重金属环境行为的影响主要归结为3个方面:
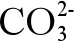
(2)海洋酸化影响重金属的氧化还原反应。pH的变化也影响金属的氧化和还原速率,通常,酸化对还原速率的提升高于氧化速率,因为后者对pH的依赖性较小。例如,当pH从8.1降至7.4时,海水中Fe半衰期从1 min增加到24 min[12],这说明海洋酸化可以增加还原态金属的量[71]。
(3)海洋酸化影响与沉积物结合的金属的行为。海洋酸化可以间接改变底泥沉积物的条件和性质,影响来自受污染沉积物的金属通量,从而引起沉积物和海水界面主要微量元素的地球化学通量变化[72]。pH和氧化还原电位(Eh)降低可能会影响氧化还原敏感性元素的溶解度,对海洋生态系统产生负面影响[73]。
2.3 海洋酸化对重金属生物毒性的影响
海洋酸化可以将重金属转化为对生物毒性更强的形态,影响海洋生物中金属的毒性和累积及其在细胞内的结合[19]。建模研究预测,由于海洋pH值的下降,在未来100年内,河口的平均Cu2+浓度可能会增加115%[74]。已经有研究表明,Cu2+浓度为6.4×10-8mg·L-1便会对海洋浮游植物产生毒性,当pH降低时,Cu毒性将影响浮游植物的生长[75]。Nardi等[26]研究发现,相对于海洋酸化或Cd单独暴露,光滑扇贝(Flexopectenglaber)暴露于低pH和Cd联合作用的条件下其组织中Cd的浓度增加,并且联合作用对扇贝的生物学毒性具有协同效应;Pascal等[18]研究也发现二氧化碳分压(pCO2)升高,pH降低,增加了Cu2+浓度,进而导致其对桡足类Amphiascoidesatopus的毒性增强,同时,海洋酸化增强了Cu对沙蚕精子的DNA损伤,对幼体成活率抑制存在协同作用[19]。
海洋酸化的酸化程度会影响重金属的毒性效应。海洋酸化会对石莼的生理性能产生一定的影响,pCO2浓度为1 000 μatm时会降低Cu对石莼(Ulvaprolifera)的毒性,而当pCO2增加到1 400 μatm时,Cu对石莼的毒性则会增强,这主要是因为当pCO2浓度为1 000 μatm时,H+和Cu2+的胞外竞争使得海洋酸化与重金属出现了拮抗作用[16,76];Xu等[21]研究发现当CO2浓度升高使pH从8.5降至7.9或7.7时,浮游植物对Zn和Cd富集量平均下降约30%,从而影响其生长;通过对不同酸化条件下Zn对浮游植物半效应浓度(EC50)值影响研究发现,当pH为6.0时测得的EC50值最低,这说明随着pH的降低,Zn对浮游植物的毒性增加[22]。
不同的重金属在环境中的存在状态也不同,所以海洋酸化对重金属的毒性的影响也有一定的差异。Dorey等[25]研究了海洋酸化与放射性重金属对地中海海胆幼体的影响,发现CO2导致的pH值变化可以改变海胆(Paracentrotuslividus)幼虫体内重金属的生物积累速率。而且由于重金属的种类不同,会导致其对生物体的累积效应不同;韦晓慧等[17]研究了海洋酸化条件下Cu、Cd对日本虎斑猛水蚤的急性毒性效应,发现随着海水pH值降低,Cu和Cd对日本虎斑猛水蚤的96 h半致死浓度(LC50)都呈减小趋势,但是在海洋酸化条件下Cu与Cd相比,其急性毒性效应更加显著,这是因为Cd2+在海洋中常形成氯复合物,而Cl-对pH的变化不敏感,Cu2+在海洋中常形成碳酸盐复合物,对海洋酸化敏感,随pH值下降释放更多的游离Cu2+,游离Cu2+的毒性要远远高于复合物形态;Wang等[29]研究发现,海洋酸化显著降低了每一代日本虎斑猛水蚤中的Hg生物积累,而且每一代的生殖抑制作用都会明显逐渐减弱,这是因为Hg可以与氯化物形成强复合物,并且其浓度不会受到海水pH降低的影响。因此,重金属的种类不同会导致其在海洋酸化条件下出现不同的差异[19]。
海洋酸化还会以物种特异性方式改变金属对生物体的生理后果,最终影响其适应性和生存性。Ivanina等[24]发现pCO2升高与Cd联合作用导致硬壳蛤(Mercenariamercenaria)和美洲牡蛎(Crassostreavirginica)血细胞中吞噬活性、粘附能力以及凝集素和热休克蛋白(HSP70)的mRNA表达降低,从而使生物体对病原体和致病菌敏感性增强。CO2浓度升高不会影响硬壳蛤和牡蛎中的蛋白酶和和能量储存,而且还有可能减轻微量金属对这些生物细胞的负面影响,但是CO2浓度升高会影响Cd和Cu对海洋双壳类的毒性,这是由于CO2浓度升高时Cu和Cd的积累增加以及高碳酸盐和金属联合胁迫对能量状态的负面影响,并可能影响双壳类群体的健康以及受污染河口的金属营养转移[20]。
3 海洋酸化与有机污染物的联合毒性(Combined toxicity of ocean acidification and organic pollutants)
3.1 有机污染物对海洋生物的毒性效应
有机污染是世界上最普遍的污染类型之一,也是驱动海洋生态系统变化的主要人为因素。环境中的持久性有机污染物(POPs)具有长期残留性、生物蓄积性、半挥发性和高毒性等特征,会对海洋生物产生不利的影响:(1)浮游植物:Huang等[77]研究发现,高浓度的石油污染降低了浮游植物的叶绿素a含量和细胞密度,极大抑制了其生长;研究表明当全氟辛烷磺酸盐(PFOS)的浓度高于50 mg·L-1时,羊角月牙藻(Selenastrumcapricornutum)和小球藻的生长会被明显抑制[78]。Bopp等[79]的研究发现,多环芳烃(PAHs)可以影响假微型海链藻(Thalassiosirapseudonana)的脂肪酸代谢和二氧化硅壳层的形成;(2)双壳贝类:当有机污染物被生物机体吸收后,在双壳软体动物体内会产生一系列的生物化学反应,并产生大量的ROS,从而产生氧化损伤[80]。蔡文贵等[81]通过研究邻苯二甲酸二乙基己酯(DEHP)对翡翠贻贝(Pernaviridis)生化指标的影响,发现DEHP可以影响翡翠贻贝的内脏和外套膜抗氧化防御系统酶,并且短期内无法消除;(3)鱼类:丛伟[82]研究了PAHs对海洋鱼类胚胎发育的神经毒性,发现苯并[a]芘能引起仔鱼出现一系列异常症状并诱导CYPIA与AHR2的表达。采用三环的菲(PHE)暴露后,雄性褐菖鲉鱼(Sebastiscusmarmoratus)性体比指数和精子比例随着浓度升高呈现U形曲线变化,同时还会抑制雌性黑点青鳉(Oryziasmelastigma)卵巢发育,产卵频率和产卵数量均减少,影响卵子质量和F1代胚胎发育心率的异常,降低F1代仔鱼的出膜率和出膜后的正常游动[83]。
3.2 海洋酸化对有机污染物降解的影响
海洋酸化会改变金属形态及其生物有效性,进而影响有机污染物的降解(图2)。Fe是降解碳氢化合物的重要因素,它可能会影响有机污染物的催化和油类氧化分解所需的酶活性[84]。在恶劣条件下,几种关键酶在以Fe作为限制条件下会导致芳烃甲苯降解的活性降低[85-86]。Shi等[87]预测,到2100年的pCO2水平可能会将生物学上可用的Fe3+降低10%~20%,这可能是由于pH降低引起的Fe与有机配体的结合。因此,海洋酸化而导致Fe的生物利用度下降会间接对有机污染物的降解产生潜在的影响。
氮是促进PAHs和其他有机污染物降解的关键因素[87]。作为海洋中最重要的氮源之一,固定氮是限制光合生物生长的营养物质,对于藻类和海洋细菌来说,固定氮是海洋细菌和古细菌的能源或氧化剂[21],海洋酸化降低了在海洋模型中蓝藻主导的N2固定的效率[21,87],从而影响了PAHs和其他有机污染物的降解。此外,随着NH3底物从体系中消失,硝化速率可以在pH为6.0~6.5时下降至零[88],也会对有机污染物的降解产生影响。据报道,大气CO2升高导致海洋含氧量下降。O2既是微生物降解有机物中最重要的元素之一,也是有机物初始分解所必需的,与正常情况相比较,较低的含氧量降低了微生物活性,导致降解率降低甚至厌氧降解[89]。
3.3 海洋酸化对有机污染物毒性的影响
海洋中的有机污染物可以被胶体有机物质吸收或结合并固定在有机金属矿物复合物中,超过50%的有机质被约束在海洋的有机金属矿物复合物中[90]。海洋酸化引起的金属离子溶解可能会破坏有机金属配合物,从而增强有机污染物的释放和毒性。同时由于酸化会抑制有机污染物的生物降解,导致有机污染物长期存在于海洋环境中[89,91]。在无脊椎动物中的研究表明,海洋酸化和苯并[a]芘均可诱导长牡蛎(Crassostreagigas)血细胞凋亡,因此可能导致总血细胞数减少和血细胞组成改变[92-93]。Su等[30]研究发现,在海洋酸化条件下,苯并[a]芘的免疫毒性增加导致文蛤总血细胞减少、血细胞组成发生改变以及吞噬作用受阻,这表明海洋酸化与苯并[a]芘具有协同作用。在pCO2升高的压力下,海洋生物可能改变能量分布,并为基础代谢和体内调节等关键生命过程分配更多能量[94]。因此在未来海洋酸化条件下,可用于污染物防御和处理能量的减少也可导致苯并[a]芘增加生物体的免疫毒性。此外,海洋酸化可能损害海洋生物的表皮组织,从而导致更多的有机污染物如苯并[a]芘富集到海洋生物体内,增强对海洋生物的毒性效应[27,95]。
4 海洋酸化与NPs的联合毒性(Combined toxicity of ocean acidification and engineered nanoparticles)
4.1 NPs对海洋生物的毒性效应
纳米材料的大量生产和广泛应用势必会导致大量NPs进入到海洋环境中,进而对海洋生物产生毒性效应:(1)浮游植物:NPs对浮游植物的影响与其材质,粒径和浮游植物的种类有关。ZnO NPs (≥10 mg·L-1)会显著抑制硅藻(角毛藻和海链藻)的生长,并在海链藻中发生明显富集[96]。TiO2NPs可以进入到正常新月菱形藻(Nitzschiaclosterium)的细胞内,对藻细胞产生氧化损伤,导致微藻脂质过氧化,影响藻细胞膜的稳定性。胞内ROS是TiO2NPs对海洋微藻产生氧化损伤的主导因素[97];(2)浮游动物:浮游动物营悬浮生活,这一生活习性决定其很容易受到悬浮NPs的影响。浮游动物在摄食时能够同时过滤大量的海水,这就可能导致大量的NPs进入到浮游动物体内,对浮游动物的正常生长造成影响。Snell和Hicks[98]报道经过2 d暴露后,聚苯乙烯NPs(≥83 nm)主要富集在臂尾轮虫(Brachionusmanjavacas)的胃和肠部,而37 nm聚苯乙烯NPs可以穿过轮虫的肠壁孔径富集到生物的不同组织。这表明粒径是影响轮虫对NPs吸收的重要因素,并会因此产生不同的毒性效应;(3)双壳贝类:Shi等[99]研究了泥蚶暴露于TiO2NPs环境浓度的免疫毒性,结果表明在浓度为10和100 mg·L-1的TiO2NPs暴露30 d后,血细胞总数、吞噬活性和红细胞比例都显著降低。此外,当暴露于高浓度的TiO2NPs时,泥蚶体内神经递质浓度显著增加,并且抑制乙酰胆碱酯酶(AChE)活性和下调神经递质相关基因的表达,这表明TiO2NPs对泥蚶具有神经毒性[100]。Canesi等[101]发现,当TiO2NPs浓度为1~10 mg·L-1时可对贻贝引起毒性作用。厚壳贻贝(Mytiluscoruscus)暴露在TiO2NPs中会导致其粘液中吸附大量的TiO2NPs,这可能会影响贻贝的呼吸[34]。CuO NPs进入水体中可以释放一定量的Cu2+,纳米材料和其释放的Cu2+均能够对栉孔扇贝的血细胞造成一定的损伤[102];(4)鱼类:Cong等[103]研究了ZnO NPs对黑点青鳉的胚胎毒性,结果表明,暴露20 d后,黑点青鳉胚胎的死亡率和心率增加,孵化率降低,孵化时间增长,畸形率增加。此外,ZnO NPs对黑点青鳉死亡率和心率的影响要大于释放的Zn2+,这表明ZnO NPs的毒性主要来自尺寸效应。Vignardi等[104]报道了鲳鲹(Trachinotuscarolinus)对TiO2NPs的富集以及NPs产生的基因毒性和细胞毒性,结果表明,NPs主要富集在生物体的肝脏、肾脏和鳃部,少量进入到肌肉部位,并且NPs会对生物产生DNA损伤,降低红细胞数量。
4.2 海洋酸化对NPs环境行为的影响
NPs进入海洋环境后,会发生一系列复杂的物理化学过程(团聚、溶解以及生物转化等)。NPs的悬浮性能以及离子释放能力与海水环境介质参数(pH、离子强度和天然有机物等)紧密相关。海洋酸化对NPs环境行为的影响主要有:
(1)NPs的悬浮性。当纳米胶体颗粒粒径<100 nm时,由于布朗运动而导致胶体颗粒物之间碰撞并在短时间内发生团聚。随着团聚体尺寸越来越大,其扩散系数变得越来越小,团聚速度逐渐变慢,最后达到平衡状态。此外,在海洋环境中,由于海水的高离子强度,NPs更易于发生团聚,而pH等条件对NPs的悬浮性能有着很大的影响[35]。有研究表明在pH=7.77和pH=7.47的海水中TiO2NPs的水力直径要小于在pH=8.20的海水中,分散性增强,这表明海洋酸化能够抑制TiO2NPs的团聚,增强其悬浮性能[14]。Mohd Omar等[105]研究发现,当pH小于等电点时,随着pH的升高,NPs的团聚程度逐渐增大。当pH等于等电点的时候NPs团聚程度最大。当pH大于等电点时,NPs随pH的增加而开始分散。所以当海洋酸化导致pH降低时,NPs的悬浮稳定性会发生变化。
(2)金属NPs的离子释放能力。海洋酸化可以导致pH下降,进而改变金属NPs的离子释放能力。Zhao等[106]的研究发现pH值变化促进了Cu NPs的离子释放(公式1),在对ZnO和CuO NPs的研究中发现,pH值可以改变ZnO和CuO NPs的物理化学性质,在海洋酸化条件下,海水中CO2浓度升高,导致海水中H+增加、pH降低,进而导致公式1向右移动,使得Zn2+和Cu2+的释放量增加。但是有研究表明,当pH大于7时,ZnO NPs在较高pH条件下的溶解度较低,这可能是由于高pH条件下在ZnO NPs表面形成了氢氧化物层,从而抑制了其在碱性环境下的溶解(公式2)[33,103,107]。已有研究表明,金属NPs的离子释放是导致其产生毒性的主要原因之一,因此研究海洋酸化对金属NPs离子释放能力的影响十分必要[108-109]。
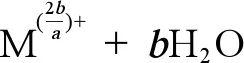
(1)
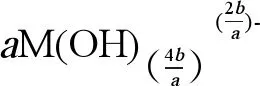
(2)
4.3 海洋酸化对NPs毒性效应的影响
NPs的毒性效应一般可以分为2种,即直接毒性效应和间接毒性效应。前者是指NPs本身物理性质(尺寸、形状、电荷等)产生的毒性反应,而后者是指由于NPs的其他特性,如金属NPs能够溶解产生离子对生物造成的毒性效应。因此,一方面海洋酸化通过促进NPs的分散,增强其悬浮性能,减弱其在海水中的团聚,从而使其作用于生物体的NPs的水力直径减小,增强其毒性效应。Xia等[14]的研究发现,海洋酸化增强了TiO2NPs对小球藻生长的抑制作用,同时增加了TiO2NPs对藻细胞的氧化损伤,这是因为海水pH降低使TiO2NPs在海水中的水力直径减小,悬浮性能增强,从而导致藻细胞中富集的TiO2NPs含量升高,进而增强了TiO2NPs对藻类的毒性效应。Huang等[34]研究了海洋酸化条件下TiO2NPs对厚壳贻贝血细胞免疫参数的综合效应,结果表明海洋酸化与TiO2NPs联合作用会使厚壳贻贝血细胞功能受损,血细胞死亡数和ROS升高,并且海洋酸化与高剂量的TiO2NPs(10 mg·L-1)对厚壳贻贝存在协同作用;Hu等[35]也发现海洋酸化条件下TiO2NPs对厚壳贻贝的生理功能的损害增大。但是海洋酸化条件下TiO2NPs对贝类毒性增强的原因未作探讨。另一方面,海洋酸化促进了金属NPs的离子释放,从而增强了NPs的毒性效应。Yin等[33]研究发现,CO2升高使pH值降低,ZnO NPs在水中释放Zn离子量是升高,增加了鲫鱼(Carassiusauratus)肝脏、脑和肌肉中Zn的富集含量,从而增强了ZnO NPs对鲫鱼的氧化损伤。Huang等[31]研究了海洋酸化与ZnO NPs对厚壳贻贝的联合毒性效应,发现在低pH和ZnO NPs的单独作用下,厚壳贻贝腮和血细胞超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、酸性磷酸酶(ACP)和碱性磷酸酶(ALP)活性均升高,但是海洋酸化与ZnO NPs没有显著的交互作用,即海洋酸化对ZnO NPs的毒性效应没有显著影响。但是,Wu等[32]研究发现海洋酸化与ZnO NPs对厚壳贻贝血细胞吞噬作用、酯酶活性、溶酶体含量、血细胞死亡率以及ROS含量具有显著的协同效应。这表明海洋酸化与ZnO NPs对厚壳贻贝的联合作用模式与测定的生化指标具有一定相关性。此外,Kadar等[36]研究发现海洋酸化增加了地中海贻贝(Mytilusgalloprovincialis)D形幼虫的畸形率,而Fe2O3NPs对贝类胚胎发育没有显著影响,但是二者联合作用下Fe2O3NPs作为缓冲剂降低了海洋酸化对地中海贻贝的损害,这可能是由Fe2O3NPs的毒性较小所致。对于非金属NPs与海洋酸化的联合毒性效应也进行了研究。如De Marchi等[37]研究了海洋酸化条件下多壁碳纳米管(MWCNTs)对菲律宾蛤仔的毒性效应,发现在低pH和正常pH条件下MWCNTs均可以诱导菲律宾蛤仔的氧化应激,影响其能量代谢,并产生神经毒性,但是低pH条件下MWCNTs的毒性与正常pH无显著差异,表明海洋酸化对MWCNTs的毒性没有显著影响。基于以上研究,海洋酸化与NPs的联合毒性作用及其机制尚不清楚,还需进一步研究。
5 研究展望(Research prospect)
全球气候变化条件下污染物的海洋环境效应是一个新兴的交叉性科学问题,特别是海洋酸化与污染物对海洋环境的联合效应更加值得关注。本文系统梳理了海洋酸化与典型污染物(重金属、有机污染物)和新型污染物(NPs)的联合毒性效应,表明海洋酸化会影响重金属、有机污染物和NPs的环境行为,从而改变其对海洋生物的毒性效应。但是目前海洋酸化与污染物的联合毒性效应的研究还很少,其致毒机制尚不明确。所以,对下一步开展的研究工作展望如下:
(1)目前的研究主要集中于海洋酸化与重金属的联合毒性效应,而与有机污染物、NPs及其他污染物的研究还很少,特别是海洋酸化条件下污染物在海洋食物链上的营养传递及生物毒性研究还没有报道。海洋酸化与污染物的联合毒性作用模式的影响因素及调控机制还不确定,机理性的研究还需进一步加强;
(2)目前的报道大多是研究IPCC预测的海洋酸化pH值与环境污染物的联合毒性效应,但是CO2浓度升高造成海洋酸化是一个渐进的过程,所以应设置更多的pH梯度来研究这种pH渐进情况下海洋污染物的环境行为及其对海洋生态系统的影响,从而更加客观地反映海洋酸化过程中污染物的海洋环境效应;
(3)目前的研究主要集中于室内模拟实验,研究对象也主要是单一的生物物种,不能全面反应实际海洋环境中酸化与污染物的联合作用对海洋生态系统的真实影响,所以下一步应采用微宇宙(Microcosm)和中宇宙(Mesocosm)生态系统原位研究海洋酸化与污染物的联合毒性,对海洋生物群落结构的影响也应加以关注;
(4)除海洋酸化外,海水升温、海洋低氧、UV-B辐射等都是全球气候变化下海洋环境的改变,它们会与环境污染物共同作用于海洋生态系统[110]。所以需要更加系统地研究全球气候变化耦合海洋污染对海洋生物的毒性效应,为准确评估全球气候变化下的海洋生态风险提供科学依据。

