砷在海洋食物链中的生物放大潜力及发生机制探讨
杜森,张黎
1. 中国科学院南海海洋研究所,中国科学院热带海洋生物资源与生态重点实验室,广州 510301 2. 中国科学院大学,北京 100049
砷(As)是一种广泛分布于自然界中的有毒类金属元素,是危害最严重的环境污染物之一。砷位于元素周期表中第四周期第五主族元素,主要以+3和+5的亚砷酸盐和砷酸盐的形式存在于环境中。砷主要用于杀虫剂、除草剂、杀真菌剂和土壤消毒剂,也用来除莠病和消毒种子;工业中也常用来有色金属的冶炼、半导体元件制造业和净化工业气体等[1-2]。在综合考虑毒性大小和污染发生频率的基础上,美国有毒物质与疾病登记署(Agency for Toxic Substances and Disease Registry)和环境保护署(Environmental Protection Agency)将砷排在2017年“优先污染物列表”的首位[3]。不同来源的砷通过陆地径流、大气沉降和废水直接排放等途径进入海洋生态系统,导致砷污染成为近海区域严重的环境问题之一[4]。海洋生物普遍具有较高的砷累积和代谢转化能力,因而在体内含有高浓度的砷,并主要以有机砷形态存在。这导致海产品成为许多国家和地区人群砷摄入的主要来源(在美国和日本超过90%),一直受到密切关注[5]。
食物相暴露是海洋捕食者(像腹足类和鱼类等)累积痕量元素的主要途径[6],这导致痕量元素沿食物链进行传递。污染物是否具有生物放大(biomagnification)的能力,是评估其对环境造成危害的重要依据之一。具有生物放大能力的污染物在沿食物链/网传递的过程中,会随营养级的增加在生物体内逐级富集,在高营养级生物中达到较高水平,对生物与人类健康产生潜在危害,因此其生态风险和人类健康风险就应当受到格外的关注。有机汞以及持久性有机污染物(如多氯联苯)等就是典型的具有高生物放大能力的物质,几十年来已被众多研究所关注[7-8]。砷通常不被认为是具有生物放大能力的污染物,过去的研究发现,砷在淡水和陆地食物链/网中确实常被生物减小(biodiminution)[9-10]。然而,近些年不少研究发现,砷在某些海洋食物链/网中出现了生物放大的现象。迄今为止,关于砷沿食物链/网传递的研究却非常匮乏,而且对相关机理的认识也不明确。因此,本文总结了近20多年来国内外有关砷在典型海洋生态系统中食物链/网传递作用的相关研究,初步探讨砷在海洋食物链/网中是否具有生物放大潜力以及相关砷在不同食物链/网中传递作用的关键核心与影响因素,有助于加深对砷的生物有效性和生物地球化学行为的认识,对准确评估预测砷的生态风险和保障海洋生态安全有十分重要的意义。
1 砷在海洋生态系统中的浓度与形态(Arsenic concentration and speciation in marine ecosystems)
砷具有不同的化学形态(如图1),不同形态砷的生物毒性具有很大差异。砷在海水和沉积物环境中主要以无机形态存在,而在海洋生物中已鉴定出20多种不同的无机和有机形态,其中无机砷主要包括高毒性的三价砷[As(III)]和五价砷[As(V)],有机砷包括低毒的甲基砷(Monomethylarsonate, MMA)、二甲基砷酸(Dimethylarsinate, DMA)、三甲基砷(Trimethylarsine, TMA),微毒的砷糖(Arsenosugars, AsS)、砷胆碱(Arsenocholine, AsC)和砷甜菜碱(Arsenobetaine, AsB)等[11-13]。与大部分重金属通过络合作用形成各种形态不同,这些有机砷形态为共价键形成的化合物,具有较为稳定的结构,例如砷甜菜碱即三甲基砷乙酸酯(CH3)3As+CH2COO-,由甜菜碱中氮原子被砷原子取代形成[13]。
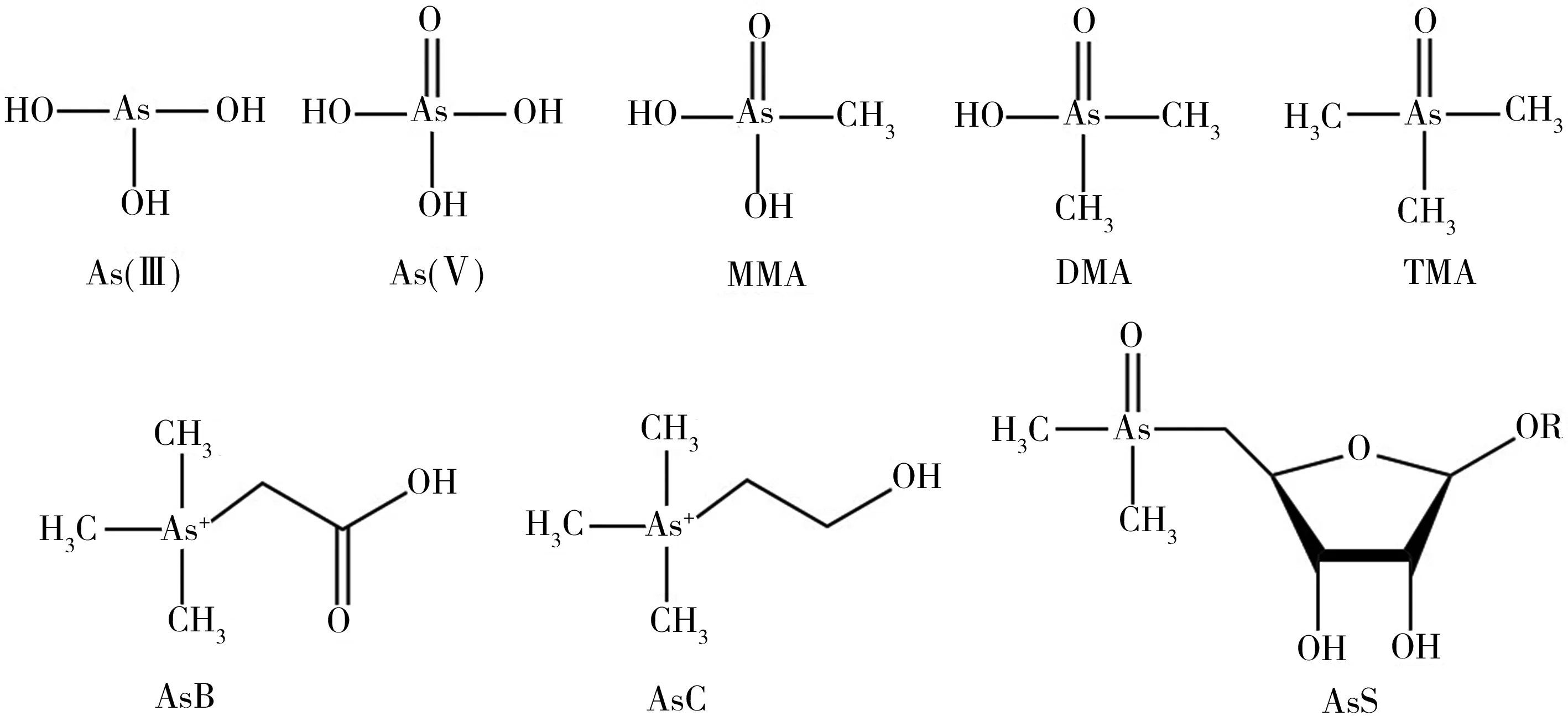
图1 海洋生物体内常见砷化合物的结构Fig. 1 Structures of common arsenic species in marine organism
目前有关海洋生物中砷的研究主要集中在对不同海洋生物中砷的浓度和形态的野外调查[14-16],有少量研究通过室内砷暴露模拟实验分析海洋生物对环境和食物中砷的累积和转化机制[17-18]。野外调查显示,通常海水中砷浓度较低(μg·L-1级),但海洋生物中普遍具有高砷水平,在未受污染的区域处于1~100 μg·g-1范围内,在一些污染区域可超过1 000 μg·g-1[19]。表1总结了世界范围内海洋生物整体或肌肉组织中总砷浓度范围和已检出的砷化合物形态。由于海洋生物组织中总砷浓度差异很大,这里用几何平均值表征其典型浓度。
在不同类群海洋生物中,海藻和海草中总砷浓度较低[21]。海藻中的砷约1%~50%为无机形态,更多的是以砷糖和甲基砷为主的有机形态[20,27],这与淡水和陆地植物中以无机砷为主形成鲜明对比。浮游植物与浮游动物处于低等水生食物链,后者常以前者为食,所以在浮游动物中也可以检测到浮游植物中出现的砷形态。浮游动物体内的砷形态也间接反映了其摄食食性,即杂食性种类浮游动物体内累积AsB,而食草性浮游动物体内累积砷糖,并将其转化为微量AsB[28-29]。
海洋无脊椎动物累积的砷浓度普遍较高,而多毛类和腹足类等底栖无脊椎生物具有很高的砷含量(例如马氏独毛虫Tharyxmarioni中超过2 000 μg·g-1和细角螺Hemifususternatanus中约300 μg·g-1)[21]。多毛类动物沙蠋(Arenicolamarina)体内的砷主要为三价砷(58%)和五价砷(16%),有机砷不到20%;对其进行水相As(V)暴露后发现该多毛类能将As(V)转化成As(III)和DMA[30]。Chen等[31]对菲律宾蛤仔(Ruditapesphilippinarum)进行30 d无机砷暴露后发现,鳃部累积的砷显著高于消化腺,蛤体内砷的主要形态为AsB和DMA;亚细胞分布显示,砷主要分布在金属硫因蛋白(metallothionein-like proteins, MTLPs)和富金属矿体(metal-rich granules, MRG)中。MTLPs能够与金属结合从而在细胞内金属的转运和隔离中发挥重要作用[32],并增加生物对砷的耐受能力。
海洋鱼类中的砷浓度范围也非常大,与无脊椎动物类似,底栖鱼类比浮游鱼类含有更高的砷浓度(例如孔鰕虎鱼Trypauchenvagina中高达134 μg·g-1[22])。砷甜菜碱是绝大多数海洋动物组织中最主要的砷形态,通常占海洋甲壳类和软体动物组织中总砷的50%~95%,在海洋鱼类组织中占80~99%以上。相反,砷在淡水生物中主要以无机砷为主,虽然也有研究报道砷甜菜碱的存在,但它占总砷的比例远低于海洋生物[24]。
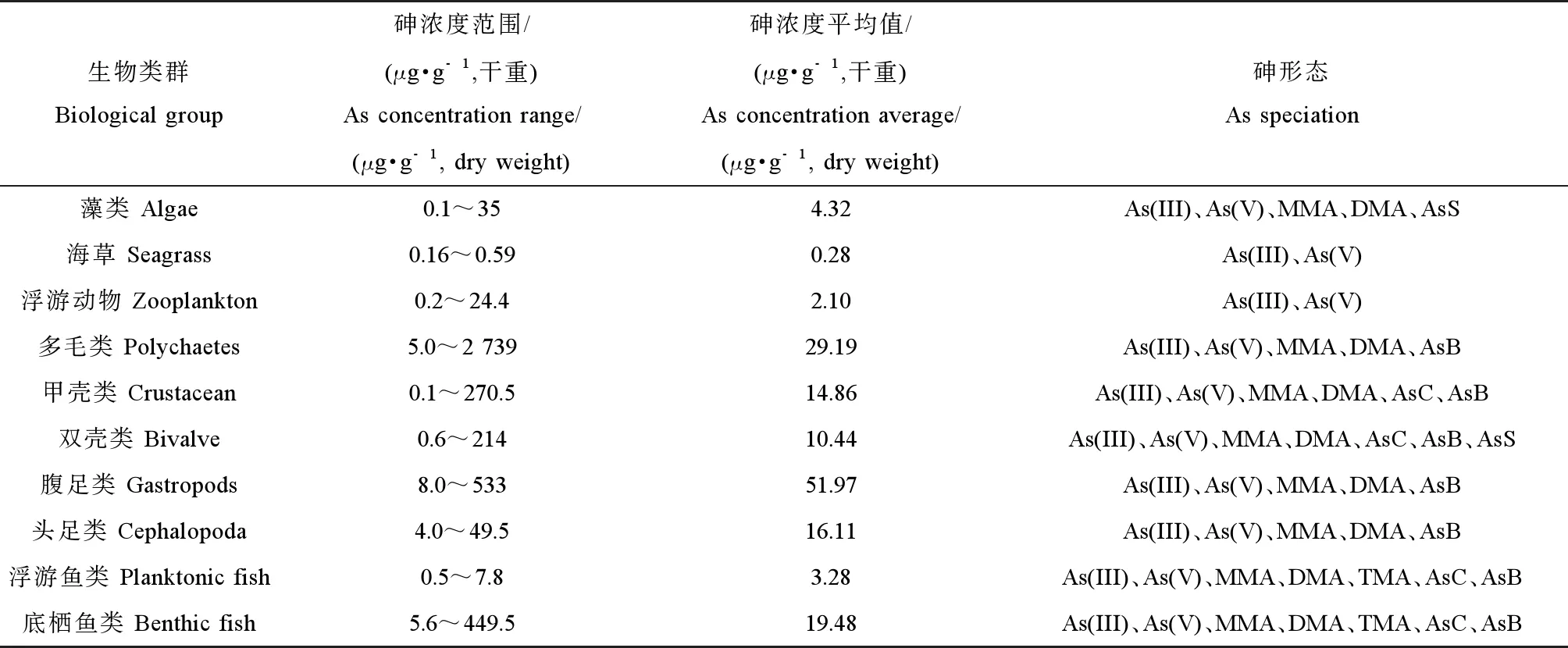
表1 海洋生物体内总砷的浓度和所检出的砷化合物形态[20-26]Table 1 The total arsenic concentration and arsenic speciation of marine organisms[20-26]
海洋鱼类累积砷的生物动力学模型可以描述为[33-34]:
dC/dt=ku×Cw+ AE×IR×Cf- (ke+g)×C
式中,dC/dt为累积速率,ku为水相吸收常数;Cw为水中砷浓度,AE(assimilation efficiency)为同化率;IR为摄食率,Cf为食物中砷浓度,ke为排出速率常数,g为生长速率,C为生物体内砷浓度。砷可以通过水相和食物相进入海洋生物体内,ku、AE和ke是影响海洋生物体内砷累积的3个重要参数,表2列举了通过室内模拟实验得出的常见海洋生物中的生物动力学参数。海洋鱼类对水相砷的吸收速率远小于小型底栖生物,尤其是在双壳类中,砷的水相吸收速率和同化率较高,而排出速率相对较低,说明其对砷的累积能力较强,这也与调查中发现的小型底栖生物高砷含量一致。
虽然目前有关海洋生物砷含量和形态的数据很多,但是由于这些研究通常仅针对一种或数种生物开展,而这些生物又受到各自所处不同环境条件的影响而具有很大的砷浓度范围,因此很难根据这些数据分析不同营养级生物对于砷累积的差异性,只有针对特定生态系统中较完整的食物链进行调查研究,才能反映砷沿食物链传递的特征和规律。
2 砷在海洋食物链/网中的生物放大潜力(Arsenic biomagnification potential along food chains/web)
生物放大(biomagnification)一般是指化学物质在生物摄食作用下,导致了生物体内化学物质的浓度高于食物中的浓度的现象。也有一些学者将生物放大现象定义为浓度随营养级的增加而升高,当生物放大系数(biomagnification factor, BMF)大于1时,这个物质就被生物放大。前者将浓度的升高限制在食物相暴露的因素下,而后者的影响因素包括通过水相暴露和食物相暴露,其中生物从水相吸收污染物的过程称为生物浓缩(bioconcentration)[43]。由于海洋动物中的砷累积主要由食物相获得[35-39],所以对于海洋食物链而言,这2种定义下的砷生物放大作用差异不大。
表3总结了砷在不同类型海洋生态系统中沿食物链传递的数据。这些研究较为综合地分析了某一特定生态系统中环境(海水和沉积物)中砷的背景浓度和不同类群生物中的砷含量,同时部分研究通过氮稳定同位素(δ15N)确定了这些生物的营养级,可较有效反映砷在自然状况下的食物链传递行为。从表中可以发现,不同类型的生态系统中砷的食物链/网的传递存在明显的差异。总体上说,砷在水生生态系统中的食物链传递可以归纳为图2中的4种模式,即生物减小、生物放大、无显著趋势和局部环节生物放大。
在海洋生态系统中,仅发现砷在意大利南部沿岸区域有显著生物减小的现象[44],研究人员对7种大型海藻、2种海草、5种无脊椎动物、9种鱼类和2种鸟类(羽毛)进行采样分析后发现,砷在沉积物、大型藻类和海草中的浓度最高(分别高达11.8、35.4和17.4 μg·g-1),然后随着营养水平的增加而减少,在三级消费者和顶级捕食者(鱼类和鸟类)中的As浓度低于2 μg·g-1,这些不同生物中As浓度的对数值(Log10As)与δ15N之间呈现出显著的负相关性,清晰地表明砷在该食物网中的生物减小作用。需要指出的是,这一研究区域严格上说并不是一个单一的食物链/网,而是一个开放区域的生物集合,因此其结果可能无法反映真实的砷食物链传递结果。相反,砷在其他的海洋生态系统中的食物链传递主要呈现出生物放大(图2B)、无显著趋势(图2C)和局部环节生物放大(图2D)等多种现象。在日本骏河湾生态系统中发现生物(浮游动物、头足类和鱼类)体内砷含量(Log10As)与营养级(δ15N值)呈显著正相关(P<0.05),有着明确的生物放大作用[45]。砷在中国大鹿岛底栖食物链中也存在一定的生物放大趋势[46]。苏禄海底层鱼类体内砷含量(Log10As)与营养级(δ15N值)之间同样存在显著的正相关(P<0.01),且BMF达1.70[47]。在珊瑚礁生态系统中,砷则出现了生物放大的趋势[48]。在南极和北极的极地海洋性生态系统中,砷的浓度与营养级之间无显著相关性[49-50]。
注:ku为水相吸收常数;AE为同化率;ke为排出速率常数。
Note:kustands for waterborne uptake rate constant; AE stands for assimilation efficiency;kestands for efflux rate constant.

表3 砷沿不同水生生态系统食物链/网传递研究汇总Table 3 Summary of arsenic trophic transfer in different aquatic ecosystems
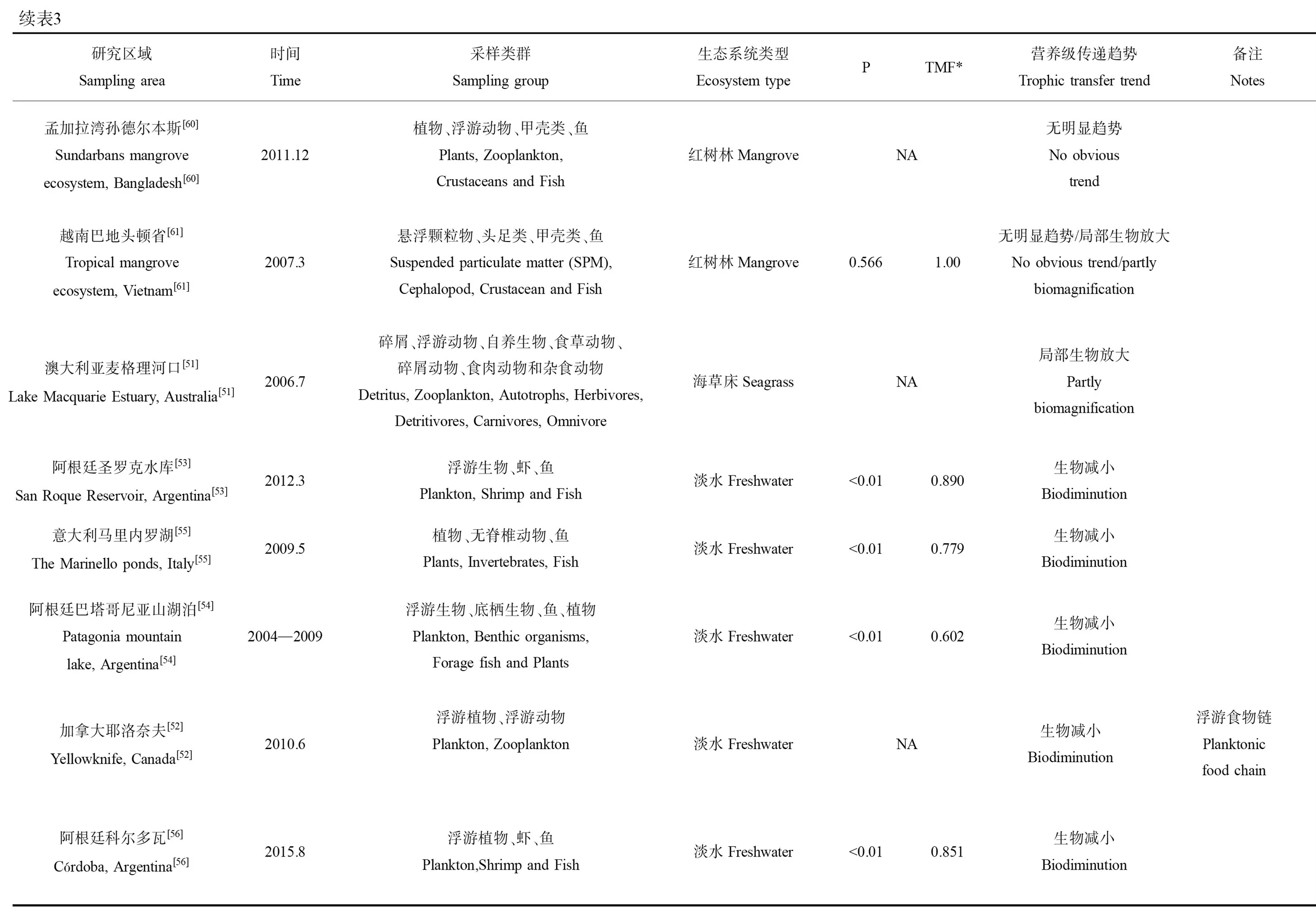
续表3研究区域Sampling area时间Time采样类群Sampling group生态系统类型Ecosystem typePTMF*营养级传递趋势Trophic transfer trend备注Notes意大利马里内罗湖[55]The Marinello ponds, Italy[55]2009.5植物、无脊椎动物、鱼Plants, Invertebrates, Fish淡水Freshwater<0.010.779生物减小Biodiminution阿根廷巴塔哥尼亚山湖泊[54]Patagonia mountain lake, Argentina[54]2004—2009浮游生物、底栖生物、鱼、植物Plankton, Benthic organisms, Forage fish and Plants淡水Freshwater<0.010.602生物减小Biodiminution加拿大耶洛奈夫[52]Yellowknife, Canada[52]2010.6浮游植物、浮游动物Plankton, Zooplankton淡水FreshwaterNA生物减小Biodiminution浮游食物链Planktonic food chain阿根廷科尔多瓦[56]Córdoba, Argentina[56]2015.8浮游植物、虾、鱼Plankton,Shrimp and Fish淡水Freshwater<0.010.851生物减小Biodiminution
注:#NA表示无有效数据;TMF表示营养级放大系数。
Notes:#NA means no valid data; TMF stands for trophic magnification factor.
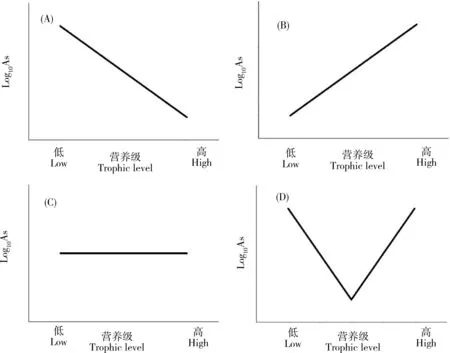
图2 砷沿食物链/网传递模式图注:(A)生物减小、(B)生物放大、(C)无显著趋势、(D)局部环节生物放大。Fig. 2 The mode pattern of arsenic transfer along food chains/websNote: (A), biodiminution; (B), biomagnification; (C), no significant trend; (D), biomagnification in part of food chains.
在沿海的浅海生态系统(包括河口、红树林和盐沼海草床等),砷同样表现出了生物放大的潜能。Barwick等[51]对澳大利亚温带河口海草生态系统中食物网的研究发现,在碎屑、浮游动物、自养生物、食草动物、碎屑动物、食肉动物和杂食动物间的35条经验食物链中有19条出现砷浓度从被捕食者到捕食者增加的现象;在浮游动物(2.1 μg·g-1)→浮游双壳类动物(4.8 μg·g-1±0.9 μg·g-1)→肉食性鱼(6.2 μg·g-1±0.4 μg·g-1)和碎屑(6 μg·g-1±3 μg·g-1)→杂食性虾(8 μg·g-1±1 μg·g-1)→杂食性鱼(11 μg·g-1±2 μg·g-1)2条食物链中观察到As的生物放大,而这2条食物链都属于底栖食物链。
砷在淡水生态系统中的食物链传递研究相对较少,但是都一致地表现出显著的生物减小作用(图2A),仅在BMF值上有所差异[52-56]。例如,在阿根廷的一个湖泊调查中发现,砷在由浮游植物、底栖生物、鱼和植物组成的食物网中出现显著的生物减小现象(P<0.01)[54]。
从这些研究结果中不难发现,砷沿海洋食物链/网传递具有一定的复杂性,但是普遍具有随营养级升高维持高生物累积或生物放大的潜力,与淡水食物链/网中砷的生物减小形成显著的对比。然而,这些研究均存在一定的局限性(例如采样没有覆盖主要生物类群,没有用δ15N确定生物营养级,缺少对同一生态系统的重复性调查等),造成研究结果的诸多不确定性,使得砷在海洋食物链/网中是否生物放大仍然存在疑问。更重要的是这些研究基本都没有对不同砷形态进行分析,而砷形态的区别恰恰是海洋生物和淡水生物最大的差异,很可能是解析砷在海洋生态系统中生物放大潜力的关键因素。
3 砷在海洋食物链/网中生物放大潜力的可能机制(Possible mechanisms of arsenic biomagnification potential along food chains/web)
目前已有研究从生物动力学角度来分析无机砷的食物链传递,在几种海洋鱼类和无脊椎动物中测定了控制食物链传递的2个参数(同化率和排出率),通过模型计算表明,无机砷难以在食物链中被生物放大[18,35,37]。Zhang等[62]研究了蛤和多毛类对沉积物中砷的生物动力学和生物可利用性,发现生物对砷的累积与沉积物中砷的形态有关,砷甜菜碱是有机砷中同化效率最高的形态,而As(III)的同化效率较低且排出速率较快。海洋鱼类对痕量元素的同化率受被捕食者亚细胞痕量元素的分布以及鱼类的摄食过程所影响[63],而不同的食物对海洋鱼类As的生物有效性和生物累积存在显著的影响作用[64]。痕量元素能够在底栖食物链中生物放大的主要原因可能是腹足类能够有效吸收食物中的痕量元素,而浮游生物食物网生物减小的发生则可能是其对痕量元素较低的同化率和较高的排出率[65]。
因此,砷的生物放大作用很可能是由有机砷的食物链传递作用所引起的。痕量元素的有机形态通常比无机形态具有更高的生物可利用性和食物链传递能力,其中了解最多的为汞。有机汞(以甲基汞为主)具有很强的亲脂性,可以直接通过细胞膜结构进入细胞并与生物分子结合,因此具有比无机汞更高的生物可利用性。而甲基汞的生物放大作用也远超无机汞,是痕量元素生物放大的最典型案例[7]。由此,有机砷可能比无机砷更容易被生物放大,这在一定程度上解释了砷在海洋和淡水生态系统中食物链传递的差异现象。在越南南部沿海的红树林生态系统中通过对悬浮颗粒物、头足类、甲壳类和鱼类的调查后发现,尽管总砷浓度(Log10As)与营养级(δ15N值)之间没有显著的相关性(P=0.556),但生物体内的砷甜菜碱出现了明显的生物放大现象(TMF=1.30,P<0.01)[61]。
海洋鱼类和贝类普遍具有将从环境中吸收的无机砷通过生物转化合成砷甜菜碱的能力(如图3),这种生物转化过程包括As(V)还原为As(III),As(III)甲基化至一甲基砷和二甲基砷,以及经过后续未知的过程合成砷甜菜碱[66-68]。砷甜菜碱的合成,有助于海洋鱼类将砷累积在体内,从而达到较高富集的结果。在这种生理作用下,当鱼类长期暴露在高无机砷环境中时,导致的结果是较高砷甜菜碱的富集,这也是鱼类的一项重要解毒机制[69]。在温带海洋盐沼系统中,植物体内砷主要为无机砷,但摄食这些植物的动物体内砷的主要形态为砷甜菜碱和砷糖为主的有机砷,说明动物将吸收的无机砷生物转化成了有机砷[70]。Zhang等[37]通过构建了2条底栖食物链(沉积物—沙蚕Nereissuccinea—诸氏鲻鰕虎鱼和沉积物—蛤Gafrariumtumidum—鰕虎鱼)研究了砷沿底栖食物链的传递和生物转化作用,发现蛤对砷的吸收效率分别为35%~65%,沙蚕对砷的吸收效率分别为52%~73%,从而造成沙蚕比蛤具备更高的砷累积能力;同时,在沉积物中砷的形态以无机砷为主,到初级消费者体内砷甜菜碱成为主要形态,再到鱼类体内砷甜菜碱可以占到95%以上,说明无机砷在底栖食物链中被高效转化,并主要发生在初级消费者环节,该结果也印证了As在底栖食物链中存在更大生物放大潜能。
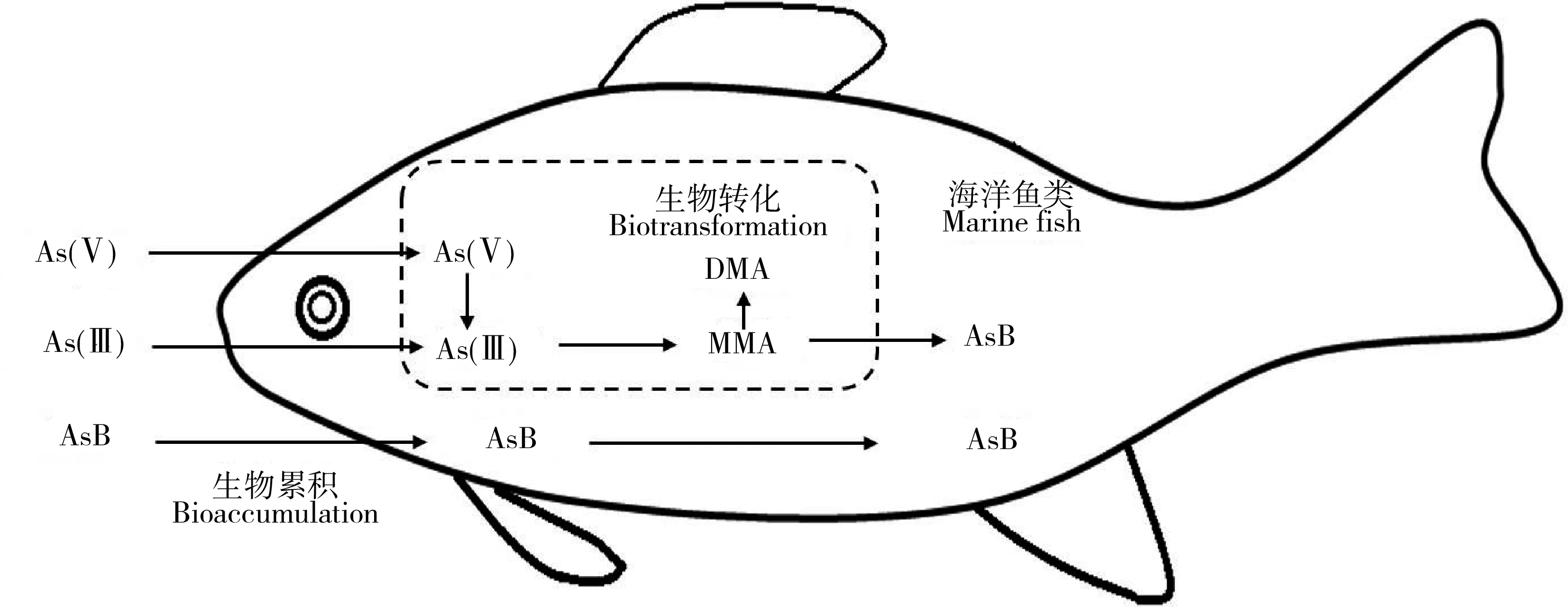
图3 海洋鱼类对砷的生物转化[67]Fig. 3 Arsenic biotransformation of marine fish[67]
当砷从不同的饵料生物传递到海洋鱼类时,饵料中的有机砷比例与总砷的营养级放大系数(TMF)呈现显著的正相关,表明海洋生物中有机砷比无机砷具有更高的食物链传递能力,可以导致海洋鱼类富集更高浓度的砷[64]。Zhang等[67]研究了海洋鱼类(草食性篮子鱼Siganusfuscescens和肉食性鲈鱼Lateolabraxjaponicus)对砷的营养转化和生物可利用性,发现食物中的无机砷较难被海洋鱼类吸收,而是在体内被生物转化成了有机砷,而食物中的砷甜菜碱可直接通过消化器官的上皮细胞被鱼类吸收,成为鱼体内砷的最终存储形态。对澳大利亚红树林的调查显示,红树林生态系统中的动物主要从食物中吸收有机砷(砷甜菜碱和砷核糖等)[71]。长期砷甜菜碱的暴露会导致大西洋鲑鱼(Salmosalar)和大西洋鳕鱼(Gadusmorhua)肌肉中砷浓度显著增加[72]。目前关于有机砷食物链传递的生物动力学研究较少,因此需要对有机砷(特别是砷甜菜碱)的生物累积动力学参数进行量化解析,厘清其对总砷食物链/网传递的贡献。
除了生物体中的砷形态(内因)可能直接作用于砷的食物链传递以外,海洋生态系统中的生物和环境因素(外因)也可能对其造成影响。环境因素如温度、浊度、营养盐和光照等可影响生物中的砷形态,间接作用于砷的食物链传递;也可能通过影响生物的生长速率和代谢率(特别是小个体生物),间接影响砷的摄入、代谢和排泄[73-74],这些作用可综合体现在砷生物累积的季节变化上。盐度能够影响大亚湾几种常见鱼类和甲壳类体内砷的累积,尤其是砷甜菜碱的浓度;同时沉积物中高砷的浓度对海洋鱼类体内砷的累积也有重要影响[75]。室内实验也证明高盐度会导致贻贝(Mytilusedulis)对砷甜菜碱的高累积[76]。有研究认为海藻通过细胞磷酸盐转运系统累积海水中的砷酸盐,但是其体内的砷糖水平更主要是受到海水中氮盐的影响[77]。食物网中生物组成的不同与所处环境的差异也会对砷的食物链传递产生影响。底栖无脊椎动物和鱼类往往比游泳生物含有更高浓度的砷,除了物种差异的原因外,还包括不同生物类群的食性不同,食物中砷浓度和形态的差异也会对砷的累积产生差异,因此,当食物网中生物组成偏向于底栖食性时,可能会导致更大的生物放大潜力[37,62]。因此,当研究砷的食物链传递时,不能仅着眼于砷本身而忽视了其他环境因素的作用。
4 总结与展望(Summary and prospect)
海洋生物普遍具有高含量的砷,这些砷主要为低毒性的有机砷形态。砷在淡水生态系统中普遍生物减小,但是在海洋生态系统中出现了一定的生物放大潜力。海洋鱼类和贝类普遍具有将从环境中吸收的无机砷通过生物转化合成砷甜菜碱的能力,有机砷比无机砷具有更高的食物链传递能力,可以导致海洋鱼类富集更高浓度的砷。因此,有机砷的存在可能有助于砷沿着海洋食物链/网富集,在某些情况下被生物放大。但是目前关于砷在海洋生态系统中生物放大潜力及机制的研究较为匮乏,今后应该从一下几个方向开展:
(1)不同砷形态如何在海洋食物链/网中传递的研究。目前关于砷在生态系统中的传递主要是关于总砷的研究,缺乏对不同砷形态在传递的过程中累积、传递和转化的研究工作。
(2)砷在海洋生态系统中生物放大潜力的影响因素。过去主要关注痕量元素在生态系统中传递的调查工作,应该系统地研究砷在不同海洋食物链/网中从初级生产者到高营养级生物中的行为,通过比较不同物种对砷累积的差异以及不同食物链之间的异同,厘清引起砷生物放大的关键因素。
(3)砷甜菜碱合成关键基因及其调控机制的研究。海洋鱼类能累积较高含量的砷,其中的砷主要为砷甜菜碱,所以应该采用分子生物学等方法研究砷甜菜碱合成的关键基因和调控机制,阐明海洋生物高砷累积的调控机制。
(4)室内模拟实验与野外调查相结合,通过不同砷形态食物链传递的室内实验来验证砷形态是否是导致海洋生态系统中砷放大的关键原因,同时验证相应的环境影响因素,最终阐明不同砷形态的食物链传递作用及其对砷生物放大的影响,对于准确评估砷的生态风险,进一步阐明砷元素的生物地球化学过程有着重要作用。

