超声波处理对猪肉肌原纤维蛋白理化及乳化特性的影响
刁小琴 关海宁 乔秀丽 刘东琦 刘 旺
(绥化学院食品与制药工程学院,黑龙江 绥化 152061)
肌原纤维蛋白是猪肌肉的重要组成成分之一,大约占猪肌肉总蛋白的55%,它不仅赋予肉制品特有的风味、口感和营养,还具有持水性、乳化性以及凝胶性等多重功能特性,决定产品的最终品质[1]。肌原纤维蛋白具有亲水亲油基团,是一种天然的表面活性物质,在乳化型肉制品中,蛋白向脂肪球靠拢后吸附在脂肪球表面,最后蛋白分子经过构象改变包裹在脂肪颗粒的外层,有效地阻止脂肪颗粒的聚集[2],减少肉制品加工过程中跑水、跑油现象的发生。
超声波技术因具有效率高、成本低、操作简单、污染小、安全性高等优点,近些年在食品加工、保藏、提取等领域被广泛应用[3-4]。超声波通过产生的机械、空化、热和化学4种效应对食品中的生物大分子进行改性,效果显著[5-6]。常海霞等[7]研究发现,应用超声波技术对草鱼肌原纤维蛋白进行改性,取得了良好的效果。Hu等[8]研究表明,超声波能够使肌原纤维蛋白结构断裂,进而使鱿鱼肉嫩度得到提高。Huang等[9]报道大豆分离蛋白经超声处理后,其游离巯基和表面疏水性会提高,进而溶解性和流动性提高。Nazari等[10]报道超声处理小米浓缩蛋白,其溶解性和乳化活性显著增加。Sheng等[11]报道,蛋清蛋白经过高强度的超声处理后,溶解性、发泡性及表面疏水性均有所提高,而黏度和表面张力降低。也有研究[12]报道,使用超声波处理乳清蛋白,其泡沫稳定性和凝胶强度均得到显著提高。
目前关于猪肉肌原纤维蛋白经超声波处理后的溶解性与乳化性改善的研究国内外尚未见报道。本试验拟通过超声波清洗仪对MP进行处理,研究其理化与乳化特性的变化,以期改善猪肉肌原纤维蛋白的功能特性,为将超声波技术进一步应用于肌原纤维蛋白的改性提供理论依据,并为进一步提高乳化型肉糜制品的品质提供参考。
1 材料与方法
1.1 材料与试剂
新鲜的猪背最长肌:大润发超市;
乙二醇双(2-氨基乙基醚)四乙酸(EGTA):分析纯,北京华迈科生物技术有限责任公司;
十二烷基硫酸钠(SDS):分析纯,上海源叶生物有限公司;
牛血清蛋白标准品:Sigma公司。
1.2 主要仪器设备
超声波发生器:KQ-100VDB型,昆山市超声仪器有限公司;
匀浆机:T18 basic型,德国IKA公司;
激光粒度仪:Mastersizer 3000型,英国马尔文公司;
ZETA电位仪:Zetasizer Nano型,英国马尔文公司;
高速冷冻离心机:GL-21M型,湖南湘仪实验仪器开发有限公司;
光学显微镜:BX50型,日本Olympus公司。
1.3 方法
1.3.1 肌原纤维蛋白的制备 参照Xia等[13]的方法,稍作修改,制备方法如下:将明显的外部脂肪和结缔组织剔除,取一定量的肉样绞碎称重,与10 mmol/L磷酸盐缓冲液(pH 7.0)以1∶4(g/mL)比例混合,其中磷酸盐缓冲液要事先预冷,且添加氯化钠、氯化镁和 EGTA,其终浓度分别为0.1,2.0,1.0 mmol/L,混合物在匀浆机中匀浆60 s,形成的肉浆在3 500 r/min冷冻(4 ℃)离心15 min,弃掉表层物质,留沉淀,依照上述步骤重复提取2次,得到的沉淀即为粗肌原纤维蛋白,接着在此沉淀中加入4倍体积预冷的0.1 mol/L NaCl洗液,匀浆机中匀浆60 s,3 500 r/min冷冻(4 ℃)离心15 min,取沉淀,重复上述操作1次,再取沉淀加入4倍体积0.1 mol/L NaCl 洗液,匀浆60 s,用4层纱布过滤,滤液用0.1 mol/L HCl 调节pH值至6.0,依据前面离心标准再次离心,得到的肌原纤维蛋白2~4 ℃保存,在48 h内利用,所有步骤均在 4 ℃条件下进行。
1.3.2 肌原纤维蛋白含量的测定 采用双缩脲法[14],以牛血清蛋白为标准品。
1.3.3 超声处理肌原纤维蛋白 将得到的肌原纤维蛋白用pH 7.0的缓冲液溶解,配成40 mg/mL的蛋白溶液,分成5份置于超声波清洗器中,设置不同的超声功率(80,140,180,200 W),超声处理40 min,冰水浴控制温度为4~10 ℃,以不做超声处理的为对照,超声结束后,冷冻干燥备用。
1.3.4 溶解度的测定 取10 mg/mL不同超声处理的MP溶液于离心管中,4 000 r/min离心40 min后,取上清用双缩脲法测定其吸光值,按式(1)计算溶解度:
(1)
式中:
s——溶解度,%;
m1——上清液中蛋白质的含量,mg/mL;
m2——样品中蛋白质含量,mg/mL。
1.3.5 粒径大小和分布的测定 将超声处理后的MP用去离子水配成1 mg/mL的溶液,采用激光粒度分析仪测定粒径大小和分布,测定温度为室温(25 ℃)。测量时以蒸馏水作为分散介质,分散剂折射率为1.330。测定结果以d3,2和d4,3表示,按式(2)、(3)计算:
(2)
(3)
式中:
d3,2——表面积等效平均粒径,μm;
d4,3——体积等效平均粒径,μm;
di——测定的第i个粒子的直径,μm;
ni——表示直径为di的颗粒数。
1.3.6 乳化液电位的测定 将不同功率超声处理的MP乳化液50 μL与浓度为10 mmol/L(pH 7.0)的磷酸盐缓冲液5 mL均匀混合后,转入毛细管吸收池中,用纳米电位仪在常温下测定乳化液的电位。
1.3.7 乳化活性和乳化稳定性的测定 参照Diao等[15]的方法,修改如下:在8 mL 10 mg/mL的MP溶液中加入大豆色拉油2 mL,用高速分散均质机10 000 r/min匀浆1 min后,用移液器从距离试管底部0.5 cm处取50 μL乳化液放入离心管中,加入5 mL SDS溶液(浓度为1 mg/g)混匀后,倒入比色皿中于500 nm波长下测其吸光度。同时,依照上述方法再次测定室温放置10 min后的样品。乳化活性(EAI)和乳化稳定性(ESI)按式(4)、(5)计算:
(4)
(5)
式中:
EAI——乳化活性,m2/g;
ESI——乳化稳定性,%;
C——乳化前的蛋白浓度,g/mL;
φ——乳化液中油的体积比;
dilution——稀释倍数;
A0——初始乳化液的吸光度(500 nm);
A10——10 min后乳化液的吸光度(500 nm)。
1.3.8 光学显微镜观察 将上述乳化液分别取1滴均匀涂布在载玻片上,用盖玻片盖好,10倍物镜下观察。
1.4 数据统计分析
每个试验结果均用平均数±SD表示。差异显著性分析采用Statistix 8.1软件进行,差异性显著用不同字母表示(P≤0.05),差异性不显著用相同字母表示(P≥0.05),采用Sigmaplot 12.5软件作图。
2 结果与分析
2.1 超声处理对肌原纤维蛋白溶解度的影响
评价蛋白质乳化特性的一个重要指标是溶解性,它也是衡量蛋白质变性和聚集的一种方法[16]。肌原纤维蛋白的溶解性越高,说明更多的蛋白质会被溶出,它们通过疏水相互作用附着在脂肪颗粒四周形成界面膜,因此溶解性高的蛋白其乳化性也高。肌原纤维蛋白经不同超声功率处理后其溶解度的变化见图1。随着超声功率的增强,溶解度由19.17%(0 W)增加到35.03%(180 W)(P≤0.05),而后又显著下降到28.92%(200 W)(P≤0.05)。可能是超声处理使蛋白质构象发生改变,形成可溶性的蛋白聚集物,也可能是内部的亲水基团暴露,增加了蛋白质与水的相互作用,进而导致溶解度增加。Maity等[17]报道超声的机械空化效应,打断了分子间的疏水相互作用,进而提高了蛋白质的溶解度,然而随着超声功率的增加,蛋白分子逐渐展开,暴露出更多的疏水基团和巯基基团,进而使溶解度降低。Wang等[18]利用超声功率为240 W 的超声波处理鸡肉肌原纤维蛋白的研究中发现,当超声时间为6 min时,溶解度达到最大,随着超声时间的延长,溶解度也表现出下降的趋势。
2.2 超声处理对肌原纤维蛋白粒径的影响
粒径分布可以反映蛋白的聚集程度。由图2看出,超声处理显著影响MP的粒度分布,超声未处理的MP呈现单峰分布,且粒度较大,经超声处理后的蛋白粒径分布变宽,而且随着超声功率的增加,粒度均朝着粒径减小的方向移动,这和超声处理对粒子直径的变化结果相一致(表1),可能是超声波的空化效应将肌原纤维蛋白之间的非共价键打断,使其形成更小的可溶性蛋白聚集物。王静宇等[19]研究发现,随着超声功率的增加,鸡肉肌原纤维蛋白的粒径显著降低。然而Vera等[20]报道高强度的超声波处理会使藜麦蛋白的粒度增加,可能是超声功率越大,疏水基团暴露的越多,分子间产生的疏水相互作用使蛋白发生了聚合。本研究也发现当超声功率为200 W时,平均粒径整体反而高于180 W处理得到的蛋白的平均粒径。体积等效平均粒径(d4,3)通常可以反映蛋白的聚集、分解或絮凝的程度。表1看出,与未经超声处理的样品比较,超声处理使d4,3显著降低(P≤0.05),然而当超声功率达到200 W时,d4,3又略有升高,但与经180 W超声处理的样品差异不显著(P≥0.05)。

图1 超声处理对肌原纤维蛋白溶解度的影响Figure 1 Effect of ultrasound treatment on solubility of MP
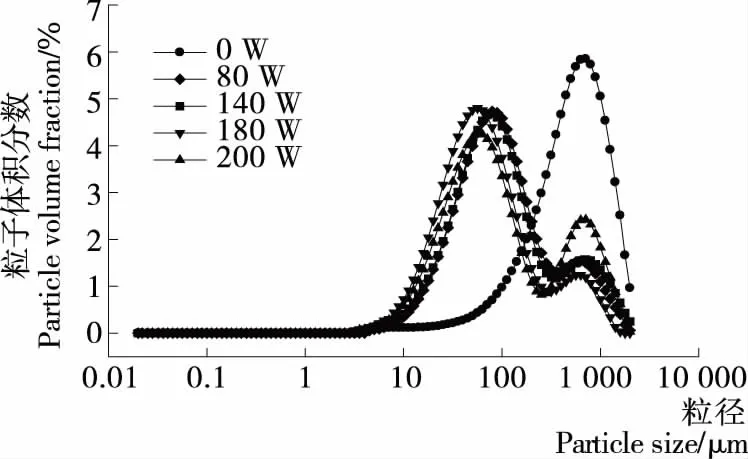
图2 超声处理对肌原纤维蛋白粒径分布的影响Figure 2 Effect of ultrasound treatment on particle size distribution of MP
2.3 超声处理对肌原纤维蛋白电位的影响
电位可以反映粒子在溶液中的表面带电性质,能够描述粒子之间的静电相互作用,进而决定粒子在溶液中的分散和聚集状态。一般来说,蛋白溶液体系中带正电荷的氨基酸数量比带负电荷的氨基酸数量高时,蛋白溶液的电位即呈现正值[21]。图3所示,所有蛋白样品的电位均呈现负值,说明蛋白表面带负电荷氨基酸的数量高于带正电荷的氨基酸数量,而且随着超声功率的增加,肌原纤维蛋白电位的绝对值逐渐增加,说明蛋白质所带的负电荷逐渐增多,蛋白分子的聚集可能被破坏,分子展开,更多的带负电荷的氨基酸暴露。当超声功率为180 W 时,肌原纤维蛋白表面的电位绝对值最大,粒子间产生的较强静电排斥力抑制了蛋白质的聚集,进而提高了蛋白质的分散性,使蛋白的溶解度增强,与蛋白溶解度测定结果一致。然而当超声功率达到200 W时,电位的绝对值又显著下降(P≤0.05),可能是较强的超声功率促进了蛋白的聚集。
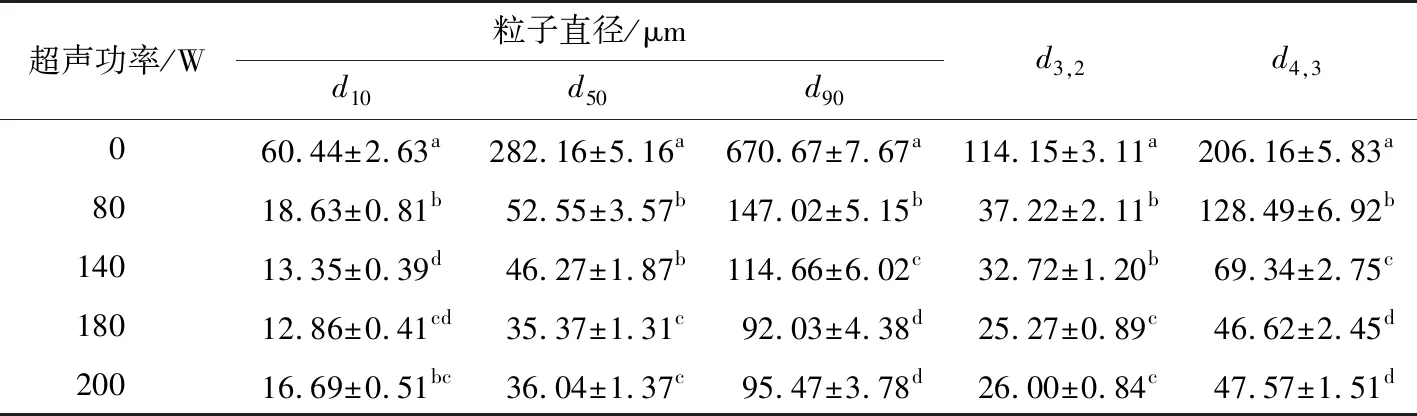
表1 超声功率对肌原纤维蛋白粒径的影响†Table 1 Effect of ultrasound treatment on particle size of MP
†d10指蛋白的粒径累计达到10%时所对应的粒径大小,d50和d90同。
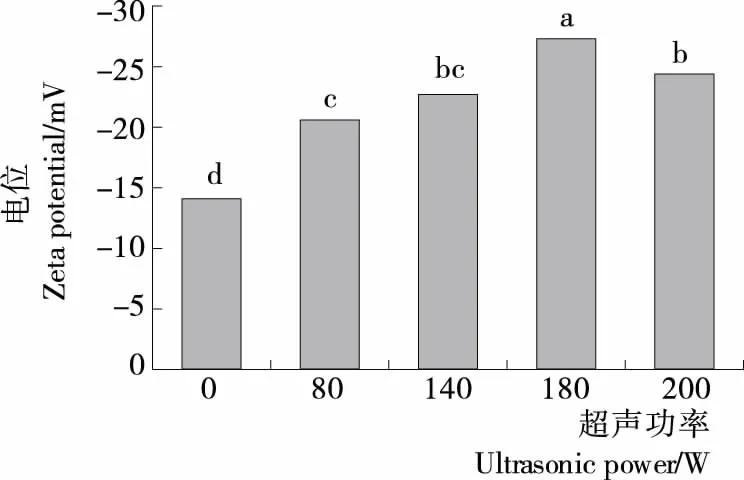
图3 超声功率对肌原纤维蛋白电位的影响Figure 3 Effect of ultrasound treatment on zeta potential of MP
2.4 超声处理对猪肉肌原纤维蛋白乳化性和乳化稳定性的影响
乳化活性(EAI)和乳化稳定性(ESI)是评价蛋白质乳化性的重要指标。EAI是指单位质量蛋白质在促进油水互溶时,稳定油水界面的大小,ESI是指维持油水混合不分离时,蛋白质抵抗外界条件的能力[22]。由图4可知,与未经超声波处理的肌原纤维蛋白样品相比,超声处理后,肌原纤维蛋白的EAI和ESI显著增加(P≤0.05),且随着超声功率的增加,二者均显著增加(P≤0.05),当超声功率超过180 W时,乳化能力开始下降,说明超声处理能够改变肌原纤维蛋白的乳化特性。肌原纤维蛋白经适当强度的超声波处理后,局部变性或结构变得无序,增加了其在油水界面的吸附潜力。然而较高功率的超声波处理,可能会产生大量的可溶性聚集体,进而使乳化活性和乳化稳定性下降。Caessens等[23]研究表明超声波处理能够减少蛋白质粒径的大小,使其吸附比例增大。有研究[24]报道,蛋白吸附于油水界面后,其结构会发生改变,乳化能力会受到影响。超声处理会使肌原纤维蛋白分子结构发生重排,进而使其具有不同的乳化能力。
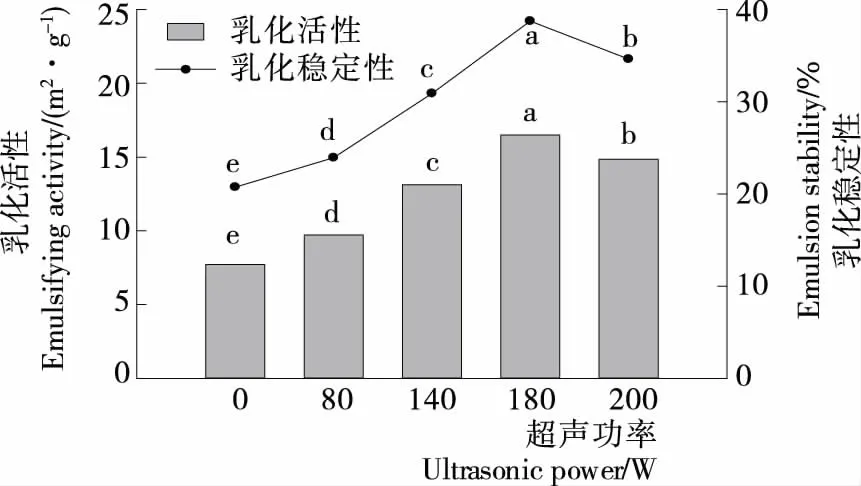
图4 超声处理对肌原纤维蛋白乳化活性和乳化稳定性的影响Figure 4 Effect of ultrasound treatment on emulsifying activity and emulsion stability of MP
2.5 乳化液的显微观察
为进一步验证不同超声处理的肌原纤维蛋白乳化液的乳化特性,未经超声处理的对照组与经不同超声处理的肌原纤维蛋白制备的乳化液的光学显微镜观察结果见图5。随着超声功率的增加,乳化液的液滴颗粒大小明显小于对照组,且随着超声功率的增加,液滴颗粒大小明显下降,在超声功率达180 W时,乳化液液滴颗粒最小,然而当超声功率增加到200 W时,乳化液液滴颗粒大小增加,液滴大小与之前乳化活性、电位以及粒径大小和分布结果相一致。
2.6 相关性分析
由表2看出,超声功率与体积等效平均粒径(d4,3)极显著负相关(P≤0.01),与溶解度、电位、乳化活性及乳化稳定性显著正相关(P≤0.01),溶解度与乳化活性和乳化稳定性之间存在极显著相关性(P≤0.01),与d4,3和电位之间存在显著相关性(P≤0.05),乳化活性与乳化稳定性之间也存在极显著相关性(P≤0.01)。由此可见,超声波对MP的理化及乳化特性有显著的影响,且理化性与乳化性之间也存在一定的相关性。

图5 不同超声处理的肌原纤维蛋白乳化液的光学显微镜图Figure 5 Optical microscopy images of MP emulsions treated with different ultrasound

表2 超声波与MP理化乳化性之间的相关性†Table 2 Correlation of ultrasound,physicochemical property of MP and emulsifying property
† *表示显著相关(P≤0.05),**表示极显著相关(P≤0.01)。
3 结论
MP的理化特性(溶解度、粒径和电位)和乳化特性受超声处理的影响显著。一定功率的超声处理能促进MP适度伸展,使颗粒粒径下降,大小分布更加均匀,溶解度、乳化活性及乳化稳定性提高。当超声功率超过180 W时,较强的超声功率又促进了蛋白的聚集,进而使各性质指标下降。因此,采用适宜的超声功率可以提高肌原纤维蛋白的理化及乳化性,然而关于超声作用时间、超声作用频率等超声波改性技术对MP功能特性及结构的影响有待进一步研究。另外,有研究[25]表明较高浓度的盐溶液也能够提高肌原纤维蛋白的理化特性和加工特性,然而较高食盐的摄入,会影响人类的健康,本研究采用的超声波改性技术对肌肉蛋白质加工特性的影响能否替代盐离子的作用有待进一步探究。

