黄芪配方颗粒提取过程中3种指标成分的传质规律
莫平莉王洛临∗卢 泳陈雪婷冯健英徐文杰李智勇
(1.广州中医药大学第五临床医学院,广东 广州 510095;2.广东省中医药工程技术研究院/广东省中医药研究开发重点实验室,广东 广州 510095)
黄芪配方颗粒的提取采用2 次煎煮方法,目前相关工艺的制定是通过间断取样及HPLC 法、紫外-可见分光光度法等来反映提取液中指标成分含有量,并优化提取方案[1-3],但这些方法会使提取信号滞后,导致无法及时调整提取方案,并且存在样品处理复杂、步骤多、耗时长、对仪器设备要求高等缺点[4-5]。因此,需寻找 1种精准简便的方法来对黄芪配方颗粒的提取过程进行实时监测,以便及时优化提取方案,确定提取终点。
本实验利用黄芪提取液显示电信号的表征,通过关联其电导率与指标成分(黄芪甲苷、黄芪多糖、毛蕊异黄酮-7-O-β-D-葡萄糖苷)含有量之间的关系,对提取过程进行实时监测,为研究该制剂提取过程中的传质规律奠定基础。
1 材料
1.1 仪器 e2695 型 HPLC 色谱仪,配置 2424 型ELS 检测器、2998 型 PDA 检测器(美国 Waters 公司);DDS-307A 型电导率仪(上海精密科学仪器有限公司);LXJ-ⅡB 型离心机(上海安亭科学仪器厂);JJ500 型电子天平(常熟市双杰测试仪器厂);TLE204 型分析天平(瑞士 Mettler-Toledo 公司);HH 系列数显恒温水浴锅(金坛市科析仪器有限公司)。
1.2 试药 黄芪甲苷(CAS 号84687-43-4,含有量>98%)对照品购自成都瑞芬思生物科技有限公司;毛蕊异黄酮-7-O-β-D-葡萄糖苷(批号 11920-201203,含有量 97.3%)、D-无水葡萄糖(批号110833-201506,含有量 99.9%)对照品购自中国食品药品检定研究院。黄芪(批号160301)购自广州市金芝中药饮片公司,经广东省中医药工程技术研究院王洛临主任中药师鉴定为正品,符合2015年版 《中国药典》 一部相关项下规定。D-101型大孔吸附树脂购自天津浩聚树脂科技有限公司。乙腈为色谱纯;甲醇、苯酚等均为分析纯;水为屈臣氏蒸馏水。
2 方法与结果
2.1 黄芪甲苷含有量测定
2.1.1 色谱条件[6-7]AichromBond-SB 色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈-水(32 ∶68);增益 150;漂移管温度 85 ℃;气体压力25 psi(1 psi=6.895 kPa);喷雾器温度 36 ℃;体积流量 1 mL/min;柱温 30 ℃。色谱图见图1。
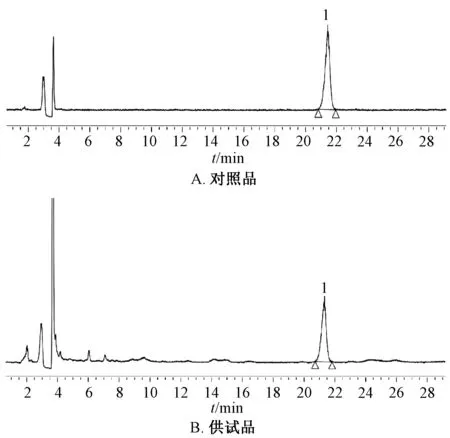
图1 黄芪甲苷HPLC 色谱图Fig.1 HPLC chromatograms of astragaloside A
2.1.2 对照品溶液制备 精密称取黄芪甲苷对照品适量,加甲醇制成 0.559 6 mg/mL 溶液,即得。
2.1.3 供试品溶液制备 精密吸取不同时间点提取液各 15 mL,按照 2015年版 《中国药典》[8-9]方法制备,即得。
2.1.4 线性关系考察 精密量取 “2.1.2”项下对照品溶液 0.1、0.2、0.4、0.6、0.8、1.0 mL,甲醇定容至1 mL,摇匀,在 “2.1.1”项色谱条件下进样10 μL 测定。以黄芪甲苷进样量对数值为横坐标(X),峰面积对数值为纵坐标(Y)进行回归,得方程为Y=1.657 3X-0.197 9(r=0.999 5),在559.58~5 595.8 ng 范围内呈良好的线性关系。
2.2 毛蕊异黄酮-7-O-β-D-葡萄糖苷含有量测定
2.2.1 色谱条件 SunFire©C18色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈-0.2% 甲酸(18 ∶82);检测波长260 nm;体积流量1 mL/min;柱温25 ℃。色谱图见图2。
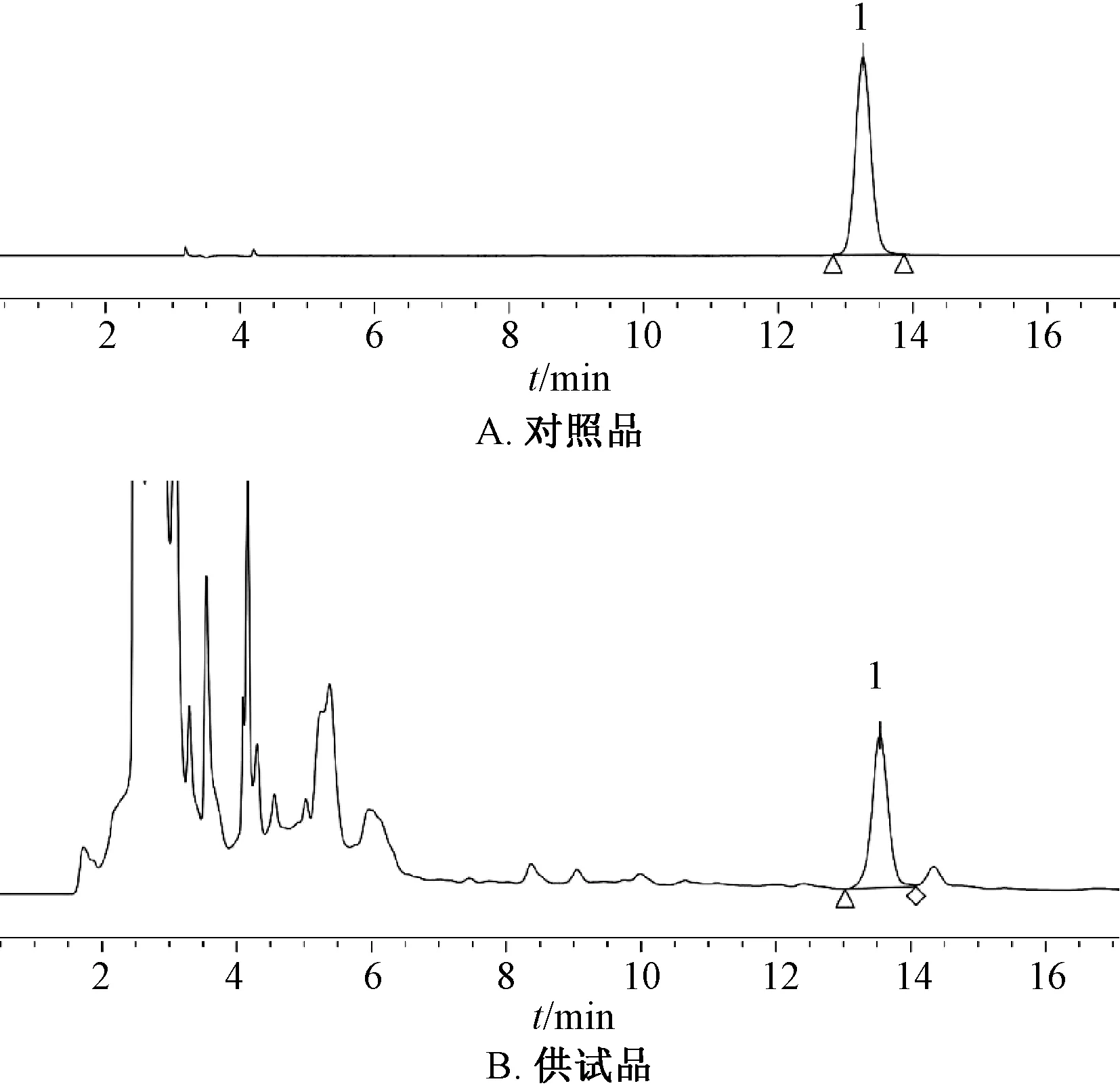
图2 毛蕊异黄酮-7-O-β-D-葡萄糖苷HPLC 色谱图Fig.2 HPLC chromatograms of calycosin-7-O-β-D-glucoside
2.2.2 对照品溶液制备 精密称取毛蕊异黄酮-7-O-β-D-葡萄糖苷对照品适量,加甲醇制成0.110 9 mg/mL 溶液,即得。
2.2.3 供试品溶液制备 量取不同时间点提取液各 1 mL,过滤,即得。
2.2.4 线性关系考察 精密量取 “2.2.2”项下对照品溶液 0.1、0.2、0.4、0.6、0.8、1.0 mL,甲醇定容至1 mL,摇匀,在 “2.2.1”项色谱条件下进样 4 μL 测定。以毛蕊异黄酮-7-O-β-D-葡萄糖苷进样量为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=7 270X-2 310(r=0.999 9),在44.36~443.6 ng 范围内呈良好的线性关系。
2.3 黄芪多糖含有量测定
2.3.1 对照品溶液制备 精密称取D-无水葡萄糖对照品适量,加水制成96 ng/mL 溶液,即得。
2.3.2 供试品溶液制备 精密量取不同时间点提取液适量,置于200 mL 量瓶中,加水定容,摇匀,即得。
2.3.3 最大吸收波长确定 精密量取对照品、供试品溶液各1 mL,置于10 mL 具塞试管中,苯酚-硫酸法[10-11]显色后在 200~700 nm 波长处检测。结果,2种溶液在486 nm 波长处均有最大吸收,故选择其作为检测波长。
2.3.4 线性关系考察 精密量取对照品溶液0.2、0.4、0.5、0.6、0.8、0.9 mL,置于具塞试管中,加水至1.0 mL,按 “2.3.3”项下方法处理,以相应溶剂为空白,于486 nm 波长处测定吸光度。以对照品溶液质量浓度为横坐标(X),吸光度为纵坐标(A)进行回归,得方程为A= 0.064 7X+0.034 5(r=0.999 5),在 2.7~12.3 ng/mL 范围内呈良好的线性关系。
2.4 药材提取和指标测定 称取药材200 g,加入一定体积水加热回流提取4 h,按预先设定的时间点取样,静置至常温后 3 000 r/min 离心 15 min 去除杂质,25 ℃恒温下测定提取液电导率,HPLCDAD 法测定黄芪甲苷含有量,HPLC-PAD 法测定毛蕊异黄酮-7-O-β-D-葡萄糖苷含有量,紫外-可见分光光度法测定黄芪多糖含有量。
2.5 黄芪指标成分提取规律及终点表征 采用电导率测定法,按 “2.4”项下结果绘制电导率-时间、指标成分含有量-时间曲线,结果见图3~5。由图可知,随着提取时间增加,电导率、指标成分含有量变化具有相同规律,均先快速增长,再趋于平稳,最后达到恒定,即在提取过程中的前40 min快速增长,40~200 min 内缓慢增长,趋于平稳,200 min 后达到平稳状态,即在200 min 时提取液中电导率与指标成分含有量均无明显变化,表明黄芪指标成分提取过程达到终点。
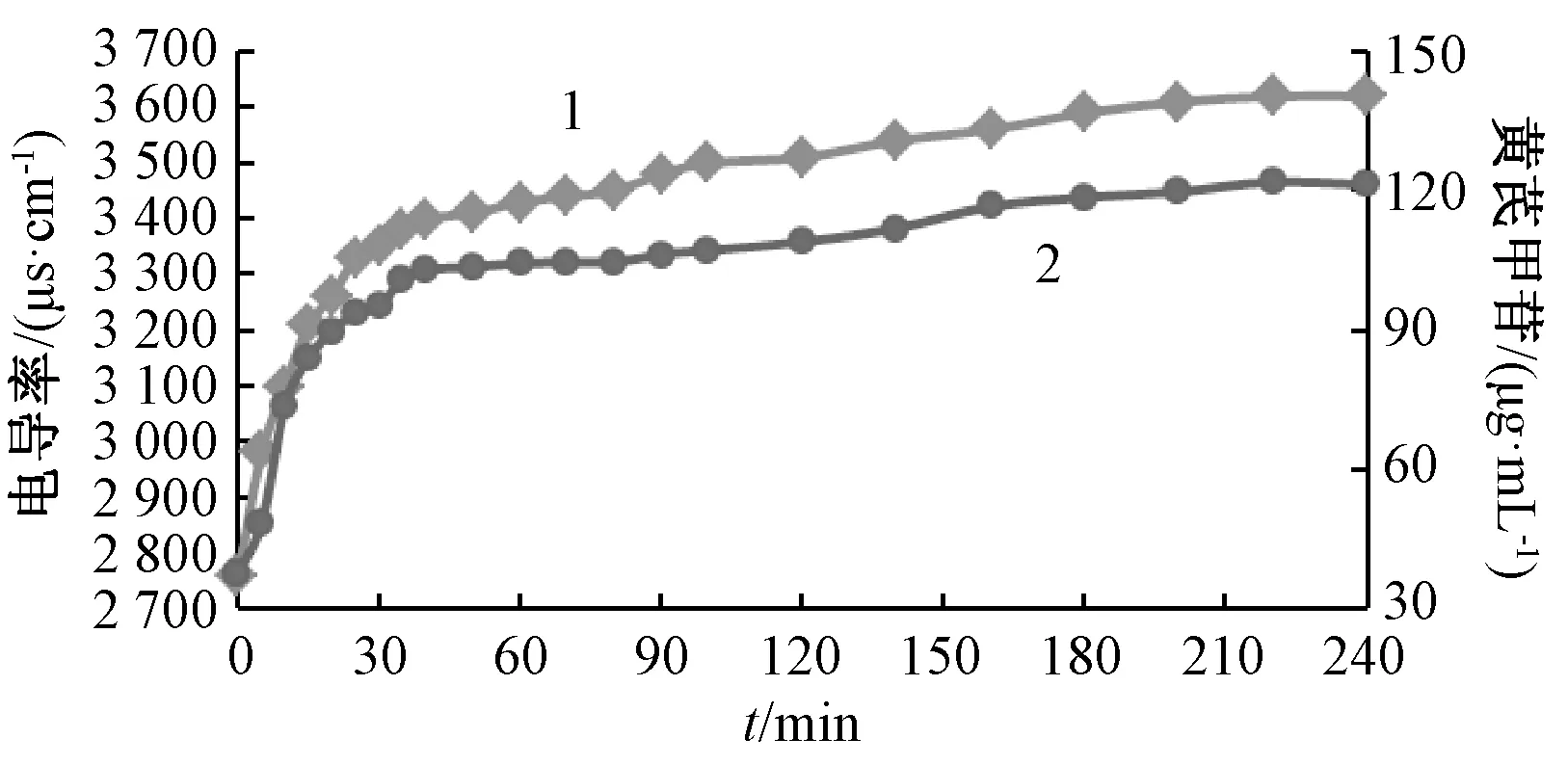
图3 电导率、黄芪甲苷含有量随提取时间的变化Fig.3 Variations of conductivity and astragaloside A content with extraction time
2.6 电导率与黄芪指标成分含有量之间的定量关系 基于 “2.5”项下结果,绘制以指标成分含有量为横坐标,提取液电导率为纵坐标的关系曲线(图6),并对其进行线性相关考察,发现电导率与黄芪甲苷、毛蕊异黄酮-7-O-β-D-葡萄糖苷、黄芪多糖含有量关系曲线的相关系数(r)分别为0.991 9、0.985 4、0.986 8,均呈现出良好的相关性。
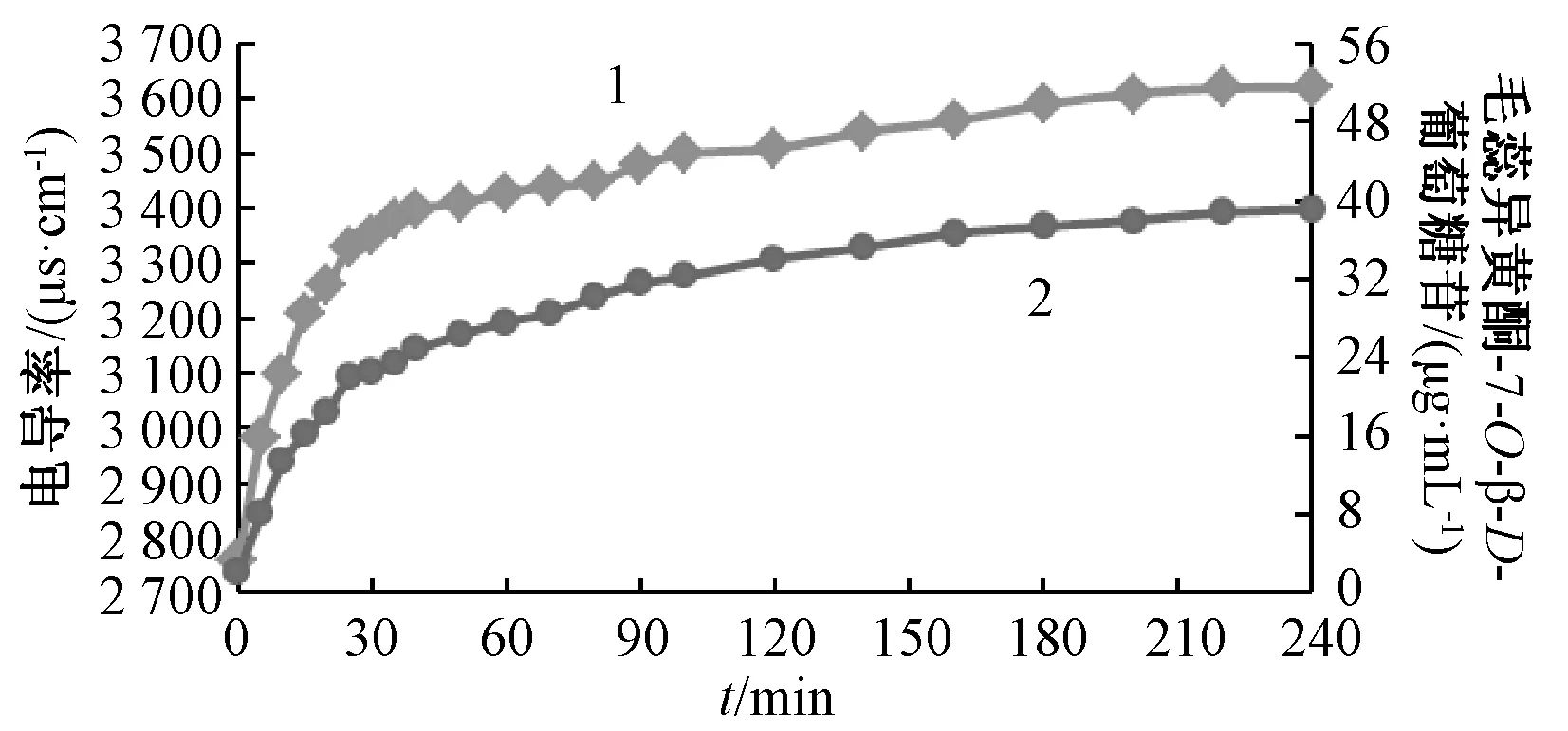
图4 电导率、毛蕊异黄酮-7-O-β-D-葡萄糖苷含有量随提取时间的变化Fig.4 Variations of conductivity and calycosin-7-O-β-D-glucoside content with extraction time
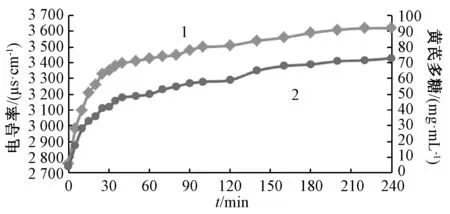
图5 电导率、黄芪多糖含有量随提取时间的变化Fig.5 Variations of conductivity and Astragali Radix polysaccharides content with extraction time

图6 电导率与黄芪甲苷(A)、毛蕊异黄酮-7-O-β-D-葡萄糖苷(B)、黄芪多糖(C)含有量之间的关系Fig.6 Relationships between conductivity and contents of astragaloside A(A),calycosin-7-O-β-D-glucoside(B)and Astragali Radix polysaccharides(C)
3 讨论
纯水中本无电导率,而在提取过程中黄芪细胞中含有的皂苷、黄酮、多糖、无机盐类等成分可透过细胞壁和细胞间质向水中扩散,并以盐的形式存在,使得水显示电信号[12]。本实验发现,随着提取时间增加,提取液中电导率与黄芪指标成分(黄芪甲苷、毛蕊异黄酮-7-O-β-D-葡萄糖苷、黄芪多糖)含有量的变化趋势均是先快速增长后趋于平稳,线性关系良好,故电导率测定法可及时快速、准确直观地反馈上述成分提取过程和终点,解决了常规HPLC 法、紫外-可见分光光度法等存在的样品处理方法复杂、步骤繁多、耗时长、反馈信号延后等问题。
另外,通过关联黄芪提取液中电导率与指标成分含有量之间的关系,发现在提取过程中可采用电导率测定法反馈后者变化规律,并及时指示提取终点,而且该方法同样适用于苦参、红花、侧柏叶、栀子、全蝎、土鳖虫类等药材指标成分的提取[12-15],可为中药提取过程控制提供更多选择。

