浸水处理对采后香菇褐变和质地的影响*
张小燕,吴元元,魏德军,彭 勇**,王庆国,石晶盈
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.山东惠民齐发果蔬有限责任公司,山东 惠民 251700;3.滨州市蔬菜生产办公室,山东 滨州 256600)
香菇(Lentinus edodes) 营养丰富、味道鲜美,富含多种维生素和矿物质,是深受人们喜爱的食用菌之一,具有很高的食用价值和药用价值[1-3]。然而,香菇采收后,贮藏期间易于褐变、开伞、失水皱缩,从而导致品质下降,货架期短,严重制约香菇产业的发展。
褐变是香菇采后常见的问题之一,许多研究表明香菇褐变与多酚氧化酶活性、贮藏条件、处理手段等有关[4-6]。酚类底物、多酚氧化酶和氧气是酶促褐变的3个必要条件,当果蔬衰老或受外界条件的影响时,细胞膜结构发生破坏,在有氧气存在的条件下,酚类代谢酶与底物接触,从而使组织褐变[7]。许多手段如低温贮藏、气调贮藏、调节pH值等可以降低果蔬组织的多酚氧化酶活性,抑制呼吸作用,延长保质期[8-10]。然而,不同果蔬内部多酚氧化酶活性不同,考察香菇多酚氧化酶的活性有助于更深入了解其褐变的机理。
香菇含水量与其贮藏品质密切相关,生产上,香菇含水量高,贮藏时表面褐变严重、易腐烂。而且在销售过程中,不合理的包装也容易导致包装内部湿度过高,导致香菇菌盖表面颜色快速褐变,影响感官品质和商品价值。但对于水分影响香菇褐变和品质的研究较少,是否多酚氧化酶在起作用仍未有清晰的结论。因此为了探索水分对香菇表面褐变和质地的影响,从水分对香菇颜色、酶活性、微结构等方面,初步研究水分导致香菇品质变化的原因,旨在为进一步了解香菇褐变机理提供理论依据。
1 材料与方法
1.1 试验材料
香菇来自于泰安市省庄镇香菇生产基地,采收后进行分拣,选取菇体完整、无损伤、大小均匀、表面颜色一致的香菇进行试验。
1.2 仪器与设备
CR-400色差计,日本柯尼卡美达能公司;T6新世纪紫外分光光度计,上海普析通用仪器有限责任公司;恒温箱,济南科达尔实业有限公司;NMI20-Analyst核磁共振分析仪,上海纽迈电子科技有限公司;Scientz-12N冷冻干燥机,宁波新芝生物科技股份有限公司;JSM-6610LV扫描电子显微镜,日本电子株式会社。
1.3 试验方法
1.3.1 试验设计
选用大小均匀(菌盖直径4 cm~5 cm)、颜色一致的香菇为试验样品,菇体整个放入蒸馏水中浸水处理10 min,以不浸水的香菇为对照。分别在浸水0.5 min、1 min、2 min、5 min、10 min 进行取样,测定表面颜色、含水量、酶活性等指标。
1.3.2 香菇表面色泽的测定
共准备36个香菇,分别在浸水前、浸水0.5 min、1 min、2 min、5 min、10 min进行取样,每次取样6个香菇,用色差计测定香菇表面颜色L值、a值、b值,L值表示亮度,a值代表从红色到绿色,b值代表从蓝色到黄色。每个香菇测定2次,比较各取样时间点香菇表面颜色变化。
1.3.3 香菇重量、含水量、水分状态的测定
共准备36个香菇样品,分成6组,每组6个香菇样品,在浸水前称重,并于浸水后不同时间点取出称重,以重量增加量表示菇体吸水能力。
不同部位含水量的测定,分为未浸水对照和浸水处理2组,以香菇烘干前与烘干后不同部位(外层菌皮、菌盖、菌柄)的重量变化计算香菇样品的含水量。
香菇水分状态测定:选择大小和颜色一致的香菇样品12个,其中6个样品浸水2 min,6个样品未浸水作为对照。把处理后的香菇菌盖切成10 mm×10 mm×5 mm的小块,每个香菇取2块,放入低场核磁共振仪中检测水分状态和分布。参照石芳等[11]的方法,利用核磁共振成像仪中的多脉冲回波序列CPMG测定样品中的横向弛豫时间T2,参数设定为频率 21.0 MHz,回波数 5 000,半回波时间 305 μs,累加采样次数8次。测定完后,反演得到T2反演谱,分析各组分T2弛豫时间及各组分比例M2。
1.3.4 香菇多酚氧化酶活性的测定
参照肖菲等[12]的方法,准确称取各取样点、各部位的香菇菌盖 0.5 g,加入 5 mL 的 0.1 mol·L-1磷酸缓冲液(pH 7.0),匀浆后冰浴搅拌10 min,然后在4℃下10 000 r·min-1离心10 min,取上清液为酶的粗提液,每个处理3次重复。
取 1 mL 的 0.1 mol·L-1邻苯二酚、2 mL 的浓度为 0.2 mol·L-1的 pH 5.0 醋酸缓冲液,混匀后,于50℃保温10 min后加入粗酶液0.5 mL,立即在436 nm下比色测定反应体系吸光度,以每分钟光密度增加0.01为一个酶活力单位。
1.3.5 香菇总酚含量的测定
准确称取香菇菌盖2 g,添加20 mL浓度80%的甲醇进行提取,然后在60℃水浴中提取90 min,再经8 000 r·min-1离心10 min,过滤后沉淀继续用20 mL的80%甲醇水浴浸提90 min,8 000 r·min-1离心10 min,过滤,最后将2次上清液混合,用80%甲醇定容至50 mL。
取1 mL样品提取液,加入1 mL福林酚试剂,震荡混匀后静置3 min,加入1 mL饱和碳酸钠溶液,充分混匀后用浓度为80%甲醇定容至5 mL,置于暗处反应90 min后,测定765 nm处的吸光度,并以没食子酸作标准曲线,计算总酚含量。
1.3.6 香菇的微观结构
冻干法:将对照和浸水2 min的样品分别用冷冻干燥机干燥后,经过喷金处理在扫描电镜下观察。
戊二醛法:将对照和浸水2 min的样品分别用缓冲液漂洗后,用2.5%戊二醛固定30 min后,用0.1 mol·L-1磷酸缓冲液冲洗数次,用 30%、50%、70%、90%和100%乙醇梯度脱水,然后于临界点干燥,经过喷金处理后用扫描电镜观察。
1.4 数据处理
数据采用Excel 2010进行处理,结果以平均值和标准差来表示。
2 结果与分析
2.1 浸水处理对香菇菌盖色泽的影响
浸水处理对香菇菌盖色泽的影响见表1和图1。
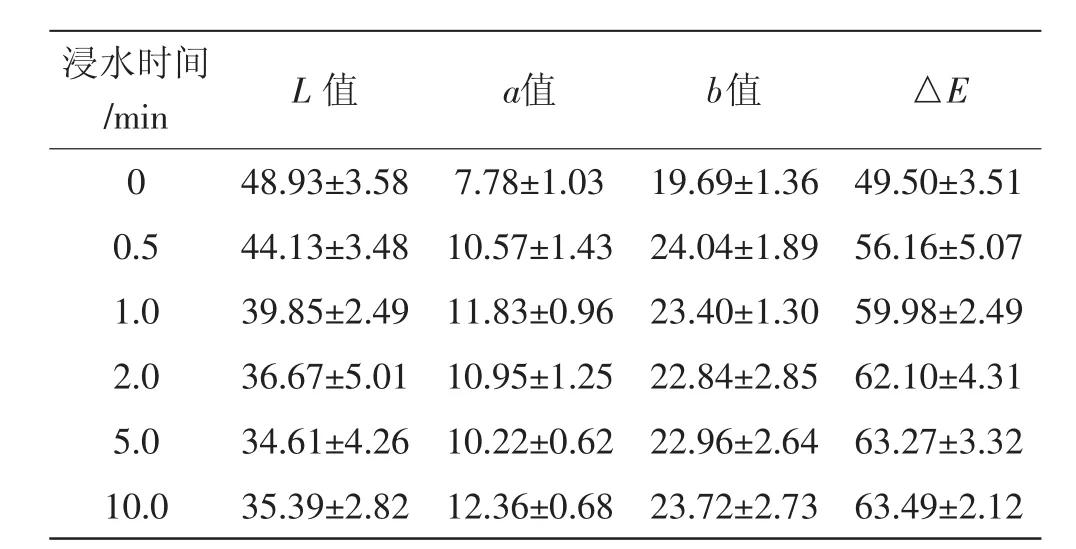
表1 浸水处理对香菇菌盖色泽的影响Tab.1 Effect of soaking on the colour of Lentinus edodes cap
由表1和图1可以看出,随着浸水时间的延长,香菇表面L值逐渐下降。浸水0~2 min内,香菇L值下降迅速;但浸水2 min~10 min,L值变化缓慢,表明浸水短时间内可降低香菇表面亮度。从a值和b值也可以看出,浸水处理后,香菇a值和b值快速增加,1 min内a值和b值变化最明显,之后趋于平缓。从△E可以看出,随着浸水时间的延长,总色差逐渐增加,2 min后变化缓慢。因此,香菇浸水后,水分的进入会导致香菇表面颜色的快速变化,但水分饱和后,颜色变化趋于平缓。

图1 浸水处理对香菇表面色泽的影响(上面为浸水处理2 min,下面为未浸水对照)Fig.1 Effect of soaking treatment on the colour of Lentinus edodes cap(The top row showed the 2 min soaking treatment,the bottom row is the unsoaked control)
2.2 浸水处理对香菇重量和水分存在状态的影响
浸水处理对香菇重量和水分存在状态的影响结果见图2、图3和表2。
由图2可以看出,随着浸水时间的延长,香菇重量逐渐增加,浸水2 min的香菇重量比未浸水时增加了16.94%,并且香菇重量变化有一个由慢变快再变慢的增长过程。0~0.5 min,香菇重量增加缓慢,0.5 min~2 min,香菇重量快速增加,2 min后香菇重量变化缓慢。由图3可看出,香菇不同部位吸水能力存在差异,外层菌皮吸水能力最强,2 min内含水量从86.37%增加到92.75%,其次是菌柄和菌盖。

图2 浸水处理对香菇重量的影响Fig.2 Effect of soaking in water on the weight of Lentinus edodes
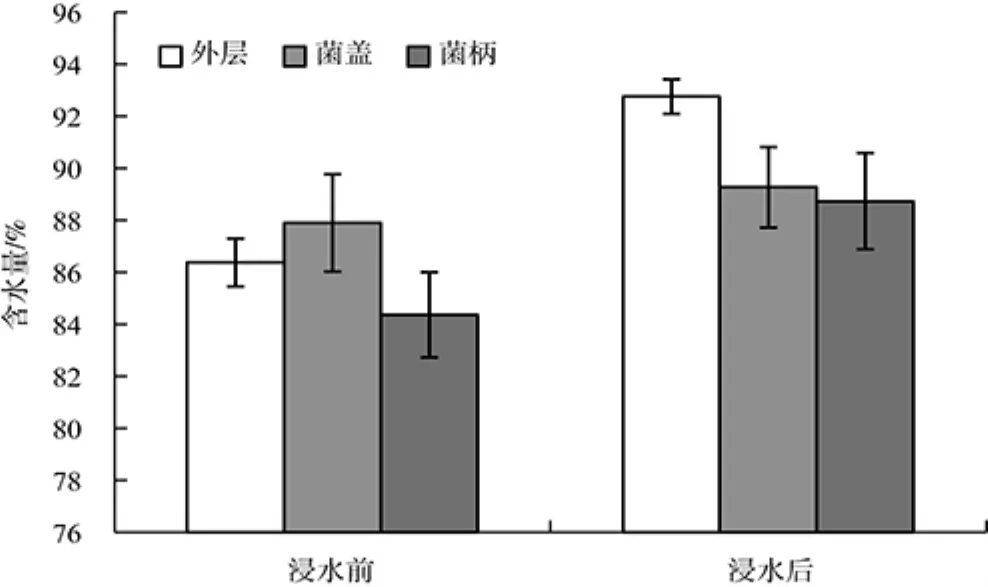
图3 香菇不同部位浸水前后含水量的变化Fig.3 Water content change in different parts of Lentinus edodes before and after soaking
由表2可以看出,香菇中仅含有2种形态的水,半结合水和自由水,这与其他果蔬中通常含有3种形态的水是不一致的[13],可能由于香菇作为食用真菌,菌丝体内部结构简单、水分存在状态单一所致。相比于未浸水香菇,浸水2 min的香菇T22弛豫时间长、M22弛豫组分比例高,半结合水显著增加,显示水分进入了香菇内部,导致内部水分流动性增强;而浸水前后自由水弛豫时间(T23)变化不大,表明浸水对香菇自由水的影响较小。

表2 香菇浸水前后水分存在状态Tab.2 Water status of Lentinus edodes before and after soaking
2.3 浸水处理对香菇多酚氧化酶活性的影响
浸水处理对香菇多酚氧化酶活性的影响结果见图4和图5。

图4 浸水处理对香菇多酚氧化酶活性的影响Fig.4 Effect of soaking in water on the polyphenol oxidase activity of Lentinus edodes
由图4可以看出,浸水处理降低了香菇多酚氧化酶(PPO) 活性,浸水2 min后,香菇PPO活性比处理前下降了52.45%。PPO活性反映了果蔬内部酚类物质氧化的能力,通常情况下,PPO活性越高,果蔬褐变越快。但香菇浸水处理后,虽然表面颜色变化快,但PPO活性显著降低,表明水分对香菇颜色的影响可能不是PPO酶促褐变造成的。
由图5可以看出,香菇不同部位PPO活性不同,以外层菌皮PPO活性最强,其次是菌盖,而菌柄PPO活性最低,仅为菌皮PPO活性的54.36%。浸水处理显著降低香菇的PPO活性,浸水2 min后,菌皮PPO活性比浸水前下降了39.18%,菌盖的PPO活性比浸水前下降了23.01%。

图5 香菇不同部位浸水前后多酚氧化酶活性的变化Fig.5 Polyphenol oxidase activity of different parts of Lentinus edodes before and after soaking
2.4 浸水处理对香菇总酚含量的影响
浸水处理对香菇总酚含量的影响结果见图6。
酚类物质是多酚氧化酶的重要底物,检测香菇内总酚含量有助于更好地判断香菇褐变原因[12]。由图6 可知,香菇在未浸水时总酚含量为 0.045 μg·mg-1,随着浸水时间的延长,香菇总酚含量呈现下降的趋势,处理 10 min 后,香菇中总酚含量为 0.039 μg·mg-1。
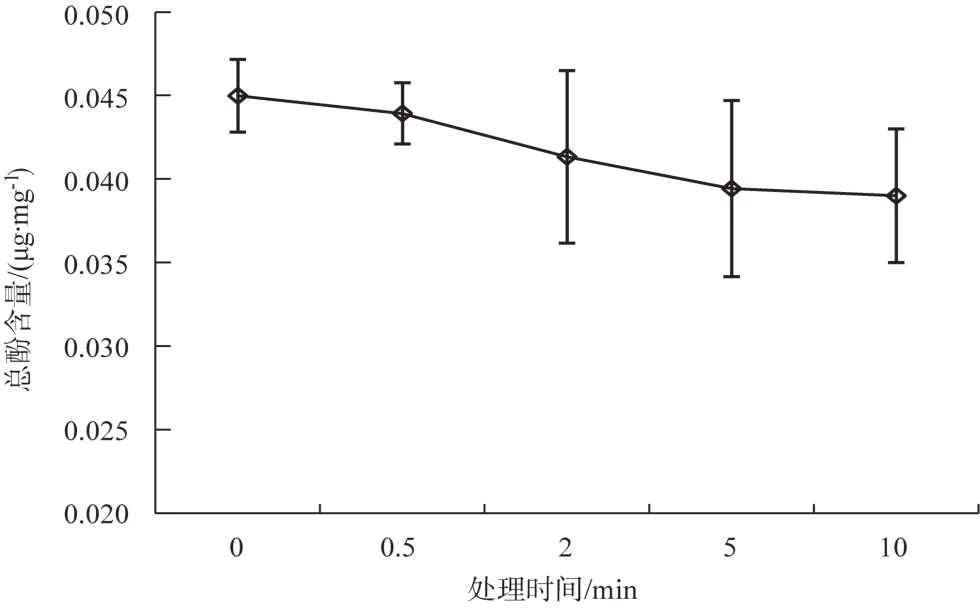
图6 浸水处理对香菇总酚含量的影响Fig.6 Effect of soaking in water on the total phenol content of Lentinus edodes
2.5 浸水处理对香菇微观结构的影响
浸水处理对香菇微观结构的影响结果见图7。
由图7可以看出,通过冻干法和戊二醛法观察到的香菇表面结构略有差异,冻干法观察的浸水前香菇表面菌丝孔隙较多,而浸水后香菇表面菌丝孔隙较少。这可能由于香菇表面浸水后,水分充满香菇表面,进入内部,导致香菇表面菌丝之间发生重叠,表面孔隙较少。与冻干法不同,浸水前后,戊二醛法观察到的香菇表面结构差异不大,这可能由于戊二醛法测定时,香菇表面经过戊二醛的浸泡依然会变色。
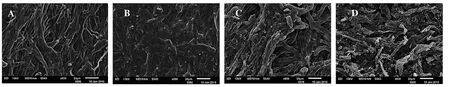
图7 浸水处理对香菇表面微观结构的影响(800倍下扫描电镜观察)Fig.7 Effect of soaking in water on the microstructure of Lentinus edodes(800 fold SEM observation)
3 讨论与结论
水分是保证香菇品质的重要成分之一,也是导致采后香菇腐烂和褐变的重要因素。本试验研究结果显示,外层菌皮中的多酚氧化酶活性最高,菌柄中其活性最低。香菇浸水处理后,表面亮度快速下降,a值和b值显著增加,然而,浸水处理导致香菇多酚氧化酶活性快速下降。食用菌中存在复杂的氧化酶体系,催化菇体褐变的主要酶类是多酚氧化酶,根据作用原理和底物的差异,多酚氧化酶又分为酪氨酸酶、双酚氧化酶和漆酶[7,14]。吴进菊等[10]研究表明不同食用菌中多酚氧化酶活性不同,食用菌中以双孢蘑菇多酚氧化酶活性最高,香菇中多酚氧化酶活性仅有20 U·mL-1。刘雅嘉等[4]也发现香菇多酚氧化酶活性受多巴、没食子酸和邻苯二酚等底物种类和环境条件的影响。因此,浸水对香菇表面颜色的影响可能不是多酚氧化酶作用的结果。
浸水也影响香菇的质量和微观结构,本试验结果发现,浸水处理后,香菇重量呈现先慢后快再变慢的变化趋势,浸水0.5 min~2 min时间段是香菇重量变化最快的阶段。同时香菇不同部位吸水能力不同,外层菌皮吸水能力最强,其次是菌柄和菌盖。浸水处理可以影响农产品的品质,通过低场核磁共振可以快速检测组织内部水分状态和分布[13,15],本试验发现浸水处理导致香菇内部水分状态发生变化,相比于对照,浸水2 min的香菇T22弛豫时间延长、M22弛豫组分比例高。石芳等[11]研究干香菇复水过程中,半结合水(T22)是主要的影响因素,而自由水(T23)在复水完成后变化不大,与本结果半结合水起主要作用是相似的。本试验结果显示新鲜香菇中主要是半结合水和自由水,浸水导致半结合水显著增加,表明浸水后水分可快速进入香菇内部。
香菇属于多细胞真菌,由大量菌丝构成[12],从微观结构上,香菇外层菌皮中分布有大量菌丝,并且,香菇吸水能力的差异与微观结构密切相关。本试验结果发现浸水处理导致了表面菌丝发生折叠,这可能是浸水导致菌皮褐变的主要原因。本试验结果为研究水分在香菇品质上的影响提供了一定参考依据,然而,对于香菇采后水分变化、褐变产生的机理,还需要开展广泛的研究。

