7株野生香菇菌株的特性及出菇试验*
马 宏,张根伟,刘 萌,刘昆昂,李书生,尹淑丽,刘振国,付艳菊
(河北省科学院生物研究所,河北 石家庄 050081)
香菇(Lentinus edodesBerk.Pegler),又名香蕈、香信等,是一种著名的食药兼用菌[1]。我国地域辽阔,大部分地区均有野生香菇的分布,是全球香菇种质资源最丰富、遗传多样性最高的区域[2-3],但是在栽培品种的遗传种质资源中利用的却相对较少。野生香菇的研究、开发和利用,充分挖掘野生香菇的优良品质,对香菇的育种工作将产生较大的促进作用。
浙江龙泉属亚热带季风气候区,其海拔最高的凤阳山,现记录有食用真菌95种,是人类最早认知香菇、驯化香菇的贡献地[4]。本研究在凤阳山采集了14株野生香菇菌株,通过拮抗实验确定了7株菌株。ITS鉴定7株菌株为香菇菌株,并进行了菌丝生长速度、木质素酶活性纤维素酶活性、抗木霉能力、出菇情况的试验,为野生香菇的开发利用奠定了基础。
1 材料与方法
1.1 供试菌株
2017年3月,在浙江龙泉市凤阳山进行了野生香菇采集、分离,得到14个野生香菇子实体,并进行了菌株分离。经拮抗试验,初步鉴定7株为野生香菇菌株(Lentinula edodes),命名为野香1(YS1)、野香2(YS2)、野香3(YS3)、野香4(YS4)、野香5(YS5)、野香 6(YS6) 和野香 7(YS7)。对照菌株为灵仙1号,硬质、中早熟、中型菇。
1.2 培养基
改良PDA培养基:马铃薯20%、葡萄糖2%、木屑粉1%、磷酸二氢钾0.3%、硫酸镁0.15%、蛋白胨0.2%、琼脂1.2%,pH自然;木屑栽培袋配方:木屑78%、麸皮20%、蔗糖1%、CaCO31%,含水量62%,pH自然;出菇栽培料配方:杂木屑85%、麸皮15%,pH自然;木质素酶显色培养基:梨木屑1%煮汁、愈创木酚0.02%、琼脂1.2%;纤维素酶显色培养基:微晶纤维素0.2%、刚果红0.02%、琼脂1.2%。
1.3 香菇菌株的DNA提取和ITS分子鉴定
1.3.1 基因组 DNA 的提取
25℃条件下,野生香菇菌株在PDA培养基上培养20 d,称取菌丝0.5 g液氮研磨,基因组DNA采用试剂盒提取,具体方法见天根生化科技(北京)有限公司“植物基因组DNA提取试剂盒(离心柱型)”使用说明书。
1.3.2 ITS-PCR 扩增
采用真菌ITS序列通用引物[5]ITS1(5’-TCCG TAGGTGAACCTGCGG-3’) 和 ITS4 (5’-TCCTC CGCTTATTGATATGC-3’) 对样品进行扩增。PCR反应体系 (50 μL):5 μL 10×PCR Buffer、4 μL dNTP、引物(10 μmol·L-1)各1 μL、1 μL Taq DNA聚合酶、2 μL DNA模板,用水补至50 μL。PCR扩增条件:94℃预变性2 min,94℃变性40 s,52℃复性1 min,72℃延伸 1 min,共 35个循环,72℃保温 5 min,4℃保存。将PCR产物用0.8%的琼脂糖凝胶电泳进行检测。
PCR产物经纯化后连接于pEASY-T3载体,挑选阳性克隆送到北京六合华大基因科技有限公司测序。纯化和连接分别按EasyPure PCR Purification Kit试剂盒和pEASY-T3 Cloning Vector(TRANS) 试剂盒说明书操作。
1.3.3 DNA序列比对和系统发育树的构建
测序获得的rDNA ITS序列使用GenBank中的BLAST工具软件进行同源DNA序列搜索比对。利用MEGA 6.0软件构建NJ系统发育树,使用靴带自检法检验(bootstrap)发育树1 000次,以此来判断各处的可信度。
1.4 菌丝生长试验
PDA试管试验:用打孔器取直径5 mm的菌饼,接种到3个改良PDA培养基试管,25℃恒温培养,3 d后每隔12 h测量、记录菌丝生长速度,连续记录10次。菌丝长满试管后,依据菌丝生长浓密程度,将对照菌株的菌丝密度用“+++”表示,野生菌株与对照菌株相比,“+”号越多,表明菌丝生长越浓密,所有观察均在无菌条件下进行。
木屑栽培袋试验:用打孔器取直径5 mm的菌饼,接种到5个木屑栽培袋,25℃恒温培养,3 d后每隔12 h测量、记录菌丝生长速度,连续记录10次。菌丝长满木屑栽培袋后记录满袋时间。
1.5 木质素酶活性和纤维素酶活性测定
利用变色圈法测定木质素酶活性和纤维素酶活性。用打孔器取直径5 mm的菌饼,接入显色培养基中,分别在5℃、10℃、15℃、20℃、25℃、30℃培养3 d,测定变色圈直径[6]。
1.6 抗木霉能力试验
使用直径90 mm的培养皿,每皿用定量蠕动泵定量加入35 mL PDA培养基。用直径为0.5 cm的打孔器打孔制备供试菌株菌饼,接种到距离培养皿中心2.5 cm处,25℃培养4 d,对称的接入木霉菌饼,在25℃条件下培养3 d。测量香菇菌株菌落生长半径、抑制带宽度,并且持续观察抑制带的颜色、大小变化。相对抑菌能力(P,%)公式为:

式中:R表示供试菌株菌落半径;R0表示对照菌株(灵仙1号)菌落半径。
1.7 出菇试验
2017年7月25日,采用聚丙烯塑料袋(17 cm×33 cm) 装料,每袋约装干料1 000 g。高温灭菌(115℃) 8 h,待料温降至25℃以下,按无菌操作规程4穴接种,各接100袋,常规管理,转色完成后喷水、保湿出菇。观察出菇情况,并记录满袋时间、出菇期、出菇温度、菌盖的厚度和直径、菌柄的柄长和柄粗。
1.8 统计方法
所有试验数据利用Excel2007中AVERAGE和STDEVP函数计算样本的均值和标准差,利用SPSS 17.0软件中LSD进行多重比较。
2 结果与分析
2.1 野生香菇菌株的ITS鉴定
利用BLAST工具软件比对发现,测序结果与香菇的序列相似性为99%以上,表明分离到的菌株为香菇。根据杨瑞恒等[2]的研究结果,Blast比对的结果全部集中在Ⅰa和Ⅰb分支中,为了确定分离到的7株野生香菇是否具有差异性,根据分支、菌株来源以及Blast比对结果的覆盖率,在Ⅰa和Ⅰb分支中各选取了4个野生香菇菌株。同时,选取了香菇栽培菌株L9和金针菇菌株F-1450(Flammulina velutipesF-1450) 共同建树分析,如表1所示。基于ITS序列构建野生香菇菌株的NJ系统发育树见图1。

表1 构建系统发育树所用菌株Tab.1 Strains used for phylogenetic trees
如图1所示,选取的8个野生香菇菌株与杨瑞恒等[2]的研究结果一致,分为了2个分支,香菇栽培菌株L9分布在Ⅰa分支,与LMLHA25亲缘关系最近,菌株YS6分布在Ⅰb分支,与SHX006亲缘关系最近。其他6株野生香菇菌株既没有分布在Ⅰa和Ⅰb分支,也没有形成一个大的分支,亲缘关系逐级递增,菌株YS3与其他菌株亲缘关系最远。Flammulina velutipesF-1450作为外围,与上述7个野生香菇菌株亲缘关系最远。说明分离到的7株野生香菇菌株与已报到的野生香菇菌株具有遗传差异性。

图1 基于ITS序列构建野生香菇菌株的NJ系统发育树Fig.1 Construction of NJ phylogenetic tree of wild Lentinus edodes strain based on ITS sequence
2.2 野生香菇菌株菌丝生长特性
分别测定在PDA试管和木屑栽培袋中栽培的菌株的菌丝生长情况,结果如表2所示。

表2 野生香菇菌株菌丝生长特性Tab.2 Growth characteristics of wild Lentinus edodes mycelium
表2结果表明,野生香菇菌株菌丝在试管中的生长速度以及在栽培袋中的生长速度和满袋时间,都显著地高于对照菌株灵仙1号。对7个野生香菇菌株比较发现,菌株YS1的菌丝生长速度最快,菌丝浓密,菌株YS3的菌丝生长速度最慢,菌丝较稀疏。
2.3 野生香菇菌株菌丝的酶活特性
2.3.1 木质素酶活性
以愈创木酚为底物,在定量培养皿中测定不同温度时的变色反应圈,以表示木质素酶活性,结果见图2。
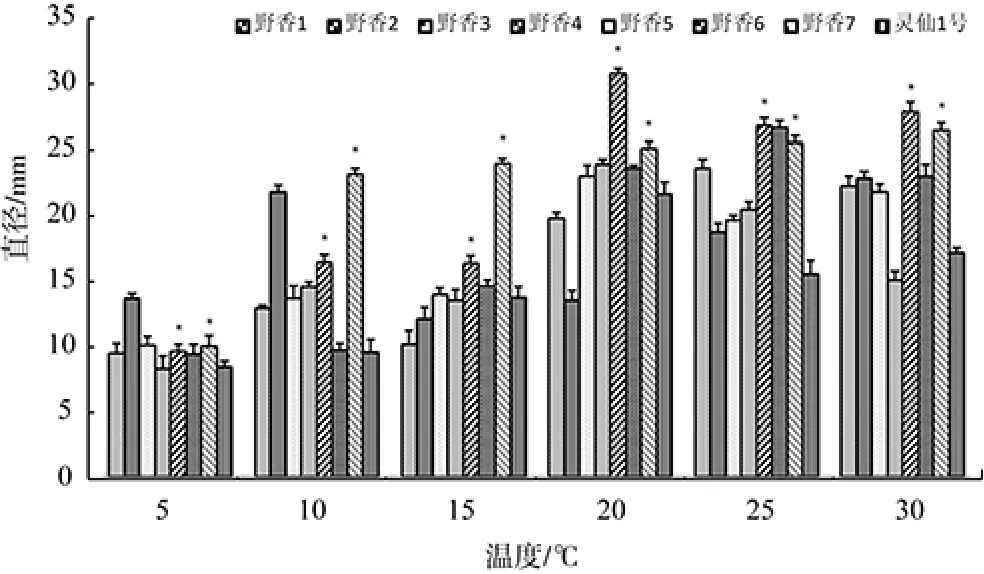
图2 野生香菇菌株菌丝不同温度下的木质素酶活性Fig.2 Lignin enzyme activity of wild Lentinus edodes mycelium at different temperatures
图2结果表明,5℃~15℃低温条件下,菌株YS3、YS4、YS5、YS6的木质素酶活性均显著高于对照菌株灵仙1号,酶活性由高到低依次为菌株YS4、YS5、YS6、YS3。20℃~30℃高温条件下,菌株 YS4、YS7的木质素酶活性均显著高于灵仙1号。总体上看,菌株YS4和YS7的木质素酶活性要优于灵仙1号。
2.3.2 纤维素酶活性
以微晶纤维素为底物,刚果红染色,在定量培养皿中测定不同温度时的变色反应圈,以表示纤维素酶活性,结果见图3。

图3 野生香菇菌株菌丝不同温度下的纤维素酶活Fig.3 Cellulase activity of wild Lentinus edodes mycelium at different temperatures
图3结果表明,低温和高温条件下纤维素酶活性均显著高于对照菌株的菌株有YS7、YS5、YS6、YS3。其中,5℃~15℃低温条件下,纤维素酶活性最高的是菌株YS7;20℃~30℃高温条件下,纤维素酶活性最高的是菌株YS5。菌株YS5和YS7表现出较高的纤维素酶活特性。
2.4 野生香菇菌株菌丝抗木霉能力特性
抗木霉的能力通过拮抗试验进行确定,即测量香菇菌株和木霉的菌落半径,计算抑菌能力,观察2个菌落交接处抑制带宽度和颜色。具体结果见表3。

表3 野生香菇菌株的抗木霉能力Tab.3 Anti Trichoderma ability of wild Lentinus edodes strain
菌株YS1、YS2、YS3和YS6抗木霉的抑菌能力显著高于对照菌株灵仙1号,提高20%以上。综合比较抑制带宽度和颜色,菌株YS1、YS2、YS4、YS5和YS6的抑制带窄、颜色深,抗木霉能力显著强于菌株808和灵仙1号。
2.5 野生香菇菌株出菇试验
野生香菇菌株出菇试验结果见表4。
如表4所示,只有菌株YS4、YS5、YS6能够出菇,均为小型菇。菌株YS5中间有明显凸起,而且在12月份依然出菇,说明菌株YS5耐低温。其他菌株直到12月底依然不能出菇,可能因为这些菌株是晚熟品种或者有病毒感染,也可能是出菇条件不合适,目前具体原因不明。
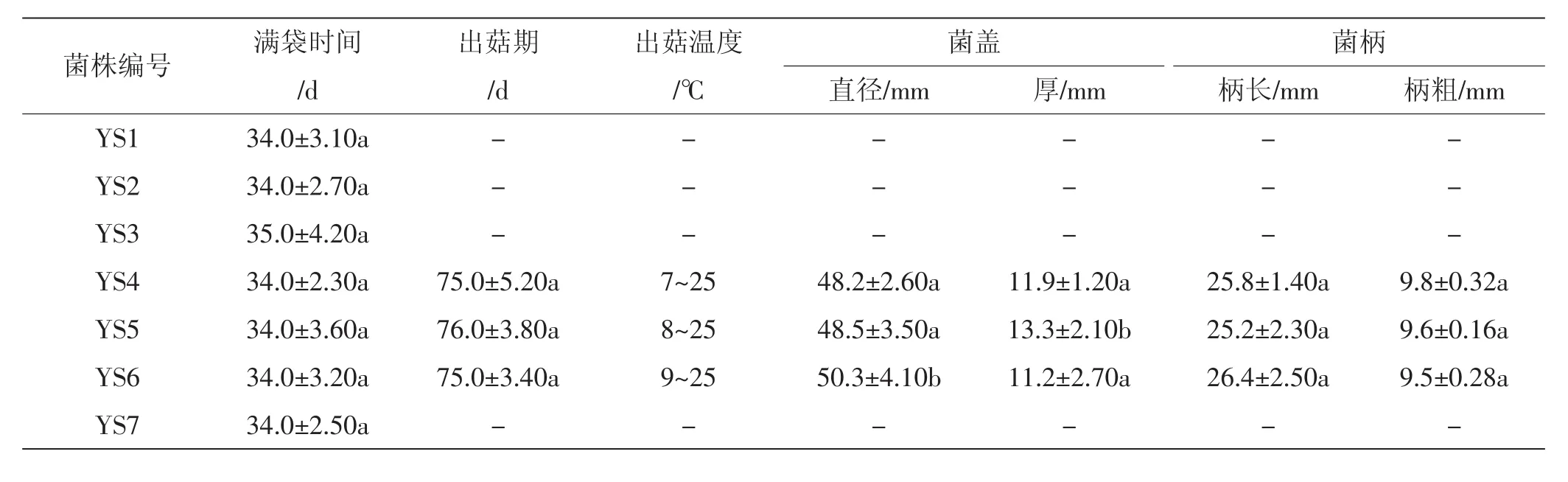
表4 野生香菇出菇试验结果Tab.4 Wild Letinous edodes mushroom test results
3 结论
种质资源作为基础生产资料,对食用菌的产量、质量以及销量起着关键的作用。比如,河北省平泉县利用科技力量栽培的错季香菇,产量居全国单品第一[7-8]。
本研究采集分离的7株野生香菇栽培,在分子水平和菌株特性方面都具有遗传差异性。利用ITS序列构建的NJ系统发育树,7株野生香菇没有聚为一支。在菌株的特性和出菇试验中,菌株YS1的菌丝生长最快,菌株YS7的木质素酶活性和纤维素酶活性都相对较高,菌株YS2的抗木霉能力强,菌株YS5出菇耐低温。此外,本研究结果说明,自然条件下,野生香菇孢子通过风力与野生香菇菌丝进行单单或单双杂交,大量收集同一地区的野生香菇菌株,也能获得具有特异性的优良种质资源[9]。
之前的研究结果表明中国大陆的香菇分成谱系I和谱系V[2-3,10-11],谱系I聚集了多数的香菇(Lentinus edodes)菌株。本研究选取了部分已报道的野生香菇菌株与分离到的7株野生香菇菌株,利用Neighbor-Joining构建系统发育树,只有菌株YS6分布在Ⅰb分支中。添加谱系Ⅱ~Ⅳ和谱系Ⅵ~Ⅷ中的野生香菇菌株构建系统发育树,其余6株野生香菇菌株也未分布在Ib分支中(数据略),说明这六株野生香菇菌株与已报道的野生香菇菌株具有一定的遗传差异性,可以为野生香菇的遗传谱系研究提供参考。

