右美托咪定对妇科腹腔镜手术患者血浆胃动素及术后不良反应的影响
徐保芹,王 洁,张 超,韩 兰,吴丽丽,姚 明,曹 晖
0 引 言
术后恶心呕吐是指术后24 h内发生的任何恶心、干呕及呕吐的现象[1-2],是临床上较为常见的术后并发症。术后恶心呕吐严重者会导致脱水、电解质、酸碱平衡紊乱、伤口愈合延迟甚至破裂等,延长住院天数,增加医疗费用。腹腔镜手术作为术后恶心呕吐的高危因素之一,术后恶心呕吐的发生率高达53%~72%,明显高于非腹腔镜手术[3-5]。近年来有研究发现血浆胃动素能够诱发消化期间移行复合运动,加快胃对于内容物的排空进程,可能与术后恶心呕吐的发生有关[6]。而盐酸右美托咪定(dexmedetomidine,DEX)是一种新型高选择性α2肾上腺能受体激动剂,具有镇静镇痛、抗焦虑、抗交感、降低围术期应激反应、减少麻醉药物用量和提高麻醉质量等作用,且无明显呼吸抑制作用[7]。本研究旨在观察DEX对妇科腹腔镜手术患者血浆胃动素及术后恶心呕吐等不良反应的影响。
1 资料与方法
1.1临床资料选择2017年6月至2018年6月南通大学附属吴江医院80例择期在全麻下行妇科腹腔镜下手术患者。根据术中及静脉自控镇痛(Patient-Controlled Intravenous Analgesia,PCIA)药物种类将患者随机分为:右美托咪定组(术毕40 min前泵注DEX 0.5µg/kg,术后PCIA予DEX 2.5µg/kg+舒芬太尼2.5µg/kg)、对照组(仅术毕前40 min静脉泵注等量的等渗盐水10 min,术后PCIA配方为舒芬太尼2.5µg/kg),每组40例。纳入标准:①年龄18~65岁、BMI 19~25kg/m2;②ASAⅠ~Ⅱ级;③无长期服用抗呕吐药物史、无吸烟史、无消化道疾病史、糖尿病、晕动病史。排除标准:①术前5d内有过恶心呕吐史;②使用阿片类药物者;③各种原因造成手术时间>2h;④术前心电图显示心动过缓或II以上方式传导阻滞者;⑤术前明确有对DEX或本研究中使用的任何药物过敏者;⑥患者拒绝使用PCIA及无法理解视觉模拟评分法(Visual Analogue Scale/Score,VAS)者。2组患者一般资料比较差异无统计学意义(P>0.05),见表1。本研究经过医院伦理委员会批准(批准号:wj2017089),患者均签署知情同意书。

表1 妇科腹腔镜下手术患者一般资料的比较(xˉ±s)Table 1 Clinical data on the two groups of patients undergoing gynecologic laparoscopic surgery(xˉ±s)
1.2分组情况所有患者术前常规禁食禁饮。入室后常规监测心率、血压、心电图、脉氧饱和度(Pulse oxygen saturation,SpO2)、脑电双频谱指数(Bispectral index,BIS)。诱导时依次给予咪达唑仑0.05 mg/kg、舒芬太尼0.5 µg/kg、丙泊酚1.5~2.0 mg/kg,顺式阿曲库铵0.15 mg/kg;行气管插管后,术中持续泵注丙泊酚4~6 mg/kg·h和瑞芬太尼0.1~0.3µg/kg·min维持麻醉。除手术结束前30 min给予阿扎司琼10 mg止吐外,不再使用其他止吐药。术毕前40 min,右美托咪定组静脉泵注DEX 0.5µg/kg 10 min;对照组给与等量的等渗盐水。2组患者术后均接PCIA,配方右美托咪定组为DEX 2.5µg/kg+舒芬太尼2.5µg/kg;对照组为舒芬太尼2.5µg/kg。均用等渗盐水稀释至125 mL,背景输注量2 mL/h,自控量为1 mL,锁定时间15 min。在镇痛期间,静息VAS≥4分或活动VAS≥5分者,静脉自控镇痛1次,自控镇痛效果不佳者,静注镇痛泵液2 mL补救,直至VAS≤3分。
1.3观察指标①一般情况:年龄、BMI、ASA分级、气腹、手术及麻醉时间、术中舒芬太尼使用量;②患者术毕自主呼吸恢复时间、睁眼时间、拔除气管拔管时间、定向力恢复时间;③患者拔管前后呛咳评分(1分:无呛咳;2分:轻度、单次呛咳;3分:中度,多次呛咳,非连续性,持续时间≤5 s;4 分:重度,连续呛咳,持续时间>5 s[8])和镇静-躁动评分(Self-Rating Anxiety Scale,SAS),1分:呼之不应;2分:深度镇静;3分:镇静易唤醒;4分,安静合作;5分:躁动能劝止;6分:躁动不能劝止;7分:过度躁动;若 SAS≥6分为躁动[9]);④分别在术前1 d和术后2 h、24 h、48 h测定血浆胃动素含量;⑤患者术后2h、24 h及48 h病人自控镇痛(patient controlled analgesia,PCA)按压次数、舒芬太尼累积使用量及术后恶心呕吐发生率及严重程度(疼痛数字模拟量表对患者进行恶心呕吐程度评估,0分为无恶心呕吐,10分为剧烈恶心呕吐;其中,疼痛数字模拟量表评分≤3分为轻度,疼痛数字模拟量表评分≥4分为中重度[10];在相应时间段内,患者恶心呕吐多次时按照一次计算,疼痛数字模拟量表评分按最高分记录);⑥术后寒战、烦躁、口干、心动过缓、高血压、低血压等不良反应的发生情况。
1.4统计学分析采用SPSS 13.0软件进行统计分析。正态分布的计量资料以均数和标准差(xˉ±s)表示,组间比较采用单因素方差分析;非正态分布的计量资料采用[中位数(四分位间距)]表示,组间比较采用秩和检验;计数资料采用%表示,组间比较采用χ2检验、校正χ2检验和Fisher确切概率法。以P≤0.05为差异有统计学意义。
2 结 果
2.1术毕苏醒时间的比较2组自主呼吸恢复时间、呼之睁眼时间等差异无统计学意义(P>0.05),见表2。
2.2拔管前后呛咳评分及SAS评分的比较右美托咪定组拔管前后呛咳评分及SAS评分较对照组明显降低(P<0.05),见表3。
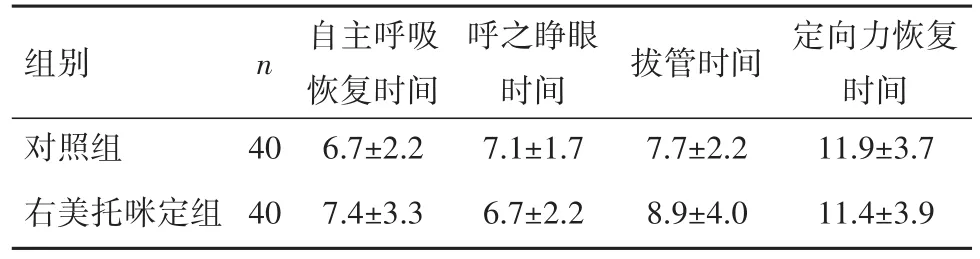
表2 妇科腹腔镜手术患者苏醒时间的比较(xˉ±s,min)Table 2 Time of recovery from anesthesia in the two groups of patients undergoing gynecologic laparoscopic surgery(xˉ±s,min)

表3 妇科腹腔镜下手术患者呛咳评分和SAS评分的比较[M(P25,P75),分]Table 3 Pre-and post-extubation cough and SAS scores of the two groups of patients undergoing gynecologic laparoscopic surgery[M(P25,P75),score]
2.3不同时间点血浆胃动素浓度的变化2组血浆胃动素浓度在术后2 h、24 h、48 h较术前均升高(P<0.05)。右美托咪定组术后2 h、24 h血浆胃动素浓度较对照组显著降低(P<0.05),术后48 h差异无统计学意义(P>0.05)。见表4。
2.4术后不同时间PCA按压次数及舒芬太尼累计使用量的比较右美托咪定组术后2 h、24 h PCA按压次数及舒芬太尼累计使用量较对照组明显减少(P<0.05);术后48h差异无统计学意义(P>0.05),见表5。
2.5术后恶心呕吐的发生率及严重程度比较右美托咪定组术后2 h、24 h术后恶心呕吐的发生率及中重度发生率较对照组明显降低(P<0.05),术后 48 h比较差异无统计学意义(P>0.05)。见表6。
2.6术后不良反应比较右美托咪定组术后寒颤、烦躁发生率明显小于对照组,但术后口干及心动过缓发生率明显高于对照组(P<0.05),见表7。

表4 妇科腹腔镜手术患者不同时间点血浆胃动素浓度的变化(xˉ±s,pg/mL)Table 4 MTL concentration in the two groups of patients before and after gynecologic laparoscopic surgery(xˉ±s,pg/mL)
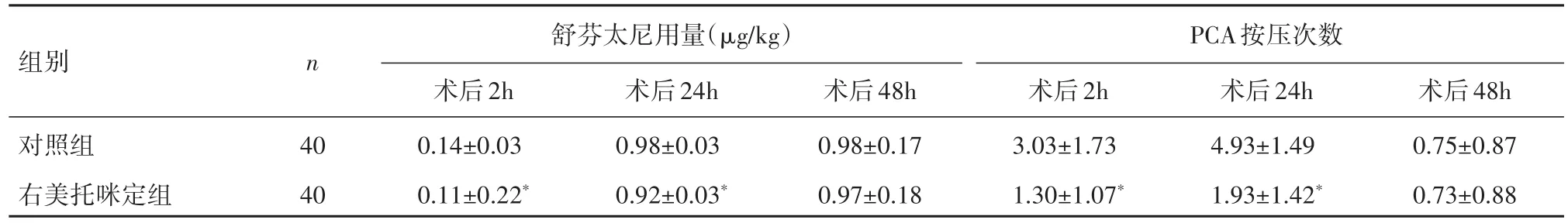
表5 妇科腹腔镜下手术患者不同时间段内PCA按压次数及舒芬太尼累计的用量比较(xˉ±s)Table 5 Frequency of PCA compression in the two groups of patients at different time points after gynecologic laparoscopic surgery(xˉ±s)

表6 妇科腹腔镜下手术患者术后恶心呕吐的发生情况的比较[n(%)]Table 6 Comparison of the incidence of PONV between the two groups[n(%)]

表7 妇科腹腔镜手术患者术后不良反应比较[n(%)]Table 7 Incidence of postoperative complications in the two groups of patients undergoing gynecologic laparoscopic surgery[n(%)]
3 讨 论
腹腔镜手术已经广泛应用于临床各级各类手术,具有切口小、术野清晰、探查范围广、术后疼痛轻微、住院天数短等优点,但是手术过程中的人工气腹及手术体位影响患者的病理生理,致术后恶心呕吐的发生率增加,影响了患者术后康复。术后恶心呕吐的发生与多个因素相关,为减少混杂因素的影响,本研究选择的对象为女性腹腔镜手术患者,在年龄、体重指数、ASA分级、手术时间、麻醉时间等一般资料之间差异无统计学意义(P<0.05)。
本研究结果右美托咪定组术后2h、24h术后恶心呕吐的发生率及中重度发生率较对照组明显降低(P<0.05)。术后恶心呕吐发生可能与以下几个方面有关:①人工气腹后腹压增高刺激胃的机械感受器及手术操作过程中的牵拉反应刺激迷走神经和内脏传入神经,激活中枢神经系统的呕吐中枢,从而诱发恶心呕吐;手术过程中的头低脚高位及腹内高压导致上腔静脉回流障碍,间接导致脑水肿,也可能导致术后难以纠正的恶心呕吐[11];②人工气腹后,大量CO2通过腹膜吸收入血,导致的高碳酸血症间接地刺激颈动脉窦和主动脉化学感受器,引起交感神经兴奋,使得血液儿茶酚胺、醛固酮和皮质醇增加,引起外周血管阻力增加,胃粘膜血流量减少,造成胃粘膜缺血,导致局部细胞的损伤而使分泌胃动素的M0(嗜铬细胞)破坏、崩解,导致血浆胃动素大量释放而引起术后恶心呕吐[12];③麻醉诱导及术后PCIA选用了作用时间较长的舒芬太尼。阿片类药物是临床上最常用的镇痛药物,但阿片类药物除了可以作用于呕吐中枢µ受体,还可激动µ、k和阿片受体刺激耳蜗前庭,进而引起恶心呕吐[13-14]。
本研究结果表明,2组患者术后2h、24h、48h血浆胃动素浓度均较术前增加,因此我们认为手术与麻醉可能引起血浆胃动素水平升高。而右美托咪定组术后2h、24h血浆胃动素浓度、PCA按压次数及舒芬太尼的累积使用量、术后恶心呕吐的发生率及严重程度均较对照组明显降低。血浆胃动素的主要作用是在禁食期或消化间期诱导胃肠移行性运动,而血浆胃动素过量释放则会引起小肠强烈的时相性收缩,导致胃,肠平滑肌痉挛,使患者出现恶心、呕吐等[15];有研究表明,七氟醚吸入麻醉下腹腔镜手术患者,麻醉诱导前静脉注射DEX可减少术中七氟醚用量,不会延长术后苏醒时间,同时减少血浆胃动素的释放,显著降低术后恶心呕吐的发生[16]。应用舒芬太尼后,术后恶心呕吐的发生与血浆胃动素水平升高在时间上相互平行,在一定程度上增加了术后恶心呕吐发生率[17]。因此,DEX降低术后恶心呕吐的发生可能与术后血浆胃动素的释放减少有关。可能机制为:α2受体激动剂通过抑制交感活性,减少儿茶酚胺的释放,同时避免高水平血浆胃动素的释放有关;DEX降低术后阿片药物的用量,也在一定程度上减少血浆胃动素的释放。在全麻恢复期,最常见的气道反射就是呛咳反射,患者拔管时呛咳的发生率可高达76%[18]。本研究结果表明,右美托咪定组患者术后呛咳评分及SAS评分较对照组明显降低,主要与DEX的镇静镇痛作用有关。术毕前40min给药,是考虑到DEX的静脉给药的起效时间,保证了DEX在手术结束前起效,在拔除气管导管时作用达到高峰,同时不影响苏醒时间。
此外,DEX还可以减少术后寒颤的发生,机制可能与其镇静、催眠、降低血管收缩阈值、提高寒颤阈值及抑制神经元放电有关[18-20]。而本研究结果显示,右美托咪定组患者术后心动过缓发生率明显高于对照组,可能与DEX选用的剂量及输注速度有关,但经过及时的处理后均未引起严重并发症。因此,DEX在应用中应特别注意选择适当的剂量和速度,密切关注患者心率的变化。
综上所述,妇科腹腔镜手术患者术毕前使用0.5ug/kg DEX,PCIA小剂量维持,可减少术后血浆胃动素的释放,有效降低术后恶心呕吐的发生率及严重程度,同时可提高患者麻醉恢复期的苏醒质量,有助于患者早期恢复。本研究不足之处在于对DEX的具体剂量未进行分组研究,对于临床使用的最佳剂量还需要进一步的临床研究证实。

