地西他滨联合全反式维甲酸或半量预激方案治疗老年骨髓增生异常综合征和急性髓系白血病的疗效及安全性比较
刘 月,曹 阳,谢晓宝,顾 荃,韦 玮,王 飞,岳延华,林榕榕,林 艳,董伟民,顾伟英
0 引 言
急性髓系白血病(acute myeloid leukemia,AML)和骨髓增生异常综合征(myelodysplastic syndromes,MDS)是常见的起源于造血干细胞的恶性克隆性疾病。老年不耐受标准化疗的AML和高危MDS患者由于基础状况差,不能耐受常规的标准诱导方案,总体生存期短[1]。地西他滨(decitabine,DAC)是一种去甲基化药物,可特异性抑制DNA甲基转移酶(DNA methyltransferase,DNMT)。多项研究证实DAC治疗老年不适宜标准化疗的AML及中高危 MDS患者有效[2-3]。全反式维甲酸(all-trans retinoic acid,ATRA)主要用于治疗急性早幼粒细胞白血病(M3)。体外研究证实,ATRA对非M3-AML细胞株及MDS细胞株也具有抗白血病效应;临床研究显示,ATRA联合常规的化疗方案可改善老年AML患者的总体反应率(overall response rate,ORR)和总生存(overall survival,OS)率[4-6]。目前DAC联合预激方案是老年AML及中高危MDS患者常用的治疗方案,已取得一定的疗效。本研究回顾性分析我院采用DAC联合ATRA和DAC联合半量预激方案治疗老年AML和MDS-EB-1/2患者的临床疗效及安全性。
1 资料与方法
1.1一般资料回顾性分析2014年1月至2018年10月就诊于我院的老年AML和MDS-EB患者48例。纳入标准如下。①经骨髓形态学、免疫学、细胞遗传学、分子生物学(MICM分型)检查,参照WHO(2016)分型标准确诊为MDS-EB及AML的老年患者(年龄≥60岁)。②不耐受标准化疗患者,即以下条件任意满足其一:患者体力状态评分(ECOG)为2或3分;或存在感染、实体肿瘤、循环、呼吸系统疾病及肝肾功能不全等合并症;治疗因素相关;老年疾病累积评分表(CIRS-G)>6分;患者意愿不接受强烈化疗。③DAC联合ATRA或联合半量预激方案治疗至少1个疗程,且能对其临床疗效和不良反应评估的患者。排除标准:①M3患者;②已知对DAC、ATRA过敏患者;③合并严重感染,抗感染治疗不能控制;④预期寿命<3个月;⑤有精神病或其他疾病,无法完全配合试验治疗或随访要求。
1.2治疗方案DAC联合ATRA:DAC20mg/(m2·d),静脉滴注,第1至第5天;ATRA 20mg/(m2·d),口服,第1周期(第4至第28天),从第2周期开始,第1至第28天,28 d为1周期,如出现感染、骨髓抑制不能恢复,则延长给药间歇期,最长不超过90 d;完成6个周期后,停用DAC,继续口服ATRA作为维持治疗。DAC联合半量预激方案:DAC 15mg/(m2·d),静脉滴注,第1至第5天。预激方案包括①半量CAG方案:阿柔比星10 mg/d,第4至第7天,静脉滴注;阿糖胞苷12.5 mg/m2,1次/12 h,第4至第10天,皮下注射;G-CSF 300 µg/d,皮下注射,第4天起,直至中性粒细胞缺乏恢复,白细胞>10×109/L,停用G-CSF。②半量IAG方案:去甲氧柔红霉素5 mg/d,第4至第7天,静脉滴注;阿糖胞苷和G-CSF同CAG。③半量HAG方案:高三尖杉酯碱2 mg/m2,第4至第7天,静脉滴注;阿糖胞苷和G-CSF同CAG。治疗期间定期监测血常规、肝肾功能和电解质,化疗后骨髓受抑,给予输注红细胞、血小板、抗感染等支持治疗。
1.3疗效及不良反应评价标准MDS疗效判定参照国际工作组(IWG)2006疗效标准,AML疗效判定参照IWG的AML疗效标准[7-8]。ORR包括完全缓解、部分缓解、骨髓缓解、血液学改善。根据美国国立肿瘤研究所常见毒性标准(Version 4.0)评估不良反应[9]。
1.4随访通过电话、门诊、医院登记系统等方式对所有48例患者进行随访。随访截至2018年10月,总生存(OS)时间定义为从开始诱导治疗到随访截止或死亡的时间。
1.5统计学分析采用SPSS 23.0软件对数据进行统计学分析。计量资料呈非正态分布,用中位数(极值)表示,采用Mann-Whitney U检验进行组间比较;计数资料用率表示,组间比较采用卡方检验或Fisher精确概率法。生存分析采用Kaplan-Meier法,组间比较采用Log-rank检验。以P≤0.05为差异有统计学意义。
2 结 果
2.1临床特征本组48例患者中,22例接受DAC联合ATRA组,其中男15例、女7例,年龄60~76岁,中位年龄68岁。其中MDS患者9例(MDS-EB-1患者6例、MDS-EB-2患者 3例),AML患者13例(M1患者2例、M2患者4例、M5患者6例、M6患者1例)。26例接受DAC联合半量预激组,其中男、女各13例,年龄60~77岁,中位年龄65岁,其中MDS患者9例(MDS-EB-1患者2例、MDS-EB-2患者7例),AML患者 17例(M1患者 4例、M2患者9例、M4患者1例、M5患者1例、M6患者2例)。DAC联合ATRA组患者经1~5个疗程,中位治疗2个疗程;DAC联合半量预激组患者经1~7个疗程,中位治疗2个疗程。2组患者性别、年龄、治疗前血细胞参数、疾病类型、乳酸脱氢酶、骨髓原始细胞比例、染色体核型、治疗疗程数差异均无统计学意义(P>0.05)。见表1。
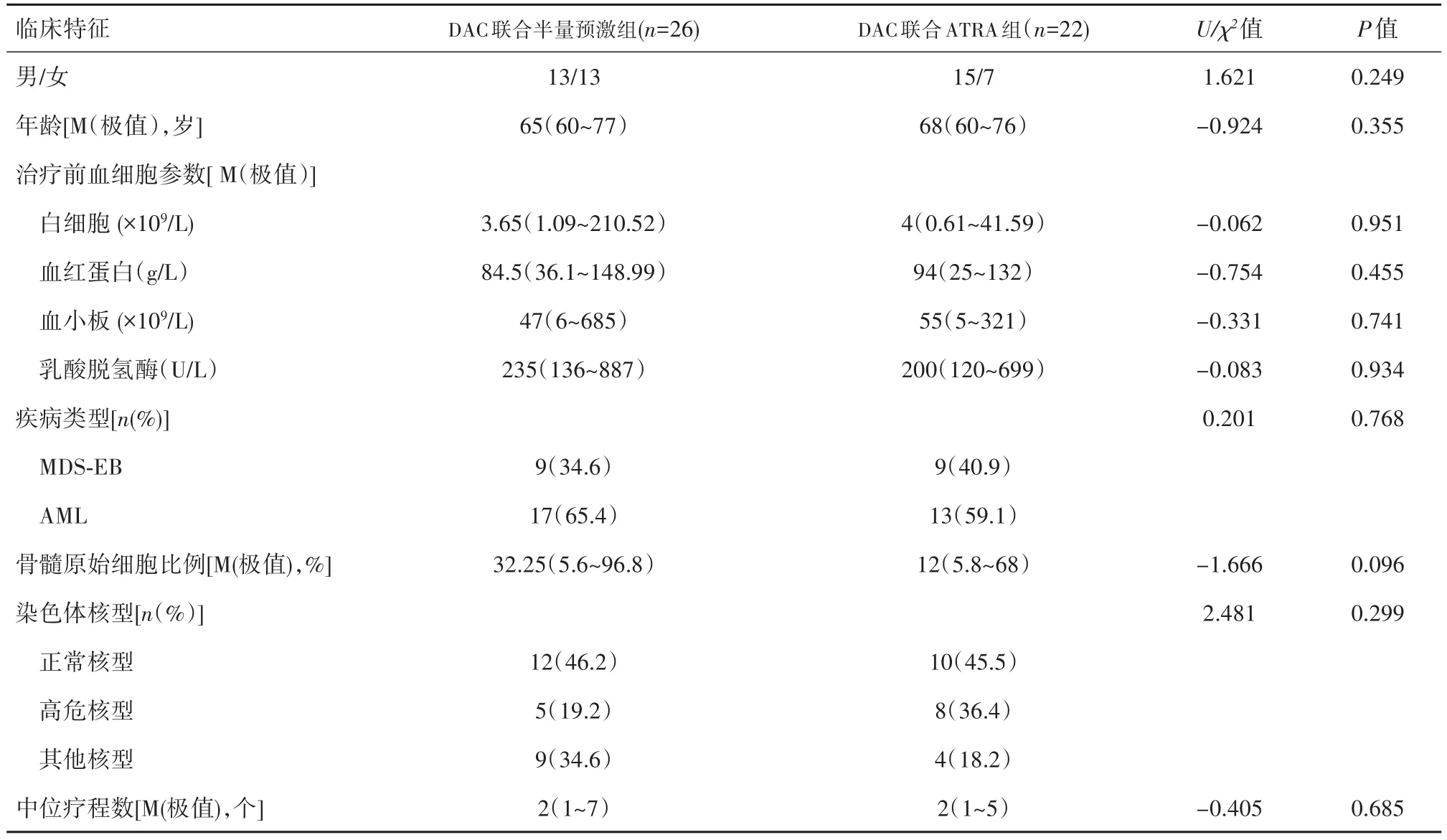
表1 DAC联合ATRA和DAC联合半量预激方案组MDS/AML患者基本情况比较Table 1 Clinical characteristics of the MDS/AML patients in the DAC+HDPR and DAC+ATRA groups
2.2临床疗效比较DAC联合ATRA组22例患者中,CR 8例(36.4%)、mCR 5例(22.7%)、PR 3例(13.6%)、HI 3例(13.6%);DAC联合半量预激组26例患者中,CR 17例(65.4%)、mCR 1例(3.8%)、PR 1例(3.8%)、HI 1例(3.8%)。DAC联合半量预激组CR率高于DAC联合ATRA组,但差异无统计学意义(χ2=0.536,P=0.551);DAC联合ATRA组mCR率及HI率明显高于DAC联合半量预激组,差异有统计学意义(χ2=4.328,P=0.037),但2组患者ORR差异无统计学意义(χ2=0.215,P=0.643)。
DAC联合ATRA组有效19例患者中,7例(31.8%)1个疗程起效,5例(22.7%)2个疗程起效,7例(31.8%)3个疗程起效;DAC联合半量预激组有效20例患者中,17例(65.4%)1个疗程起效,2例(7.7%)2个疗程起效,1例(3.8%)3个疗程起效。DAC联合半量预激组1疗程起效率高于DAC联合ATRA组,差异有统计学意义(χ2=5.371,P=0.041)。
2.3生存分析比较截止随访终点,DAC联合ATRA组22例患者中存活11例(50%)、死亡9例(40.9%)、失访2例(9.1%),中位OS时间为26.2(95%CI:8.646~33.754)个月;DAC联合半量预激组26例患者中存活12例(46.2%)、死亡11例(42.3%)、失访3例(11.5%),中位OS时间为 24.9(95%CI:22.002~27.298)个月。两组患者中位OS时间差异无统计学意义(χ2=0.01,P=0.920)。见图1。
2.4不良反应和支持治疗比较所有患者化疗后均出现了血液系统的不良反应。其他常见不良反应包括胃肠道反应、呼吸道感染、皮肤软组织感染、低血压、肝肾功能异常等。治疗过程中,DAC联合ATRA组3级以上血细胞减少12例,DAC联合半量预激组3级以上血细胞减少22例,组间比较差异有统计学意义(χ2=5.215,P=0.029)。DAC联合ATRA组感染发生率及出血率明显低于DAC联合半量预激组,2组间感染发生率差异有统计学意义(χ2=5.035,P=0.037);但出血发生率差异无统计学意义(χ2=0.215,P=0.643)。
DAC联合ATRA组患者粒细胞缺乏持续时间明显低于DAC联合半量预激组患者[9(0~24)dvs15(0~32)d],差异有统计学意义(P=0.003),红细胞及血小板输注量均明显低于DAC联合半量预激组患者,差异有统计学意义(P<0.05)。见表2。
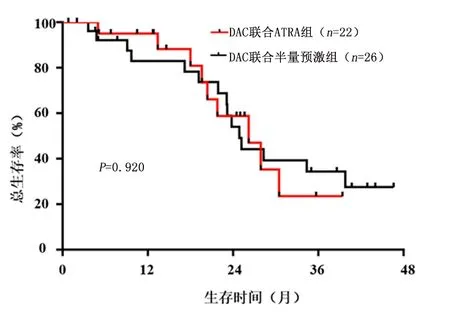
图1 DAC联合ATRA及DAC联合半量预激方案组AML/MDS患者总生存时间曲线比较Figure 1 Overall survival rate of the AML/MDS patients in the DAC/ATRA and DAC/HDPR groups
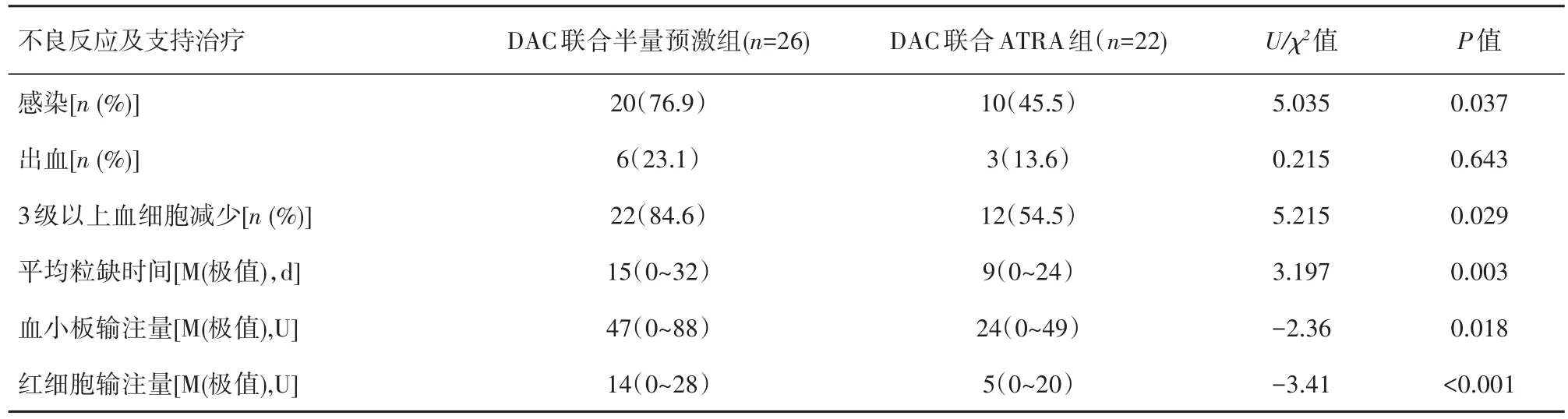
表2 DAC联合ATRA和DAC联合半量预激方案组患者不良反应发生率和支持治疗比较Table 2 Adverse events and supportive treatment in the MDS/AML patients of the DAC+HDPR and DAC+ATRA groups
3 讨 论
AML好发于老年人,中位年龄67岁,其中1/3患者年龄大于75岁[10]。近年来,随着新型靶向药物的问世及诱导方案的改良,年轻或可耐受标准化疗的AML患者预后已明显改善。但老年AML患者多存在不良因素(高龄、基础状况差、合并不良细胞遗传学及分子生物学改变等),目前尚无标准的治疗方案,其生存期仍然较短。MDS同样好发于老年人,中位年龄大于70岁[11]。其中MDS-EB是一种相对高危的疾病,老年MDS-EB患者具有基础状况差、化疗药物清除能力下降等特点,常规的标准化疗缓解率低,骨髓抑制重,难以耐受,尚缺乏有效的治疗手段。
去甲基化药物DAC是一种脱氧胞苷类似物,通过抑制DNMT逆转DNA的甲基化过程,激活沉默的抑癌基因使其再表达并诱导细胞凋亡,从而发挥抗肿瘤作用[12]。目前DAC在临床上多用于治疗老年不适宜标准化疗的AML以及中高危MDS。中国诊疗共识均推荐DAC作为老年不耐受标准化疗AML及中高危MDS的一线治疗方案[13-14]。既往研究表明,单药DAC治疗老年AML的CR率为14%~27%,ORR为21.6%~37%;治疗高危MDS的CR率为9%~13%,ORR为30%~34%[3,15-16]。血液学毒性是最常见的不良反应,包括骨髓抑制、3~4级的血细胞减少、感染等。本研究中DAC联合ATRA或半量预激方案CR率及ORR高于单药DAC方案,而3~4级的血细胞减少率、感染率并未提高。
1995年,Yamada等[17]首次报道CAG方案治疗难治复发的AML疗效显著,CR率达83%。既往研究结果表明CAG方案用于治疗老年AML和相对高危MDS也获得可喜的效果。CAG方案治疗老年AML CR率为29.2%~86.67%[18-20],治疗高危MDS CR率为33.3%~51.6%[21-22]。G-CSF 的抗白血病机制是通过诱导G0期白血病细胞进入S期,增强阿糖胞苷、阿克拉霉素的抗白血病效应[23]。研究发现DAC能够增强阿糖胞苷的细胞毒性,协同诱导白血病细胞凋亡[24]。因此有学者试图将DAC与CAG预激方案联合用于治疗老年AML和高危MDS患者,为该类患者的治疗提供一个新的选择。既往研究表明,DAC联合CAG方案治老年AML CR率为28.6%~62.5%[25-26],治疗高危 MDS的CR率达 82.6%[27]。后以高三尖杉酯碱(HHT)或去甲氧柔红霉素替代CAG方案中的阿克拉霉素形成HAG或IAG方案,单用或与DAC联合用于治疗老年AML与相对高危的MDS[28-33]。中国专家共识指出,以小剂量Ara-C为基础G-CSF为主的预激方案联合DAC可作为老年不能耐受标准化疗的AML和相对高危MDS患者的治疗选择[13-14]。因此,目前国内针对老年AML和相对高危MDS患者多采用DAC联合G-CSF为主的预激方案治疗。
考虑到本研究纳入不能耐受标准化疗的老年AML患者,对化疗耐受性差,故选择半量预激方案,将常规的预激方案剂量减半,避免DAC联合CAG/IAG/HAG方案产生严重的骨髓抑制,出现严重的化疗相关毒副反应。既往临床研究也提示,小剂量的预激方案或DAC联合小剂量Ara-C为基础的CAG方案治疗老年不耐受标准化疗的AML患者可减轻患者的不良反应,提高耐受性[34-35]。
本课题组前期基础研究发现,DAC联合ATRA可上调抑癌基因p16、RARβ,下调癌基因WT1,协同诱导白血病细胞株的增殖抑制、凋亡和分化[36-38]。临床上采用小剂量DAC联合ATRA治疗31例老年不能耐受强烈化疗的髓系肿瘤患者,获得很好的抗白血病效应,CR率为22.6%,ORR为58.1%,中位OS为11个月[39]。国外一项多中心临床试验显示,DAC联合ATRA治疗老年不耐受标准诱导化疗的AML患者CR加PR率为26%,ORR为52%,中位OS为5.5个月[40]。本研究中DAC联合ATRDAC联合ATRA组CR率为36.4%,ORR为86.4%,中位OS为26.2个月,均高于既往研究[39-40]。这可能由于我们之前的临床研究采用小剂量DAC;而本研究采用标准剂量DAC,提高了临床疗效。另外,国外临床试验单纯观察老年不耐受标准化疗的AML。本研究联合观察老年AML及MDS患者,AML本身疾病恶性程度高于MDS。此外,临床疗效的差异还可能与研究的疗效评价标准、患者的体能状况、病例数、治疗疗程数不同及疾病的生物学行为有关。
本研究纳入的均为高龄、不适宜标准化疗的患者。DAC联合半量预激方案组CR率高于DAC联合ATRDAC联合ATRA组,而ORR低于DAC联合ATRDAC联合ATRA组,但差异均无统计学意义。DAC联合半量预激方案中位OS时间为24.9个月,DAC联合ATRDAC联合ATRA组中位OS时间为26.2个月,两组差异无统计学意义。此外DAC联合半量预激方案组1疗程起效率高于DAC联合ATRDAC联合ATRA组。初步结果提示虽然DAC联合半量预激方案起效更快,但两种方案治疗老年AML和MDS-EB的疗效相当。进一步比较两种方案治疗老年AML和MDS-EB的不良反应发生率,两组主要不良反应均为3~4级的血细胞减少和感染。结果显示DAC联合半量预激方案组感染率、出血率、3级以上血细胞减少率均大于DAC联合ATRDAC联合ATRA组,其中感染率与3级以上血细胞减少率差异均有统计学意义。此外,DAC联合半量预激方案组血小板、红细胞输注量均大于DAC联合ATRDAC联合ATRA组,粒缺时间长于DAC联合ATRDAC联合ATRA组,差异均有统计学意义。提示DAC联合半量预激方案治疗老年AML和MDSEB不良反应发生率高于DAC联合ATRDAC联合ATRA组,DAC联合ATRA可能更适合不适宜标准化疗的老年患者,安全性更高。
总之,本研究结果初步显示DAC联合ATRA与DAC联合半量预激方案治疗老年骨髓增生异常综合征伴原始细胞增多和急性髓系白血病的疗效(ORR和中位OS时间)相当。虽然DAC联合半量预激方案起效更快,但血细胞减少和感染发生率明显高于DAC联合ATRA,且红细胞及血小板输注量增加,提示DAC联合ATRA治疗老年AML和MDS-EB不良反应较轻,安全性较高,耐受性更好,可能更适用于高龄、不适宜常规化疗方案的患者。由于本研究为单中心回顾性分析,样本量小,研究结果在统计学上可能存在偏倚,DAC联合ATRA是否能改善该类患者的不良反应和临床疗效有待多中心前瞻性大样本临床研究进一步证实。

