胃动素对消化间期胃动脉血流影响的在体机制研究
金 颖,李 彤,刘 彤,金文香,金春香
(1.吉林大学白求恩医学院,吉林长春 130021;2.吉林大学白求恩第二医院;3.长春市朝阳区医院;4.吉林大学白求恩第一医院)
胃动素(Motilin)是启动消化间期周期性胃肠移行性复合肌电运动(MigratingMotorComplex,MMC)的重要胃肠激素[1]。血中内生胃动素浓度在消化间期的波动特点与胃肠MMC紧密相关,显示了静止期(phaseⅠ期)的低谷和收缩期(phaseⅢ)附近的高峰[2,3]。胃肠MMC所具有的时相性和移行性特征,是人和哺乳动物与生俱来的基本运动形式[4],在整体生命活动中具有非常重要的生理意义,被称为机械性胃肠“清道夫”,而且MMCⅢ相可发出“饥饿”信号,进而产生有意识的摄食欲望[4]。同时,胃动素还是启动消化间期周期性胆囊收缩[5]和胰腺内[6]·外分泌[7,8]增加的主要激素之一,而且是与胃肠MMCⅢ相同步出现,促进化学性消化,因而也叫化学性“清扫”,为下一次进餐做准备。这些结果提示胃动素是联系机械性和化学性消化的关键。我们课题组经在体研究,在国内首次报道了在支配胃肠的动脉系中,只有胃动脉发生消化间期周期性舒张并与胃肠MMCⅢ相同步出现胃血流的增加[9],而胃动素对消化间期胃动脉血流影响的在体机制目前在国内尚未见文献报道。
1 材料与方法
1.1 材料
胃动素(Motilin)和VIP(vasoactive intestinal polypepdde,血管活性肠肽)从肽研究所(Minoh,Japan)购买;thya-milal购自 Kyorin(Tokyo,Japan);halothane(氟烷)购自Takeda Chemical Industries(Osaka,Japan);atropine(阿托品) hexamethonium(六羟季铵) propranolol(心得安)和 phenoxybenzamine(酚苄明)均购自Sigma公司;granisetron(5HT3受体拮抗剂)购自Roche(Tokyo,Japan).GM-109(phe-cyclo[Lys-Tyr(3-tBu)-Ala-].trifluoroacetate)由Chugai Pharmaceutical(Tokyo,Japan)捐赠。
1.2 动物准备
在本研究中我们使用了健康成年狗5条,体重12.5-18.5 kg,雌雄均有,由名古屋大学医学部动物管理中心提供。禁食18 h以后,对狗进行全身麻醉,然后进行腹部正中切开。超声波传输时间血流仪的血流探头(ultrasound transit-time blood flow meters;Transonic systems,Ithaca,NY)安装固定在胃左动脉(LGA)周边[10-13],与探头相连的导线分别穿过腹腔,并通过人为制作的共用皮下隧道,最终固定在左侧胸廓上。不锈钢套管和托马斯型十二指肠瘘管分别置入胃的体部和正对十二指肠乳头的对侧十二指肠肠壁上,另一端分别固定在左右侧腹壁上[14]。最后缝合腹壁,关闭腹腔。远距离血压感应器测定系统(Data Science,St.Paul,MN)的导管被固定在股动脉里面。在手术期间始终以2 m l/min速度静脉滴注生理盐水。术后三天给予输液和青霉素预防感染。一个月后痊愈,这一期间,狗可以自由地在笼里活动,并允许自由地摄入食物和水,除了实验以外。
1.3 血流测定的稳定性
在手术之前校准血流探头。每次实验之前,为了探头的稳定性、信号强度和电容,检测了静止期的脉冲和平均血流。LGA血流测定的可靠性在每条狗达12个月以上[10-13],未见有意义的差别。
1.4 实验
禁食一夜(18小时)以后,狗在意识清醒的状态下,站立于pavlov's台上。首先打开胃和十二指肠的瘘管,把导管型应力传感器(Millar,Houston,TX)分别固定在胃体和十二指肠瘘管内,并把其导线与polygraph系统相连,以便测定胃和十二指肠的机械性收缩运动。其次,把连接在血流探头另一端的插头与血流仪相连。通过polygraph系统(NEC-SanEi,Tokyo,Japan)测定LGA血流、胃和十二指肠的机械性收缩运动、血压和心率,而且记录在磁性的数据记录仪(pen recorder;NEC-SanEi,Tokyo,Japan)。最终全部数据储存在计算机数据调节掌握系统(Maclab system,Analog Digital Instruments,Castle Hill,Australia)。为了补充实验中液体的流失,以1m l/m in静脉内持续性滴注生理盐水。
给每一条狗静脉内持续性滴注生理盐水至少达6小时。十二指肠的收缩期(phaseⅢ期)结束后30分钟,静脉内持续性滴注胃动素(100 pmol/kg/h)达30分钟。十二指肠的收缩期(phaseⅢ期)结束后10分钟,GM-109(10mmol/kg/h)、granisetron(40μg/kg/h)、atropine(50 μg/kg followed by 25 μg/kg/h)、hexamethonium(2 mg/kg followed by 5mg/kg/h)、phenoxybenzamine(1mg/kg)和propranolol(1mg/kg)分别静脉内持续性滴注的前提下,反复静点胃动素(100 pmol/kg/h)进行实验。在另一个研究系列里,在有或无atropine(50μg/kg followed by 25 μg/kg/h)的情况下,把胃动素或VIP(5、10、20、40和80 pmol/kg)溶解在1 ml生理盐水里,并在1分钟内完成静脉推注。实验的全部系列被实施在5条狗上。每一条狗一周实验1-2次,而且,一天只进行一个系列实验。
1.5 分析
显示的全部数据是15 s瞬间数据的平均值,来源于血流,心率,平均血压及血管阻力,由计算机收集并储存,用于数据分析。血管阻力(mmHg/m l per minute)通过系统平均血压(mmHg)除以血流(m l/min)而获得。计算出的血管阻力是注射后阻力与注射前阻力之比。通过总和30分钟期间高于注射前水平的血流和胃肠腔内的阻力,分别计算血流增加的积分(m l/min·30minutes)和动力指数(motility index,反应收缩频率和振幅总和,mmHg·30 minutes)。升高的LGA血流恢复到静止水平的时间确认为静止期的开始,把phaseⅡ收缩开始或血流升高开始的时间定为静止期结束。
1.6 统计
所有的数据被表示为Means±SEM。通过方差分析进行统计学的分析,针对于配对数据进行配对t检验,而且针对于多重比较进行分散分析(Dunnett procedure),P<0.05为有意义的水平。
2 结果
2.1 胃动素对胃动脉血流的影响
胃动素诱导了LGA血流的增加,其类似于自发地发生的周期性LGA血流增加,并与胃·肠机械性收缩同步出现(图1)。
2.2 胃动素受体拮抗剂GM-109对胃动素作用的影响
GM-109(10mmol/kg/h)的静脉内持续性注入,完全抑制了胃动素(100 pmol/kg/h)诱导的LGA血流增加和胃·十二指肠的机械性运动(图2)。GM-109静脉内持续性注入达120min,完全抑制了自发性发生的周期性胃·十二指肠的运动和LGA血流的增加,而且当停止注入GM-109以后,立即出现了自发性发生的胃·十二指肠运动和LGA血流增加(图3)。
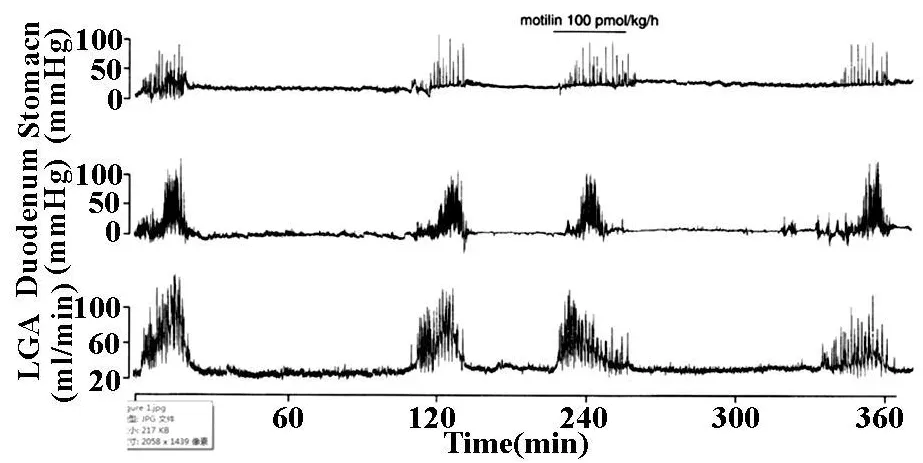
图1 胃动素(100 pmol/kg/h)静脉内投入对胃·肠运动和LGA血流的影响
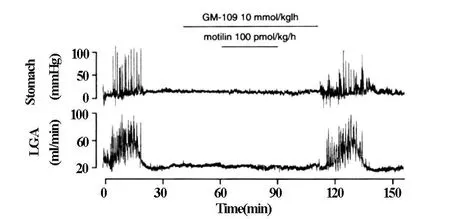
图2 GM-109的前投入对胃动素作用的影响
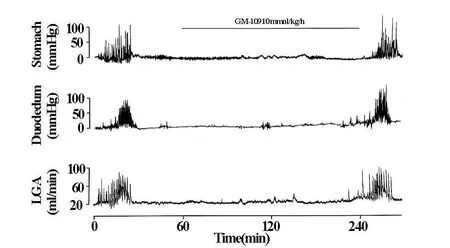
图3 GM-109(10mmol/kg/h)静脉内投入对自发性发生的胃·十二指肠运动和LGA血流的影响
2.3 Granisetron对胃动素作用的影响
Granisetron(40μg/kg/h)完全抑制了胃动素(100 pmol/kg/h)诱导的胃运动,然而,这个 5-HT3受体抑制剂没有抑制LGA血流的持续性升高和十二指肠的运动(图4)。
2.4 Atropine对胃动素作用的影响
Atropine(25μg/kg/h)前投入的情况下,完全抑制了胃动素(100 pmol/kg/h)诱导的胃和十二指肠的收缩,然而未能抑制LGA血流的增加(图5)。
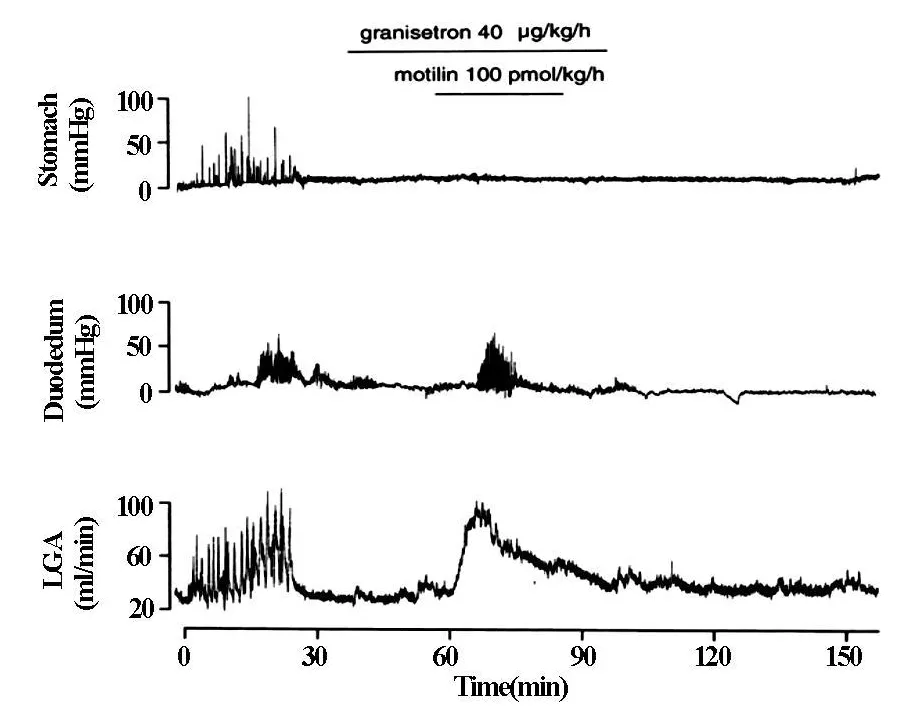
图4 Granisetron对胃动素诱导的胃·十二指肠运动和LGA血流的影响
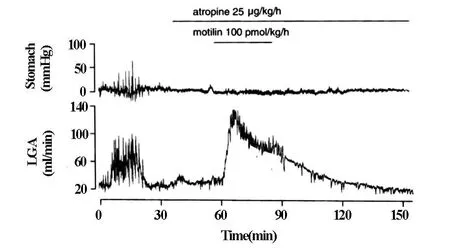
图5 atropine静脉内前投入对胃动素诱导的胃收缩运动和LGA血流的影响
2.5 Hexamethonium对胃动素作用的影响
Hexamethonium(5mg/kg/h),有意义的(P<0.05)抑制了胃动素(100 pmol/kg/h)诱导的胃·十二指肠的运动,但无法抑制LGA血流的应答(图6)。
2.6 肾上腺素能阻滞剂对胃动素作用的影响
Phenoxybenzamine(1 mg/kg)和Propranolol(1mg/kg)均没有影响胃动素(100 pmol/kg/h)诱导的胃·十二指肠运动和LGA血流增加(图7)。
2.7 胃动素的不同剂量与LGA血流应答
针对于胃动素(5、10、20、40和80 pmol/kg)不同剂量的静脉内注射,无论LGA血流应答持续时间还是增加量都是相似的,均无剂量相关性(图8A)。在atropine前投入的情况下,胃动素的静注诱导了较小的但剂量相关的LGA血流的增加(图8B)。用atropine处理以后,LGA血流对胃动素的应答仍然存在,但被GM-109完全抑制了,然而,VIP未受两种抑制剂的影响(图8C)。
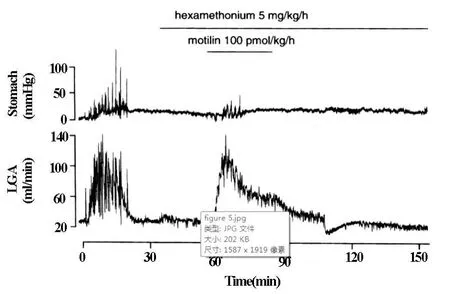
图6 hexamethonium静脉内前投入对胃动素诱导的胃收缩运动和LGA血流的影响
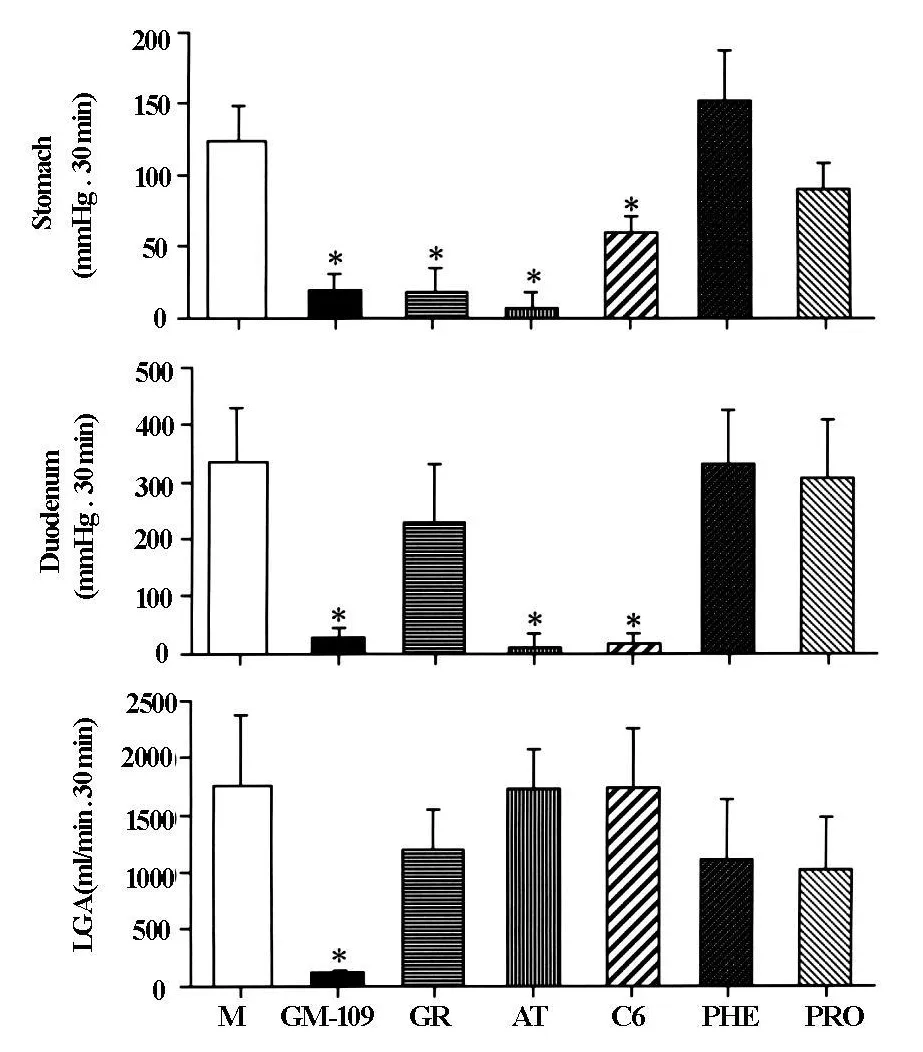
图7 GM-109(10 mmol/kg/h),granisetron(GR;40μg/kg/h),atropine(AT;25μg/kg/h)和 hexamethonium(C6;5 mg/kg/h),Phenoxybenzamine(PHE;1 mg/kg)和 Propranolol(PRO;1 mg/kg)对 motilin(M;100 pmol/kg/h)诱导的胃·十二指肠收缩和LGA血流(积分)的影响。平均值±标准误(n=5条狗)*代表有意义的差异(P<0.05)与单独使用motilin组比较
3 讨论
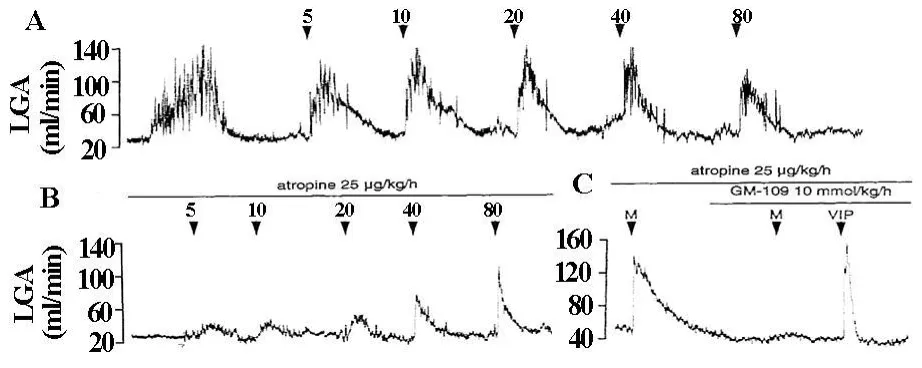
图8 Motilin(5,10,20,40和80 pmol/kg)静注对LGA血流的影响无(A)或有(B)atropine(25 ug/kg/h)的情况。(C)前投入 atropine(25 ug/kg/h)和GM-109(10 mmol/kg/h)情况下LGA血流对motilin(M)或VIP 80 pmol/kg的应答
我们曾经在国内首次报道了在意识清醒狗消化间期支配胃肠的动脉系中,只有胃动脉发生周期性舒张并与胃肠MMCⅢ相同步出现胃血流的增加,外源性胃动素(生理剂量),对肠系膜上动脉(SMA)、血压和心率均没有影响,胃动素只选择性的舒张LGA增加胃动脉血流,且同步诱导MMCⅢ相类似的胃肠机械性收缩[9]。这些研究结果提示,消化间期随着胃肠MMCⅢ相周期性的出现,只有胃对胃动脉血流的生理性需求同步呈现周期性的明显增加。
本研究就胃动素选择性舒张消化间期胃动脉增加胃动脉血流的在体机制进行了研究。其结果表明,胃动素对在体意识清醒狗消化间期胃平滑肌的调节机制与同步舒张胃动脉的作用机制是不同的,前者与胆碱能和非胆碱能神经关系密切,而后者以依赖于胃动脉壁上胃动素受体为主,胆碱能神经的参与为辅。
在这个研究系列里,静脉内分别注射胃动素5-80 pmol/kg,LGA血流应答的持续时间和增加量是相似的,未见剂量相关性(图8A)。Atropine的前投入,使LGA血流对胃动素的应答呈现剂量相关性,但明显的小于单纯胃动素投入组(图B)。如此,胃动素诱导胃动脉舒张的机制,既有胆碱能神经的参与,也有对胃动脉壁的直接作用。胃动素作用的位置似乎在神经节后,因为与atropine相比,hexamethonium未能完全抑制胃动素诱导的胃收缩,而且,切除双侧迷走神经以后,Heidenhain囊仍然可以对胃动素产生应答[15]。实验证明,胃动素刺激离体兔十二指肠的肠神经元释放乙酰胆碱[16]。因此,胃动素很可能对胃壁内和肠壁内的固有胆碱能神经起作用,释放的乙酰胆碱可以促进内皮释放一氧化氮(NO),并诱导胃动脉的舒张[17,18]。值得注意的是,胃动素是高度选择性而且有效力的胃血管舒张剂。我们的研究显示[9],胃动素诱导的胃血管舒张作用大于V IP。在5-80 pmol/kg剂量范围内 胃动素没有影响血压,心率和SMA,然而VIP诱导了剂量相关的降低血压 心动过速和SMA血流的增加。当通过atropine消除了胆碱能神经途径参与的胃动素诱导的胃血管舒张部分后,两种肽的剂量相关应答曲线几乎是完全相同的。因此,胃动素本身就像VIP一样是有效力的胃血管舒张剂,而且,此系列研究的最低剂量接近于胃动素的生理剂量。
对狗[19]和人[20]进行的实验显示,5HT3受体调节胃动素-或红霉素诱导的胃收缩。周吕课题组曾发现,清醒狗胃肠MMC不同时相血浆胃动素和5-羟色胺(5-HT)浓度呈现周期性变化,5-HT峰值在胃动素峰值之前出现,表明5-HT激发了胃动素释放,进而启动MMCⅢ相[21],而且,胃肠MMC周期性调节是通过胃动素与5-HT间正反馈的相互作用机制实现的[22]。然而,这个途径似乎在胃血管的调节机制中不重要,因为,5HT3受体拮抗剂granisetron,未能抑制胃动素诱导的胃动脉舒张(图4,图7)。交感神经系统在系统阻力血管的调节中起重要作用。在此研究里无论是α-还是β-肾上腺素能阻滞剂均没有影响胃动素诱导的胃收缩和胃动脉舒张(图7)。因此,肾上腺素能神经途径在胃动素调控胃动脉舒张过程中不发挥作用。胃动素诱导的胃动脉舒张经 atropine的前投入仍然存在,而被GM-109完全抑制(图8C)。GM-109敏感的胃动素受体有可能存在于胃动脉血管壁,并调控血管舒张,且胃动素通过内皮依赖机制直接或间接地作用于血管平滑肌上。胃动素-R1A受体被克隆[23]。组织化学的研究显示,胃动素受体被表达在胃肠肌间神经元[24-26],但胃动脉壁上是否存在胃动素受体,尚有待进一步深入研究。我们的研究显示,对于狗来说,胃动素是一个有效力的而且是高度选择性的胃血管舒张剂。胆碱能神经途径参与胃动素受体调控胃动脉舒张的过程。这个胃肠激素在消化间期胃血流的调节中起非常重要的作用,可以保护因消化间期胃收缩而引起的胃粘膜的局部缺血。这个假设的有效性和此发现的病理生理学的含义,尚有待继续深入研究。
[1]Portras P.M otilin isa digestivehormone in the dog[J].Gastroenterology,1987,87:909.
[2]Ioh Z:Effect ofmotilin on gastrointestinalmotor activity in the dog[M].In:Itoh Z,ed.Motilin,Academic Press,San Diego,1990.133.
[3]张建忠,王 雁,袁申元.消化间期移行性复合运动的发生机制[J].胃肠病学和肝病学,1999,8:30.
[4]周 吕.消化间期移行性复合运动的重要性及其临床意义[J].基础医学与临床,1999,19:1.
[5]Itoh Z,Takahashi I.Periodic contractionsof the caninegallbladder during the interdigestive state[J].Am JPhysiol,1981,240,G183.
[6]Shiba Y,Mizumoto A,SatohM,et al:Effect of nonpeptidemotilin agonist EM 523 on releaseofgut and pancreatic hormones in conscious dogs[J].Gastroenterology,1996,110:241.
[7]Magee DF,Naruse S.The role ofmotilin in periodic interdigestive pancreatic secretion in dogs[J].JPhysiol,1984,355:441.
[8]Lee KY,Sniratori K,Chen YF,Chang TM,Chey WY.A hormonalmechanism for the interdigestive pancreatic secretion in dogs[J].Am JPhysiol,1986,251:G759.
[9] 刘贤英,李 彤,金 颖,金文香,金春香.消化间期意识清醒狗胃左动脉及肠系膜上动脉血流变化的对比研究[J].中国实验诊断学,2011,15:397.
[10]Nakamura T,NaruseS,OzakiT,KumadaK.Calcitonin gene related peptide isa potent intestinal,but not gasiric,vasodilator in conscious dogs[J].Regul Pept,1996,65:21.
[11]Ito O,Naruse S,K itagawaM,Ishiguro H,Ko S,Nakajima M,Hayakawa T.The effect of V IP/PACAP family of peptideson pancreatic blood flow and secretion in conscious dogs[J].Regul Pept,1998,78:105.
[12]Jin C,Naruse S,Kitagawa M,Ishiguro H,NakajimaM,Mizuno N,Ko S,Hayakawa T.The effect of calcitonin gene-related peptide on pancreatic blood flow and secretion in conscious dogs[J].Regul Pept,2001,99:9.
[13]NakajimaM,NaruseS,Kitagawa M,Ishiguro H,Jin C.Ito O,Hayakawa T.Roleof cholecystokinin in the intestinalphaseof pancreatic circulation in dogs[J].Am JPhysiol,2001,280:G614.
[14]Magee DF,Naruse S.Neural control of periodic secretion of the pancreas and the stomach in fasting dogs[J].JPhysiol,1983,344:153.
[15]Magee DF,Naruse S.The role ofmotilin in periodic interdigestive pancreatic secretion in dogs[J].JPhysiol,1984,355:441.
[16]Kitazawa T,Ishii A,Taniyama K.The Leu 13motilin(KW-5139)evoked release of acetylcholine from enteric neurones in the rabbit duodenum[J].Br JPharmacol,1993,109:94.
[17]Furchgott RF,Zawadzki JV.The obligatory role of endothelial cells in the relaxation of arterialsmoothmuscle by acetylcholine[J].Nature,1980,288:373.
[18]Palmer RMJ,Ferrige AG,Moncada S.Nitric oxide release accounts for the biologicalactivity of endothelium-derived relaxing factor[J].Nature,1987,327:524.
[19]Itoh Z,M izumoto A,Jwanaga Y,Yoshida N,ToriiK,WakabayashiK,Involvement of 5-hydroxytryptam ine 3 receptors in regulation of interdigestive gastric contractions by motilin in the dog[J].Gastroenterology,1991,100:901.
[20]Wilmer A,Tack J,CoremansG,Janssens J,Peeters T,Vantrappen G.5-hydroxytryptamine 3 receptors are involved in the initiation of gastric phase 3motor activity in humans[J].Gastroenterology,1993,105:773.
[21]杨春敏,周 吕,张 航,郝 维.5-羟色胺和胃动素在狗小肠移行性复合运动调控中的作用[J].生理学报,1998,50:431.
[22]Nakajima H,Mochiki E,Zietlow A,Ludwig K,Takahashi T.Mechanism of interdigestive migrating motor complex in conscious dogs[J].JGastroenterol,2010;45:506.
[23]Feighner SD,Tan CP,McKee KK,Paiyha OC,Hreniuk DL,Pong SS,Austin CP,Figueroa D,MacNeilD,Cascied MA,Nargund R,Bakshi R,AbramovitzM,Stocco R,Kargman S,O'NeillG,VanDerPloeg LHT,E-vans J,Patchett AA,Sm ith RG.Howard AD.Receptor formotilin identified in the humangastrointestinal system[J].Science,1999,284:2184.
[24]柳力公,周 吕,王 玲.肠神经系统脑肠肽神经元的免疫组化研究[J].基础医学与临床,2003,23:348.
[25]杨 侠,董 蕾,杨 浩.大鼠肠肌间神经元胃动素受体的表达及胃动素引起神经元内钙信号的机制[J].四川大学学报(医学版),2006,37:683.
[26]Hiroyuki O,M iki N,Katsuom i I.Molecular identification and characterization of the dogmotilin receptor[J].Regul Pept,2008,146:80.

