焦磷酸测序检测载脂蛋白E基因多态性方法的建立
初亚男,封利颖,吴燕子,张婕妤
0 引 言
载脂蛋白E(Apolipoprotein E,ApoE)隶属于载脂蛋白家族,主要通过与低密度脂蛋白受体和极低密度脂蛋白受体结合参与脂类代谢和胆固醇转运,也参与神经系统发育、组织损伤后修复、组织再生和脂质的再分布、免疫应答、抗氧化、细胞增殖、分化等,对维持身体健康有重要意义[1-3]。ApoE的编码基因由于3种异构体所带电荷存在差异,导致其与相关脂蛋白受体结合的活性不同,进而影响了脂蛋白代谢过程,例如相对ε3等位基因,ε2等位基因往往与甘油三酯水平升高、总胆固醇(Total cholesterol,TC)水平下降有关,而ε4则相反[3]。此外,还有多篇文章报道该位点与阿尔茨海默病[4]、冠状动脉粥样硬化[5]、帕金森病以及卒中后抑郁等的发病风险有相关性[6-7]。目前,对于SNP的检测技术日新月异,主要包括探针杂交技术,Taqman探针技术,高分辨溶解曲线技术以及直接测序技术等[8-9]。但这些方法大多操作复杂,成本昂贵,因而没有在大规模SNP检测中得到应用。焦磷酸测序法由于其良好的定量性能,无需电泳或荧光标记,易于自动化等优点已成为 SNP检测最主要的方法[10]。王丹慧等[11]通过优化焦磷酸测序的推注顺序实现同时检测ApoE基因的2个SNP位点,可以节约一半测序时间和试剂成本,但是该方法的灵敏度较低,需要50 ng的人基因组核酸才能实现检测,对模板要求较高。Apoe基因中的2个SNP位点所处区域的GC含量高达68%以上,Tm值高于70℃,不利于扩增引物的结合和延伸,容易产生非特异性条带,不利于后期进行焦磷酸测序,因此需要对扩增条件进行优化才能获得理想的测序结果。本研究的目的是建立一种基于焦测序技术的高灵敏高特异性rs429358(112T>C)、rs7412(158C>T)位点分型方法。
1 材料与方法
1.1试剂和仪器人基因组提取试剂盒采用Wizard Genomic DNA Purification Kit,焦磷酸测序相关试剂购自德国QIAGEN公司;2×TransTaq®High Fidelity(HiFi)PCR SuperMix I试剂盒购自北京全式金公司;TaKaRa LA Taq®with GC Buffer试剂盒及TaKaRa TaqTM试剂盒购自日本TaKaRa公司。其他试剂均为分析纯;实验用水均为灭菌双蒸水。Q24焦磷酸测序仪购自德国QIAGEN公司,A200基因扩增仪购自杭州朗基科学仪器有限公司,微量紫外分光光度计购自南京伍义科技有限公司。
1.2引物设计和合成在NCBI中查询到人ApoE基因的序列信息,选择112和158位点附近的保守区域,使用PyroMark Assay Design 2.0设计焦磷酸测序引物,使用Primer5软件分析引物的Tm值和二级结构,对引物进行微调整。由于112和158位点相距137个bp,因此我们设计了一个包含两个SNP位点,总长为276bp的扩增片段,只需要采用不同的测序引物就分别测得两个SNP的结果。设计得到的引物序列由Invitrogen公司合成,分别为上游引物“5′-AAATCGGAACTGGAGGAA-CAA-3′”,下游引物“Biotin-5′CCCCGGCCTGGTACACT-3′”,112位点测序引物“5′-GCGGACA-TGGAGGACGTG-3′”及158位点测序引物“5′-GCCGATGACCTGCAGAAG-3′”。PCR体系及温度考察
本研究验证了TaKaRa公司的普通Taq酶体系(简称T体系)、高GC专用的La Taq酶体系(简称L体系)和全式金公司高GC专用的Trans Taq酶体系(简称TT体系)。其中T体系包括:10×buffer 5µL,MgCl22 mmol/L,dNTP 200 µmol/L,上下游引物各0.4µmol/L,DNA 模板2µL,Taq酶1.25 U,加水补充至 50µL。L体系包括:10×高 GC buffer 25µL,dNTP 400µmol/L,上下游引物各0.4µmol/L,DNA模板2µL,La Taq酶2.5 U,加水补充至50µL。TT体系包括:2*Trass Taq High Pidelity(包含热启动酶,反应 Buffer,dNTP)25µL,上下游引物各 0.4µmol/L,DNA模板2µL,加水补充至50µL。
同时,本研究也考察了60°C循环程序及62-68°C梯度升温循环程序,作为最适应温度优化。其中60°C循环程序为:94°C预变性5 min,94°C变性30 s,60°C退火30 s、72 °C延伸30 s,共35个循环,最后72°C延伸7 min。62~68°C梯度升温循环程序为:94°C预变性5 min,94°C变性30 s,62°C到68°C退火30 s每个循环升1°C ,72°C延伸30 s,共6个循环,94°C变性30 s,60°C退火30 s、72°C延伸30 s,共29个循环,最后72°C延伸7 min。
1.3焦磷酸测序方法特异性考察从我科的临床基因检测扩增检验实验室收集到的人基因组核酸标本库中随机挑选20份标本,采用最优条件进行扩增,取同管产物一部分用于焦磷酸测序,一部分用于Sanger测序,将两者对112和158位点的测序结果进行比较。同时将Sanger测序得到的序列在NCBI数据库中进行BLAST比对,分析序列的来源是否为人源ApoE基因。
1.4焦磷酸测序方法灵敏度考察将已知基因型的标本用纯水进行梯度稀释,得到浓度为10、2、0.4、0.08 ng/µL标本及纯水0 ng/µL作为模板。对各梯度模板扩增后进行焦磷酸测序,在相应碱基位置有信号峰出现,且信号峰比例符合预期的判定为测序正确。设置112位点测序推注顺序为“TTCCGC”其中第1个“T”为112位点的野生型信号峰,第2个“T”可获知T碱基的测序本底,同理C碱基为突变型信号峰。在焦磷酸测序仪的试剂仓中依次加入A、C、G、T4种碱基,测序底物(S)和酶(E),运行程序10 min后得到相应测序图谱。同理设置158位点的推注顺序为“TTCCGC”,“T”为突变型信号峰,“C”为野生型信号峰。
2 结 果
2.1 PCR体系及温度考察结果3种扩增体系仅L体系获得了位于276 bp的单一目标产物。62~68℃梯度升温循环程序下L体系和TT体系获得了位于276 bp的单一目标产物,见图1。实验结果表明62~68℃梯度升温循环程序的设置可以显著降低非特异性扩增,但同时对目的产物的终浓度也会造成影响。综合电泳条带亮度、特异性,60℃循环程序和L体系为最优组合。
2.2焦磷酸测序方法特异性考察结果从标本库中随机挑选20份标本焦磷酸测序,结果如下,112T>C位点TT型15份、TC型5份,CC型0份。158C>T位点TT型0例、TC型4份,CC型16份。20份标本2个SNP位点的Sanger测序结果与焦磷酸测序结果一致。将多态性分析结果同Sanger测序结果进行比较,与Sanger测序完全一致。将Sanger测序获得的基因序列进行BlAST比对,该序列与GenBank中人载脂蛋白E基因的碱基序列100%匹配。说明本方法的特异性良好。
2.3焦磷酸测序方法灵敏度考察112T>C位点和158C>T位点均可检出低至0.16 ng的人基因组DNA,见图2,信号峰比例正常,能明显区分于本底信号峰。
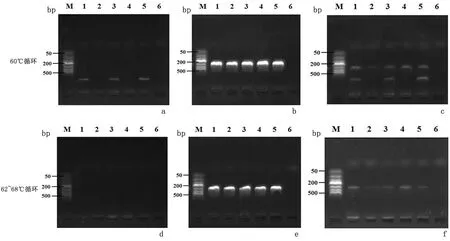
图1 3种PCR体系优化结果Figure 1 Results of three PCR buffer seletion at annealing temperature
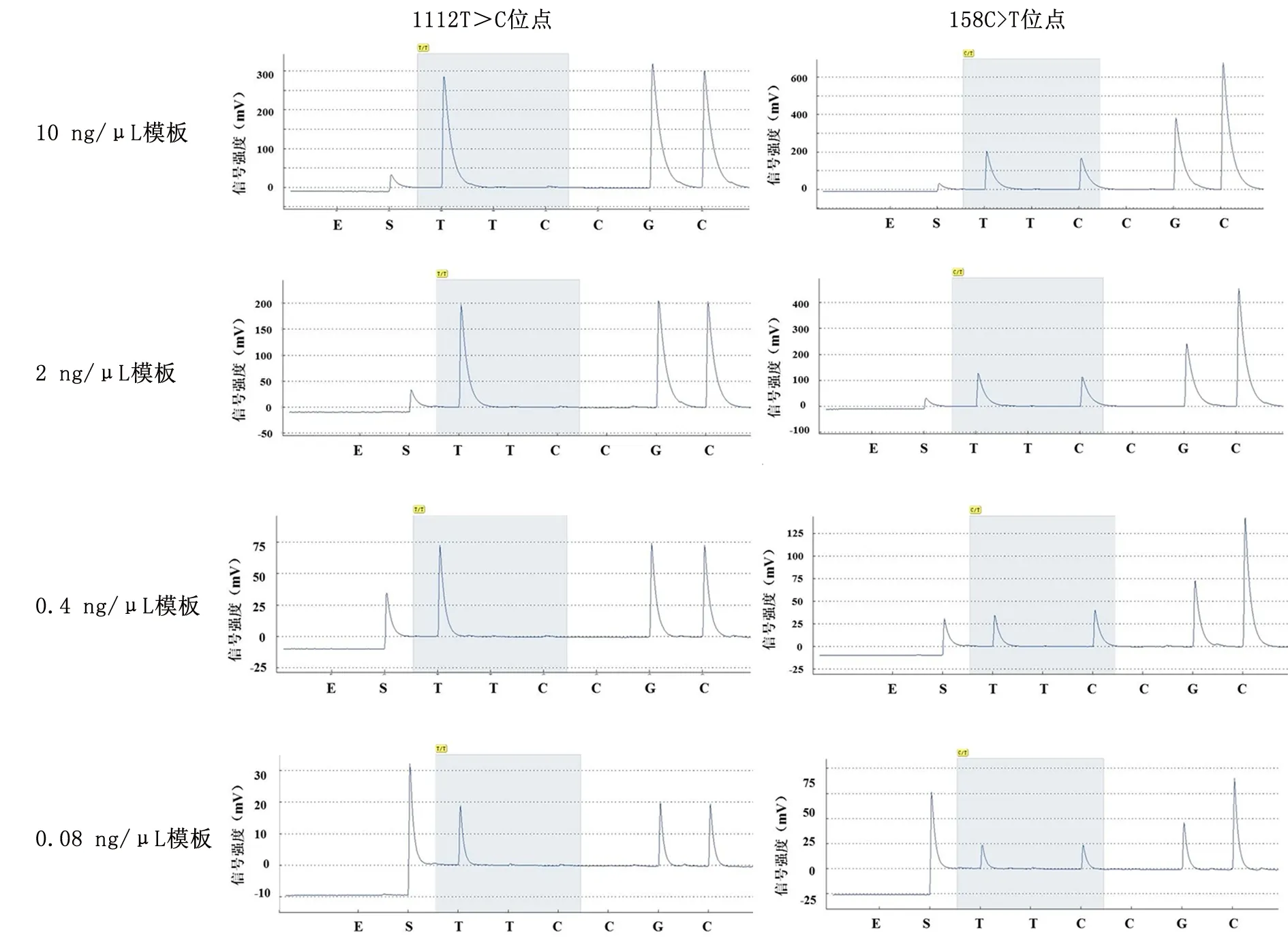
图2 不同条件下灵敏度检测结果Figure 2 Sensitivity of the 1112T>C site and 158C>T site
3 讨 论
有研究发现ApoE各基因型与TC和LDL-C水平存在显著性关联。其中ε4基因型的患者总胆固醇和低密度脂蛋白浓度的平均水平偏高。由于冠心病的发病危险因素之一就是高血脂,且与TC和LDL-C的水平更为相关[12-13],所以对ε4基因型携带者可以及早进行干预。以饮食、药物、生活方式为干预手段,制定健康管理方案,以此预防或延缓冠心病的发生或发展。该基因在他汀类个体化用药方面也具有一定意义,一项对16个候选基因中的43个SNP位点的研究发现,ApoE基因158位点CT和TT型患者对阿托伐他汀的治疗反应较好[14]。因此ApoE基因在结果解读时,应该联系患者的疾病发生风险、血脂、他汀类药物疗效等方面综合进行解读。目前已经获得CFDA批准的ApoE基因分型检测试剂盒分别基于基因芯片和荧光PCR技术平台。基因芯片法检测ApoE基因需要经过核酸纯化、杂交、洗脱、显色等步骤,对实验人员的操作要求较高且步骤繁琐。荧光PCR方法由于属于闭管检测,可以有效避免气溶胶污染,但是由于该方法是基于核酸杂交进行基因序列分析,所以属于间接方法,如果在目标区域内存在序列变异时容易造成检测误差。本研究建立的焦磷酸测序方法属于直接测序法,是核酸序列分析的金标准,通过体系优化本研究建立的ApoE基因焦磷酸测序检测方法具备特异性好灵敏度高的优点,最低可检测0.16 ng的人基因组核酸,因此本方法可适用于纸片血、咽拭子等核酸含量较低的标本来源,减轻患者采样负担,更好的满足临床检测。总之,本研究建立了一个可以在临床检测ApoE基因112和158位点变异的方法。该方法将有望应用于患者疾病发生风险预测及药物合理使用等方向。

