环状RNA hsa_circ_0082626的特征分析及过表达载体构建
潘劲辉,姚文霞,林 海,牛秋玲,罗远卫,梁 敏,周新科
0 引 言
环状RNA可通过反向剪接、首尾相连,形成以闭合共价环为特征,不含有5′末端帽子和3′末端poly A尾巴的内源性非编码RNA分子,在各种真核生物中广泛存在[1]。随着高通量测序技术出现和飞速发展,越来越多环状RNA被发现,环状RNA也成为了近年的研究热点[2-4]。研究表明,环状RNA并非仅仅是剪接的副产物,具有丰富的生物学功能[5],目前报道较多的功能主要有:竞争性内源RNA、调控基因转录[6]、与RNA结合蛋白相互作用和翻译成多肽[7-8],环状RNA与多种疾病的发生、发展有密切关系[9-11]。
ZC3HAV1基因是位于7号染色体(7q34)上的干扰素诱导基因,经过可变剪接可产生两个主要的mRNA亚型(长亚型NM_020119.3和短亚型NM_024625.3),分别编码合成两种锌指抗病毒蛋白(zinc-finger antiviral protein,ZAP)。ZAP通过与病毒RNA中的ZAP反应元件(ZRE)相互作用,以及通过动员外泌体来降解RNA底物,抑制多种RNA病毒,包括逆转录病毒、α病毒和丝状病毒的复制[12]。
本文研究的环状RNA hsa_circ_0082626则是来源于抗病毒基因ZC3HAV1的长亚型mRNA(NM_020119.3),再经过反向剪切,由3、4、5、6号外显子组成。根据circBase数据库收录信息,人类ZC3HAV1基因的长亚型mRNA可通过反向剪接产生出多个环状RNA(circBase收录显示有15个),hsa_circ_0082626的长度为1564 bp。hsa_circ_0082626被高通量测序检测出的相关研究最多[6,13],提示其分布较广泛,具有的功能相对重要。因此,本文关注到了环状RNA hsa_circ_0082626并研究了其反向剪接位点、Rnase R抵抗性以及在细胞内的胞质胞核分布情况等基本特征以及构建出环状RNA hsa_circ_0082626真核生物过表达载体,并进一步转染293T细胞,经实时定量PCR检测,hsa_circ_0082626的过表达效果明显。通过这些试验,为深入研究环状RNA hsa_circ_0082626的生物功能提供了实验基础。
1 材料与方法
1.1实验材料HEK293T(人胚肾上皮细胞)为ATCC来源;大肠埃希菌DH5α感受态细胞购自天根公司。过表达载体pHB-circBasic试剂盒购自汉恒生物公司;质粒小量抽提试剂盒(Cat.CW0500M)、DNA胶回收试剂盒(Cat.CW2302M)购自康为世纪生物公司;DNA marker(Cat.M10-02)购自OMEGA公司;反转录试剂盒PrimeScript™RT reagent Kit with gDNA Eraser(Code No.:RR047A)、RNase-free H2O(Takara)、实时定量PCR试剂盒(TB Green™ Premix Ex Taq™ II(Tli RNaseH Plus)Code No.:RR820A)均购自TaKaRa公司;PARIS Kit(AM1921)购自生命技术公司;Trizol试剂、引物均购自Invitrogen公司;RNase RE(picentre,RNR07250)购自 ILLUMINA 公司;RnaseR纯化试剂盒(RNeasy® MinElute® Cleanup)购自QIAGEN公司;培养液DMEM、Optium-Medium、双抗(青霉素及链霉素)、胎牛血清(FBS)、胰蛋白酶、双抗均购自Gibco公司。
1.2实验方法
1.2.1 hsa_circ_0082626反向剪切位点的PCR扩增验证及测序验证 从circBase数据库(http://www.circbase.org/)上获得环状 RNA hsa_circ_0082626 的序列,并设计一对双向引物来扩增出包含反向剪切位点的序列,引物的序列为:Forward Primer 5′-cagtatggagaagaggaatt-3′;Reverse Primer 5′-ttttgcatatctcgggcata-3′。以细胞的cDNA为模板进行PCR扩增,预测会得到136 bp大小的扩增产物。PCR产物用2.0%琼脂糖凝胶电泳检测后,送广州艾基生物技术有限公司测序。
1.2.2 RNA提取 将培养的细胞收集,然后用Trizol法抽提出细胞总RNA。
1.2.3 RNase R消化 将收集到的RNA分为RNase R处理组与对照组,各10µg,RNase R处理组加入20 U(2 U/µg)的RNase R,对照组用等量ddH2O替代,于37℃中孵育10 min。
1.2.4 处理后纯化 处理后产物用RNase R纯化试剂盒(RNeasy® MinElute® Cleanup)进行纯化,然后分别检测两组RNA浓度。
1.2.5 反转录及实时定量PCR 用反转录试剂盒进行反转录合成cDNA(两组分别取等量RNA进行反转录),以得到的cDNA为模板进行实时定量PCR扩增(TB Green™ Premix Ex Taq™ II(Tli RNaseH Plus)Code No.:RR820A)。反应体系 20 µL:TB Green Premix Ex Taq II(Tli RNaseH Plus)10 µL,ROX Reference Dye II 0.4µL,正反向引物各0.8µL,ddH2O 6µL,cDNA 2µL。
1.3细胞定位实验已知U1 RNA主要定位于细胞核中,GAPDH RNA主要定位于细胞质中,因此在实验中可将U1 RNA和GAPDH RNA分别作为细胞核、细胞质的定位参照标志。
1.3.1 细胞质与细胞核RNA分离及提取 将收集到的细胞的细胞质、细胞核中的RNA用细胞质、细胞核分离试剂盒(PARIS™Kit AM1921)分离及提取出来。
1.3.2 反转录及定量PCR 将细胞质、细胞核中RNA分别取等量(500 ng)反转录成cDNA。然后以cDNA为模板进行实时定量PCR,分别检测了U1 RNA、GAPDH RNA、hsa_circ_0082626和CDR1as在细胞质、细胞核中的相对分布量,反应体系同1.3.4。
1.4过表达载体构建及鉴定
1.4.1 序列全长的扩增 针对ZC3HAV1基因的环状RNA hsa_circ_0082626 设 计 引 物 HB-F:5′-CGTACTAATGACTTTTTTTTTATACTTCAGGAATTT ATGCAAATATTCTCATGAGGTTCTCTCAG-3′;HBR:5′-CCTAATTCTTTTCCTTGCTTCTTACCTCTTCTCCATACTGAATCCATGTGCCAG-3′。以细胞的 cDNA为模板进行PCR扩增。PCR反应体系50µL:5×PrimerSTAR Buffer(Mg2+Plus)10 µL,dNTP Mixture(2.5 mmol/L each)4µL,上、下游引物(10µmol/L)各 1.25 µL,cDNA 模板 1 µL,PrimerSTAR HS DNA Polymerase(2.5 U/µL)0.5 µL ,ddH2O 32 µL。PCR扩增条件:94℃预变性5 min;98℃变性30 s,56℃退火5 s,72℃延伸2 min,共35个循环;72℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳后,用DNA快速纯化回收试剂盒回收目的片段。
1.4.2 重组表达载体构建与鉴定 将回收的目的片段和线性化pHB-circBasic载体无缝克隆拼接,反应体系20µL:hsa_circ_0082626目标产物100 ng,线性化 pHB-circBasic载体 1µL,HB-infusion Master Mix(2×)10µL,ddH2O up to 20 µL。50 ℃孵育25 min,转化DH5α感受态。将重组载体与感受态细胞混合,冰上放置30 min,42℃热激90 s,加入、LB培养基,37℃恒温摇床孵育45 min。4℃,92xg离心2 min,去部分上清(约留150~200µL)后混匀,将细胞悬液均匀涂布到含有氨苄的LB固体培养基中培养、筛选16 h,挑选阳性单菌落,接种于含氨苄的LB液体培养基(约5~6 mL),37℃ 摇床培养16 h,培养液质粒提取。将PCR鉴定后进行1%琼脂糖凝胶电泳检测,目的条带大小正确的质粒送公司测序。测序结果正确的重组质粒,-20℃保存备用。
1.4.3 细胞转染 HEK293T细胞转染采用PEI转染方法:将处于对数生长期的293T细胞接种到6孔板中,观察细胞形态,待细胞覆盖率约90% 时,配置DNA-PEI稀释液:使用Opti-MEM培养基稀释DNA,同时加入3倍体积的PEI,充分混合,室温静置15 min。将含有DNA-PEI的Opti-MEM稀释液逐滴加入到培养板中,摇动培养板混匀,培养箱中培养5~6 h。转染12 h后,更换完全培养基,培养箱中继续培养待检测。
1.4.4 RT-qPCR检测环状RNA表达效果 转染24、48和72 h后分别收集以转染重组质粒的细胞为过表达组、未经转染的细胞作为阴性对照组,Trizol法提取细胞总RNA,反转录合成cDNA,以反转录得到的cDNA为模板进行实时定量PCR,反应体系同1.2.5。
2 结 果
2.1 hsa_circ_0082626反向剪切位点的PCR及测序鉴定环状RNA hsa_circ_0082626可经反向剪接,使6号外显子3′末端连接到3号外显子5′端而形成环状结构,见图1。琼脂糖凝胶电泳结果显示,扩增出了包含反向剪接位点的大小为136 bp的片段,见图2。测序结果进一步证实这一结论,箭头左侧为ZC3HAV1基因6号外显子末尾序列右侧为3号外显子的起始序列,见图3。
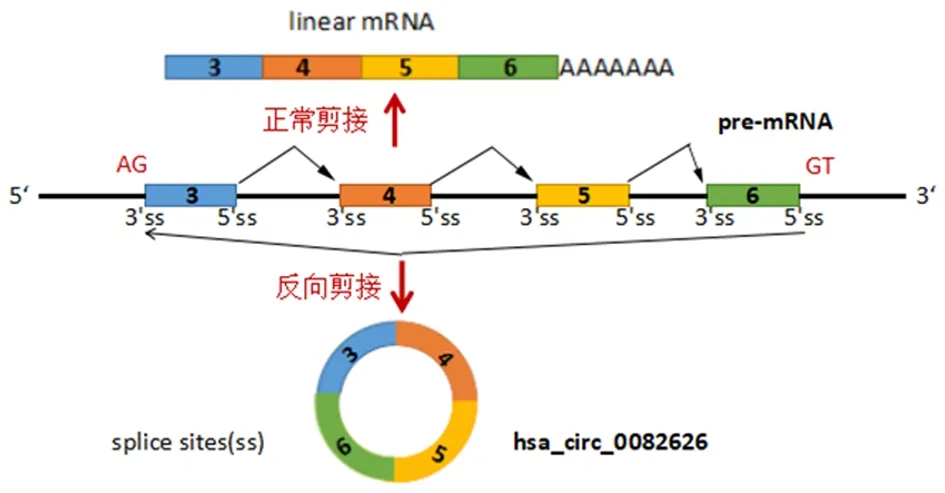
图1 环状RNA hsa_circ_0082626产生示意图Figure 1 Schematic shows that generation of circular RNA hsa_circ_0082626

图2 hsa_circ_0082626的反向剪切位点的qPCR产物的凝胶电泳结果Figure 2 Gel electrophoresis shows the back-splicing junction of hsa_circ_0082626 amplified by qPCR
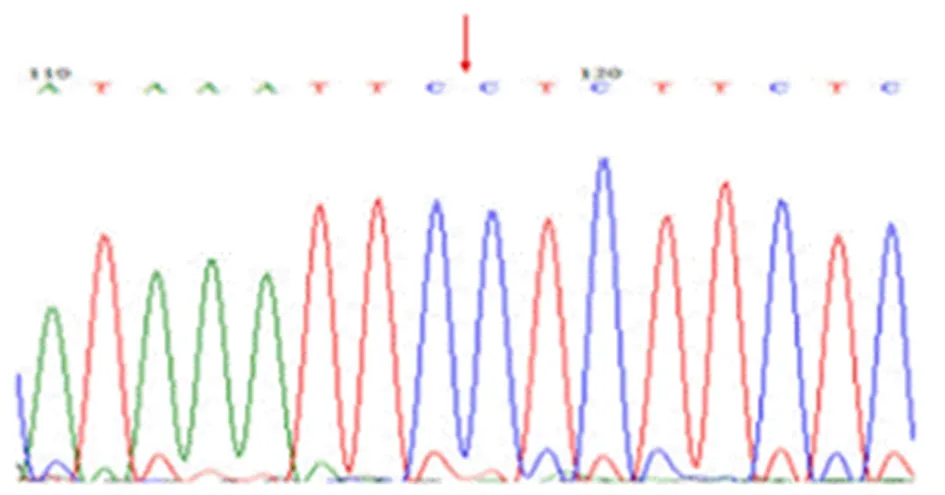
图3 hsa_circ_0082626反向剪切位点经sanger测序验证Figure 3 Verification of the back-splicing junction of hsa_circ_0082626 by sanger sequencing
2.2 hsa_circ_0082626抵抗RNase R消化与对照组比较,RNase R处理组ZC3HAV1、CDR1as、GAPDH表达均显著升高(P<0.05),见表1。
2.3 hsa_circ_0082626主要分布在细胞质中结果表明:U1 snRNA在细胞核中表达更高,hsa_circ_0082626、CDR1as、GAPDH 在细胞质中表达更高。见表2。
2.4 hsa_circ_0082626过表达载体的构建及鉴定
通过PCR扩增了hsa_circ_0082626的序列全长,经琼脂糖凝胶电泳检测,目的片段大小分别约1564 bp,结果与预期相符。将构建的重组质粒,经PCR扩增鉴定显示,hsa_circ_0082626重组质粒在约1564 bp处检测到目的条带,与预期结果相符。见图4。进行测序分析后,经过比对发现,插入的序列与目标RNA hsa_circ_0082626序列相同,说明重组的环状RNA表达载体构建成功。
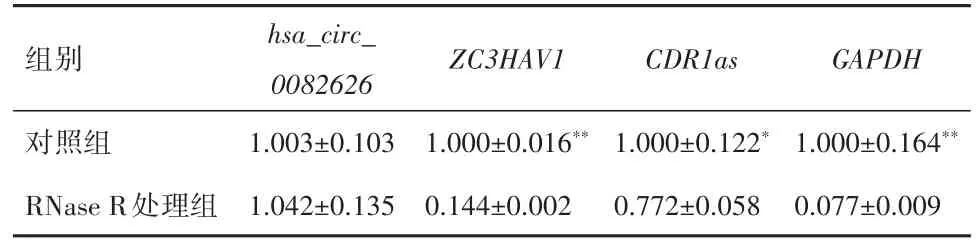
表1 环状RNA hsa_circ_0082626在RNase R处理组与对照组中的相对表达量比较(xˉ±s)Table 1 The relative expression of circular RNA hsa_circ_0082626 in RNase R treated group and control group(xˉ±s)

表2 hsa_circ_0082626、U1 snRNA、GAPDH以及CDR1as在细胞质、细胞核中的表达量的比较(xˉ±s)Table 2 Distribution of hsa_circ_0082626、U1 snRNA、GAPDH and CDR1as in cytoplasm and nucleus(xˉ±s)
2.5 hsa_circ_0082626过表达效果检测结果显示,过表达组的hsa_circ_0082626表达量明显较阴性对照组明显增高,而且在转染48 h时的表达量最高(表达量约为对照组的1000倍)。见图5。
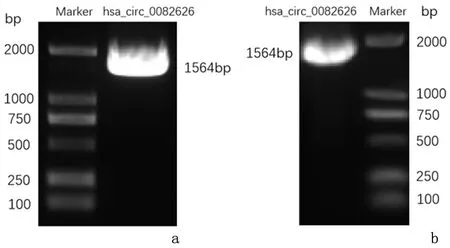
图4 凝胶电泳显示的PCR产物鉴定Figure 4 Gel electrophoresis shows the PCR identification
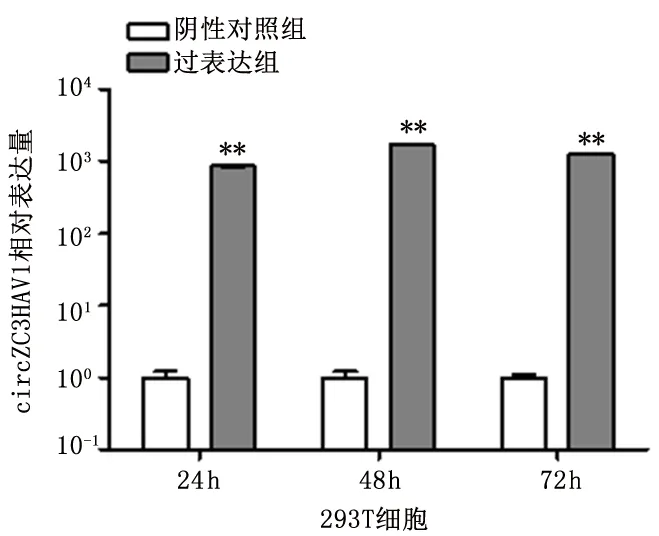
图5 阴性对照组和过表达组hsa_circ_0082626表达的比较Figure 5 Expression analysis of hsa_circ_0001426 by qRT-PCR aftertherecombinantplasmids were transfected to HEK293T cells
3 讨 论
目前,对于抗病毒基因ZC3HAV1所产生的环状RNA仅被检测出,并没有详细关注,因此本文首次关注到了来源于ZC3HAV1基因的环状RNA hsa_circ_0082626,并研究分析了环状RNA hsa_circ_0082626的基本特征以及成功构建了hsa_circ_0082626的过表达载体。同时,结合其来源的抗病毒基因ZC3HAV1的已知信息和功能以及已有的研究报道,分析了hsa_circ_0082626可能发挥的功能及机制,为进一步的深入研究提供基础。
经过对hsa_circ_0082626反向剪切位点的PCR扩增验证及测序验证,进一步结合RNaseR处理实验,证明了hsa_circ_0082626比线性的mRNA更能抵抗Ranse R消化作用,说明hsa_circ_0082626确实首尾相接,正确成环。经过对hsa_circ_0082626全长序列的扩增及测序,通过数据库比对,hsa_circ_0082626是由 NM_020119.3的3、4、5、6号外显子经过反向剪接而成,剪切点前后的序列分别是AG和GT,也正符合环状RNA产生的剪切规律[14]。NM_020119.3一共有1到13号外显子,其编码的锌指抗病毒蛋白ZAP(L)有N-端CCCH结构域(包含4个CCCH锌指模块)、TPH或TiPARP同源结构域(保守存在于ZAP的旁系同源中且包含第五个锌指模块)、WWE结构域(预测可调节泛素和ADP-核糖结合蛋白之间特定的蛋白-蛋白相互作用)和C-端PRAP样结构域。CCCH锌指模块直接参与病毒RNA的结合,而C-端PRAP样结构域(由10-13号外显子编码而来)则可增强ZAP蛋白的抗病毒能力[15]。组成hsa_circ_0082626的3、4、5、6号外显子编码N端CCCH结构域中的后两个CCCH锌指模块和 TPH 或 TiPARP 同源结构域[15],如果 hsa_circ_0082626具有翻译的潜能,则提示hsa_circ_0082626可能具有CCCH锌指模块、TPH或TiPARP同源结构域和中间连接区域的功能。当然对于hsa_circ_0082626是否具有翻译的潜能以及其详细的功能还需要进一步深入的研究。
研究表明,环状RNA与病毒之间存在相互作用,可影响病毒复制、增殖的过程。如有研究通过RNA测序分析发现,在Vero细胞中,类人猿病毒40病毒感染后有134个环状RNA表达明显变化[16];类似的,Hu等[17]也发现在家蚕胞质型多角体病毒感染后的蚕中肠组织中有400个环状RNA表达明显变化。在环状RNA与病毒复制过程中的作用机制相关研究中,Jost等[18]在研究中阐述了他们通过人为设计的环状RNA(具有microRNA-122的结合位点),可与microRNA-122的相互作用抑制丙肝病毒蛋白的产生;也有研究发现成熟的环状RNA可与NF90/NF110(抗病毒免疫相关的反式作用蛋白因子)直接结合形成circRNP,并在抗病毒过程中发挥重要的免疫功能[19]。本研究中,从实验结果可以看到U1 RNA主要分布于细胞核,而GAPDH RNA主要分布于细胞质,说明本实验中细胞质、细胞核RNA的分离是成功的。因此,从结果可见,hsa_circ_0082626主要是分布于细胞质中的,因此我们推测hsa_circ_0082626可能是通过与microRNAs(主要在细胞质中)的相互作用而发挥功能的,已有较多的研究叙述了环状RNA与microRNAs的相互作用(即microRNA 海绵)[3,5,20],此外microRNAs在病毒复制、增殖中的作用,也有研究进行了阐述[21]。
circRNA研究当前还处于起步阶段,大量cricRNA的功能研究还未涉及,以及对于表达量较低的环状RNA,通过构建过表达载体,以此进行获得潜在功能的研究则是不可缺少的。因此我们构建了hsa_circ_0082626的过表达载体,并用qPCR检测了hsa_circ_0082626在293T细胞中的过表达效果;我们的结果显示,在3个不同时间段,hsa_circ_0082626过表达载体以及作为阳性对照的circPC过表达载体均在48 h时表达量最高。总的来说,我们利用无缝克隆策略成功构建了环状RNA hsa_circ_0082626的过表达载体,结果显示,该载体可在细胞中高效表达hsa_circ_0082626,从而为进一步开展hsa_circ_0082626的功能获得性研究奠定了基础。

