miR-509靶向Rac1调节人肝癌LM3细胞侵袭和迁移及裸鼠模型的存活*
王春玲,张荣芳,陈峰杰,周 露,姬颖华
(河南护理职业学院1护理系,2教务处,3药理学教研室,4基础护理教研室,河南 安阳 455000;5新乡医学院第一附属医院,河南 卫辉 453100)
肝癌是最常见的恶性肿瘤之一,亚洲和非洲是肝癌的高发区[1-2]。据统计,2015年,我国约有4 292 000例肝癌新发病例,2 814 000例肝癌死亡病例,并且发病率呈逐年上升的趋势[3]。虽然近年来对于肝癌的诊断和治疗水平有所提高,但肝癌患者的5年内生存率依然很低[4]。高复发率是导致肝癌患者术后死亡的主要原因,并且肿瘤细胞转移的具体分子机制还不清楚[5-6]。因此,探究肝癌细胞转移的分子机制是寻找新的肝癌诊断及治疗方法、增加肝癌患者生存时间及存活率的关键。大量研究表明,微小RNAs(microRNAs,miRNAs,miR)在细胞生长、增殖、凋亡和迁移过程中具有重要的调控作用,同时也可通过调控蛋白编码基因的表达影响癌症的发生和发展[7-8]。研究表明,人体有超过60%的蛋白质编码基因上都具有miRNAs的结合位点[9]。miR-509是具有抑癌作用的miRNA,能够抑制乳腺癌、卵巢癌和肺癌等多种肿瘤的转移[10-12]。也有研究表明,miR-509高表达能抑制肝癌细胞生长[13]。但miR-509对肝癌细胞侵袭和迁移能力的影响还未见报道。本文以人肝癌细胞株LM3为研究对象,探究miR-509对肝癌的作用及作用机制。
材 料 和 方 法
1 试剂与仪器
DMEM细胞培养液、0.25%胰酶和胎牛血清均购自Gibco;miR-509模拟物(miR-509 mimic)和pcDNA Ras相关的C3肉毒毒素底物1(pcDNA Ras-related C3 botulinum toxin substrate 1, pcRac1)由上海吉玛生物设计合成;Matrigel购自Invitriogen;抗Rac1抗体和辣根过氧化物酶标记的山羊抗小鼠II抗购自Abcam(货号分别为ab33186和ab6789); RIPA裂解液购自Sigma(货号为R0278);BCA试剂盒购自碧云天生物科技公司;Lipofectamine 2000转染试剂盒购自Thermo Fisher(货号为11668500);Dual-Luciferase®报告基因试剂盒购自Promega(货号为E1910)。
2 方法
2.1细胞培养 人肝癌细胞株LM3购自中国科学院细胞库。用含有10%胎牛血清的DMEM培养液培养LM3细胞。培养条件为37 ℃、5% CO2。细胞融合率达到85%以上时用0.25%胰酶进行消化传代。
2.2细胞转染 将细胞传代培养于12孔板中,细胞密度为1×108/L。将细胞随机分为LM3组、miR-509 mimic组、mimic+pcDNA组和mimic+pcRac1组。将细胞培养24 h后,根据转染试剂盒说明书采用Lipofectamine 2000转染miR-509 mimic和pcRac1到LM3细胞。转染4 h后更换正常培养液进行培养,48 h进行相关检测。
2.3Western blot实验 用RIPA蛋白裂解液于冰上提取各组细胞或组织蛋白,用BCA试剂盒检测各组蛋白浓度并调平。每组取等量蛋白质用12% SDS-PAGE分离蛋白后,转移蛋白质到PVDF膜。用5%脱脂牛奶室温封闭蛋白质2 h,以1∶1 000的浓度加入抗Rac1抗体,4 ℃孵育过夜。第2天弃去 I 抗,用缓冲液清洗PVDF膜后,加入 II 抗,室温封闭1 h后,滴加ECL于暗室曝光显影。实验至少重复3次,以GAPDH为内参照。
2.4萤光素酶报告基因实验 通过生物信息预测Rac1在miR-509序列上的结合片段,用RT-PCR扩增此结合片段,将该片段插入到pMIR-Report萤光素酶载体中,构建Rac1野生质粒;利用基因位点突变技术将结合片段中部分核苷酸突变,构建Rac1突变质粒。用Rac1野生质粒或突变质粒与miR-509 mimic对LM3细胞进行共转染,根据Dual-Luciferase®报告基因试剂盒说明书检测各组萤光素酶活性。
2.5Transwell实验 将转染后细胞传代接种于提前用Matrigel包被的Transwell小室上层,细胞密度为4×108/L,用不含胎牛血清的培养液培养,Transwell小室下层则加入正常细胞培养液。连续培养48 h后用无菌棉签拭去小室上层细胞,用结晶紫将迁移至小室下层的LM3细胞染色,每组随机选取5个视野对染色细胞进行基数统计。实验至少重复3次,每组6个复孔。
2.6划痕实验 实验前1 d用标记笔于12孔板背面画出5条平行直线,消毒灭菌后备用。将LM3细胞以1×109/L的密度传代培养于提前准备好的12孔板中,用miR-509 mimic和pc Rac1转染细胞后,用10 μL枪头垂直于培养板背面的横线划痕,用PBS清洗3次后,用无血清的DMEM培养液继续培养24 h,随机选取5个视野,检测肝癌细胞迁移情况。
2.7肝癌裸鼠移植瘤(patient-derived xenograft,PDX)模型的建立 60只SPF级4周龄雄性BALB/c裸鼠购自北京维通利华实验动物公司,许可证号为SCXK (京) 2014-0001。将裸鼠适应性喂养1周后进行实验。用慢病毒转染构建稳定高表达miR-509的LM3细胞。将裸小鼠随机分为LM3组和miR-509 mimic组。收集细胞并将细胞密度调整至5×109/L,于miR-509组小鼠右前部背部皮下注射稳定表达miR-509的LM3细胞悬液,LM3组小鼠于相同位置注射未转染的LM3细胞。连续饲养30 d,每天记录小鼠存活情况,计算小鼠存活率,存活率(%)=存活小鼠数/每组小鼠总数×100%。
3 统计学处理
采用统计学软件SPSS 19.0对实验结果进行统计分析,组间差异采用单因素方差分析(one-way ANOVA),两组间比较采用t检验。所有实验结果均以均数±标准差 (mean±SD) 表示,以P<0.05为差异有统计学意义。
结 果
1 miR-509对肝癌细胞Rac1表达的影响
与LM3组比较,miR-509 mimic组和mimic+pcDNA组LM3细胞Rac1蛋白表达水平明显降低(P<0.05);与mimic+pcDNA组比较,mimic+pcRac1组细胞的Rac1 表达水平显著升高 (P<0.05),见图1,提示miR-509可能可靶向调控Rac1的表达。

Figure 1.The effect of miR-509 on the expression of Rac1 in LM3 cells. Mean±SD.n=6.*P<0.05vsLM3 group;#P<0.05vsmimic+pcDNA group.
图1 miR-509对肝癌细胞Rac1蛋白表达的影响
2 miR-509与Rac1的靶向关系
生物信息预测结果表明,miR-509序列上存在Rac1的连续结合序列。萤光素酶报告实验结果表明,miR-509 mimic能显著减弱Rac1野生质粒的萤光素酶活性(P<0.05);结合位点突变后,miR-509 mimic对Rac1突变质粒萤光素酶活性的调控作用消失,见图2,表明miR-509可靶向结合Rac1。
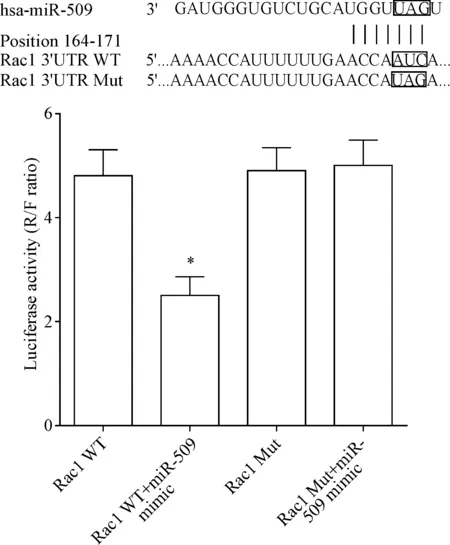
Figure 2.The relationship between miR-509 and Rac1 determined by luciferase reporter assay. Mean±SD.n=6.*P<0.05vsRac1 WT group.
图2 miR-509与Rac1的靶向关系
3 miR-509对肝癌细胞侵袭能力的影响
Transwell实验结果表明,与LM3组比较,miR-509 mimic组和mimic+pcDNA组侵袭细胞数明显减少(P<0.05); 与mimic+pcDNA组比较,mimic+pcRac1组侵袭细胞数明显增多(P<0.05),见图3,表明miR-509可通过抑制Rac1表达降低肝癌细胞侵袭能力。
4 miR-509对肝癌细胞迁移能力的影响
与LM3组比较,miR-509 mimic组和mimic+pcDNA组肝癌细胞划痕愈合率明显降低(P<0.05);用miR-509 mimic和pcRac1同时转染细胞后,细胞划痕愈合率显著升高,与mimic+pcDNA组比较差异有统计学意义(P<0.05),见图4。
5 miR-509对肝癌模型小鼠存活率及对肿瘤组织Rac1表达的影响
与LM3组比较,miR-509 mimic组裸鼠存活率明显升高(P<0.05),见图5,表明miR-509 mimic能促进肝癌模型小鼠存活。同时,miR-509 mimic还能显著降低肿瘤组织Rac1的表达水平(P<0.01),见图6,表明miR-509可能通过抑制Rac1表达促进肝癌模型小鼠存活。
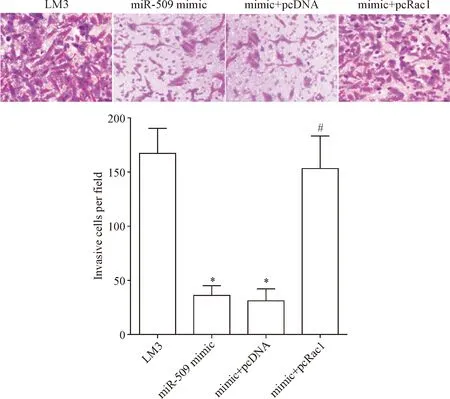
Figure 3.The effect of miR-509 on the invasion ability of LM3 cells determined by Transwell assay (×200). Mean±SD.n=6.*P<0.05vsLM3 group;#P<0.05vsmimic+pcDNA group.
图3 miR-509对肝癌细胞侵袭能力的影响
Figure 4.The effect of miR-509 on the migration of LM3 cells determined by wound healing assay (×100). Mean±SD.n=6.*P<0.05vsLM3 group;#P<0.05vsmimic+pcDNA group.
图4 miR-509对肝癌细胞迁移能力的影响
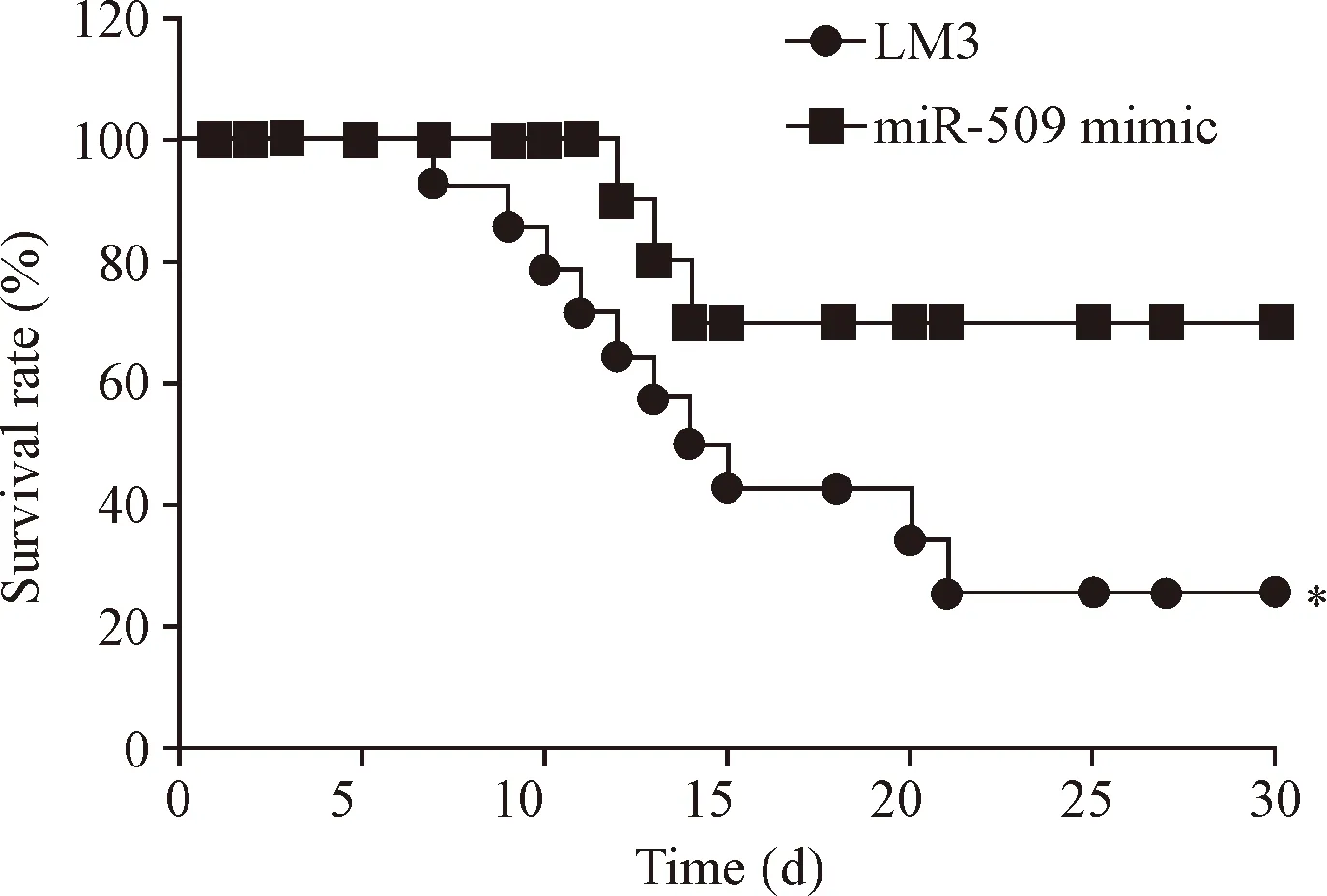
Figure 5.The effect of miR-509 on the survival of hepatocellular carcinoma model mice. Mean±SD.n=15.*P<0.05vsLM3 group.
图5 miR-509对肝癌模型小鼠存活率的影响

Figure 6.The effect of miR-509 on the expression of Rac1 in tumor tissue of hepatocellular carcinoma measured by Western blot. GAPDH was used as loading control. Mean±SD.n=8.**P<0.01vsLM3 group.
图6 miR-509对肝癌肿瘤组织Rac1表达的影响
讨 论
大量研究表明,miRNAs在多种生物学过程中发挥重要作用,包括细胞生长、分化及迁移等[14]。miRNAs在多类肿瘤中的异常表达表明miRNAs可能与肿瘤的发生也密切相关。如microRNA-204和microRNA-30c-2-3p在乳腺癌中表达异常降低[15-16];microRNA-301a和microRNA-484在乳腺癌中表达升高[17];microRNA-192和microRNA-506等在结肠癌细胞中表达水平低于正常结肠细胞[18-19]。miR-509等在肝癌细胞中也呈低表达状态,但关于miR-509对肝癌侵袭和转移能力的作用及作用机制还未见报道[13]。Chen等[20]的研究表明,miR-509-3p可通过靶向调控凋亡蛋白Bcl-2的表达增强顺铂诱导的卵巢癌细胞凋亡的作用。miR-509还可通过调控PODXL抑制胃癌细胞侵袭和迁移[21]。本文采用miR-509 mimic提高miR-509在肝癌细胞LM3中的表达水平发现,miR-509 mimic能抑制肝癌细胞侵袭和迁移,同时还能促进肝癌皮下移植瘤模型小鼠的存活,表明miR-509在肝癌中发挥着抑癌的作用。
此外,miR-509 mimic能显著降低肝癌细胞中Rac1的蛋白表达水平,pcRac1能减弱miR-509 mimic对Rac1表达的抑制作用,提示miR-509可能可靶向抑制肝癌细胞LM3 Rac1的表达。通过生物信息预测发现miR-509基因序列上存在Rac1的靶向结合位点,萤光素酶报告基因实验进一步表明miR-509可靶向结合Rac1。
Rac1是调控细胞骨架重组的关键调控分子,在细胞运动过程中发挥着至关重要的作用[22]。研究表明,Rac1的表达水平和活性在多类肿瘤中均明显升高,能促进肿瘤的转移[23]。研究发现,Rac1与肺癌患者的预后密切相关,抑制Rac1活性可抑制肺癌细胞转移[24-25]。已有研究表明miR-509-3p可通过靶向调控Rac1表达抑制肺癌细胞增殖[26]。长链非编码RNA可通过抑制miR-509表达上调Rac1活性,从而促进骨肉瘤癌细胞转移[27]。本文研究发现,上调Rac1的表达能显著减弱miR-509 mimic对肝癌细胞侵袭的抑制作用,表明miR-509抑制肝癌细胞侵袭的作用与下调Rac1表达有关。此外,pcRac1能明显减弱miR-509 mimic对肝癌细胞迁移的抑制作用,进一步表明miR-509可通过靶向抑制肝癌LM3细胞Rac1的表达抑制癌细胞的转移。
综上所述,miR-509能抑制肝癌细胞Rac1表达,并能抑制肝癌细胞侵袭和迁移,上调Rac1表达能明显减弱miR-509对肝癌细胞侵袭和迁移的抑制作用。本文对miR-509对肝癌细胞侵袭和迁移的作用和作用机制进行探讨,可能为临床寻找治疗肝癌及减缓肝癌发展的方法提供了新的思路。
——一道江苏高考题的奥秘解读和拓展

